扩展功能
文章信息
- 刘起勇
- LIU Qi-yong
- 寨卡病毒媒介伊蚊控制策略和措施展望
- Prospects on Zika virus vector control measures and strategy
- 中国媒介生物学及控制杂志, 2016, 27(2): 93-98
- Chin J Vector Biol & Control, 2016, 27(2): 93-98
- 10.11853/j.issn.1003.8280.2016.02.001
-
文章历史
- 收稿日期: 2016-2-29
当前,寨卡(Zika)病毒感染已成为国际社会关注的焦点[1, 2]。2016年2月1日,世界卫生组织(WHO)将寨卡病毒升级为全球紧急公共卫生事件[3]。我国幅员辽阔,生态多样性高,寨卡病毒的传播媒介埃及伊蚊(Aedes aegypti)和白纹伊蚊(Ae. albopictus)分布广泛[4];加之近年来我国与国外交流日益频繁,截至3月24日,我国大陆累计报告13例境外输入寨卡病毒感染病例。为更好地指导我国寨卡病毒媒介伊蚊防控工作,本文对寨卡病毒媒介伊蚊控制技术和策略进行了展望。
1 疫情概况 1.1 全球疫情寨卡病毒属于黄病毒科黄病毒属的单股正链RNA病毒,主要经由媒介伊蚊叮咬传播的一种蚊媒病毒。该病毒首次于1947年在乌干达发热的猕猴体内分离,一年后从非洲伊蚊中分离,1952年从乌干达和坦桑尼亚的人体成功分离。2007年,首次在太平洋岛国密克罗尼西亚联邦雅浦岛出现暴发疫情。2013年以来,有疫情及出现暴发疫情的国家数量呈现增加趋势,特别是2015年以来开始于智利、巴西等国家的寨卡病毒病疫情在美洲地区迅速传播、蔓延。
根据WHO更新态势简报,2007年以来,全球共有55个国家或地区有寨卡病毒流行的证据(截至2016年3月9日,图 1),其中2015年以来,报告寨卡病毒病本地传播病例的国家或地区41个(图 1),有间接证据表明存在本地传播的国家或地区6个;近期未报告病例、但曾经证实寨卡病毒传播的国家或地区5个;以及出现本地病例、但尚无蚊媒传播疫情的国家或地区3个(美国)。在报告寨卡病毒病本地传播病例的51个国家或地区中,WHO美洲区有32个[5]、东南亚区3个[6]、西太区12个、非洲区2个[7]及欧洲区2个。
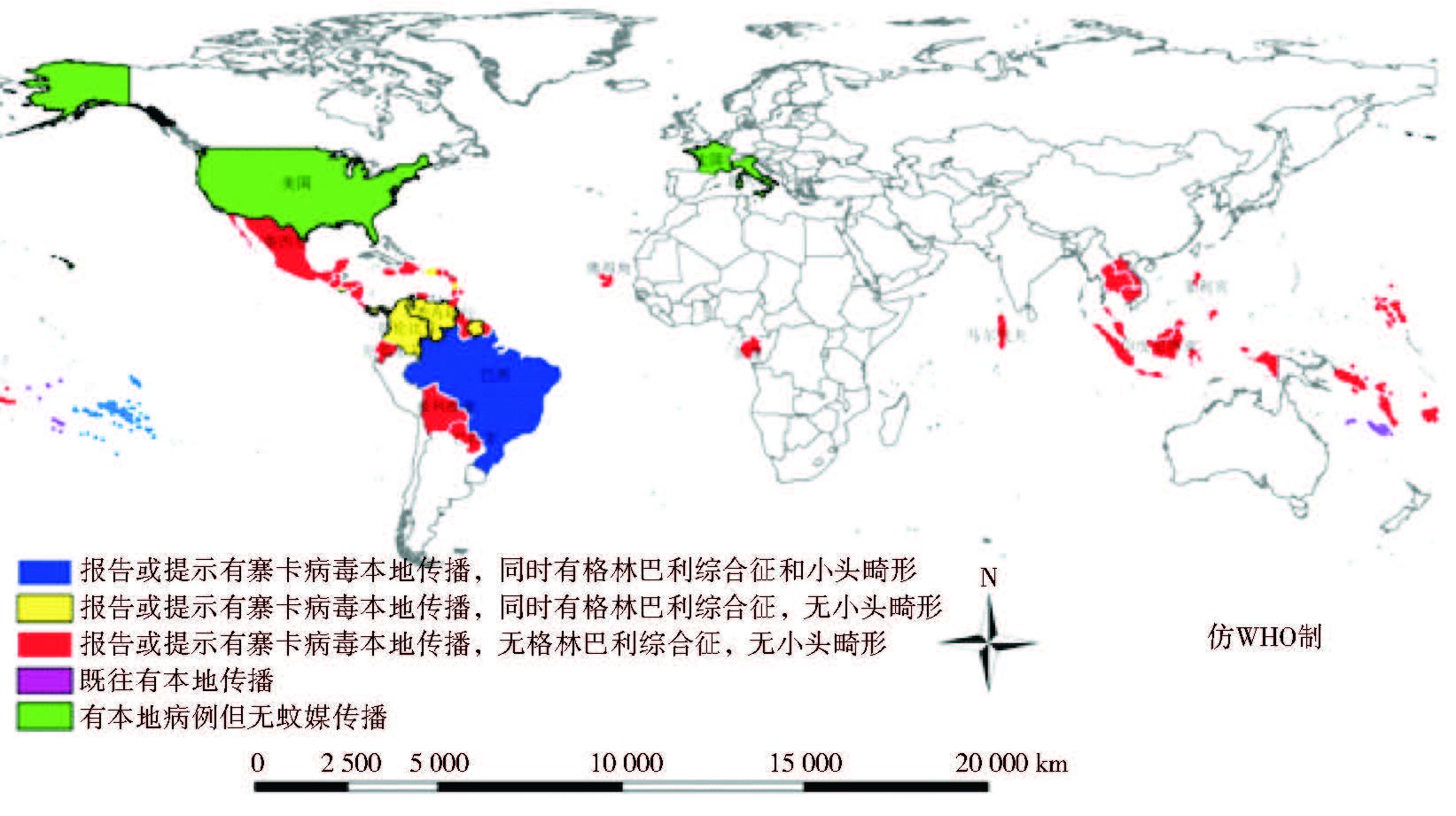
|
| 图 1 2007-2016年全球寨卡病毒病地理分布(截至2016年3月9日) Figure 1 Countries and territories with transmission of Zika virus, 2007-2016(Up to March 9, 2016) |
自2016年2月9日我国确诊首例经委内瑞拉输入性寨卡病毒感染病例以来,当前我国大陆已确认13例寨卡病毒感染的输入病例,尚无本地感染病例。然而,由于我国与寨卡病毒病高发国家存在比较密切的人员、货物往来,不排除疫情通过寨卡病毒感染者或带病毒蚊虫输入的可能,因此,我国存在寨卡病毒疫情再次输入的风险。随着天气转暖气温逐渐升高,我国一些地方将陆续进入媒介伊蚊活跃期,一旦有寨卡病毒病疫情输入,不排除在局部地区传播扩散的可能。
2 传染源和传播媒介 2.1 传染源患者、隐性感染者和感染寨卡病毒的非人灵长类动物。 2.2 寨卡病毒流行区主要媒介
目前,寨卡病毒的主要传播媒介为埃及伊蚊[8],次要媒介为白纹伊蚊[9, 10]、非洲伊蚊(Ae. africanus)、黄头伊蚊(Ae. luteocephalus)[11]等7种伊蚊属蚊虫[9, 12, 13],Anopheles coustani、Mansonia uniformis和Culex perfuscus[12]也曾经报道携带病毒。埃及伊蚊广泛分布于全球热带地区,是城市型黄热病、登革热和登革出血热的重要媒介蚊虫,是国际公认最危险蚊虫之一。白纹伊蚊已成为过去20年间全球扩散速度最快的100种物种之一,已从起源地亚洲扩散至全球70多个国家。
2.3 中国寨卡病毒主要媒介中国存在可传播寨卡病毒的埃及伊蚊和白纹伊蚊[10]。其中,根据监测及文献资料,埃及伊蚊主要分布于海南省沿海市(县)及火山岩地区、广东省雷州半岛、云南省西双版纳州[14]、德宏州、临沧市[15]和台湾地区嘉义县以南及澎湖县部分地区。这些地区不仅是寨卡病毒病,也是登革热、基孔肯雅热等本地传播高风险地区。根据中国疾病预防控制中心(CDC)传染病预防控制所白纹伊蚊边界调查及媒介伊蚊监测发现,当前白纹伊蚊在我国分布区为:北至沈阳、大连,经天水、陇南,至西藏墨脱一线及其东南侧大部分地区(图 2)[4]。随着全球气候变化[16, 17]、城市化、贸易及交通运输业快速发展等影响[15],我国媒介伊蚊及其传播疾病的分布范围将进一步北扩[4],寨卡病毒病的风险地区和人群将显著增加,需引起高度关注。巴基斯坦埃及伊蚊分布区北扩可能与快速城市化、贸易和旅行等因素有关[18]。

|
| 图 2 我国寨卡病毒病媒介埃及伊蚊和白纹伊蚊分布 Figure 2 The distribution map of Aedes aegypti and Ae. albopictus in China |
约为5~15 d,平均10 d。 3 寨卡病毒媒介伊蚊控制策略及技术 3.1 控制策略 2004年WHO提出《媒介生物综合治理全球策略框架》[19],指出应当合理利用人力、财力以及组织机构等多种资源,强化社区参与,确保媒介控制可持续性。同时强调,有效控制媒介伊蚊不仅是卫生部门的责任,也需要其他各部门、公立或私人机构和科研机构的合作,制定行之有效的公共卫生法规与管理制度,以确保综合治理策略具体措施的落实。
当前,我国的病媒生物控制遵循媒介生物综合治理基础上的可持续控制策略[20, 21]。该策略支持系统包括可持续监控技术、管理措施、人力资源及财政支出等4个模块,从社会、经济和自然方面协调人与自然的和谐发展,以人为本,控制病媒传播疾病的发生,减少病媒生物对人群的骚扰,提高居民的生活质量;同时保护环境和媒介的敏感性,实现人与自然和谐发展。
由于寨卡病毒病与登革热、基孔肯雅热、黄热病传播媒介基本相同,均主要由媒介伊蚊叮咬传播[22, 23]。依据我国登革热防控策略并结合我国的实际情况,寨卡病毒病媒介伊蚊防控应采用基于可持续控制理念和登革热控制经验的控制策略,具体如下:
3.1.1 媒介伊蚊日常监测控制在我国寨卡病毒病不同风险区埃及伊蚊和白纹伊蚊的活动季节,开展媒介伊蚊监测,虽未出现寨卡病毒病疫情但布雷图指数≥20时,当地政府要组织开展爱国卫生运动,在重点区域(如城区、城郊结合部)的重点地点(如居民区、公共场所及其他人群密集地点)进行预防性灭蚊,清除室内外媒介伊蚊的孳生地,将布雷图指数控制在20以下,降低寨卡病毒病输入后的传播风险。各地要开展媒介伊蚊抗药性监测,指导科学合理用药。在寨卡病毒病高风险地区每年至少开展1次抗药性监测,其他地区每两年至少开展1次抗药性监测。
3.1.2 媒介伊蚊应急监测控制在我国寨卡病毒病不同风险区的媒介伊蚊活动季节,出现输入或本地感染寨卡病毒病病例时,以疫点为圆心的200 m半径核心区布雷图指数≥5、警戒区(核心区外展200 m半径范围)≥10、其他区域布雷图指数≥20时,应启动媒介伊蚊应急控制。在核心区和警戒区,应根据媒介伊蚊抗药性监测结果选取敏感卫生杀虫剂进行疫点成蚊杀灭,结合重点部位的滞留喷施和蚊虫孳生地清理。当地政府要组织开展爱国卫生运动,全民动员做好蚊虫孳生地清理工作,告知居民做好个人防护、病例和医院防蚊隔离。通过媒介伊蚊综合防控措施[24],尽快将布雷图指数控制在5以下,控制传播和扩散风险。寨卡病毒病控制应从暴发后控制规模和强度,向暴发前开展伊蚊监控,降低伊蚊密度,控制暴发风险的可持续模式转变[20]。
做好寨卡病毒病的联防联控至关重要。根据国家卫生和计划生育委员会(卫计委)最新信息,我国2月1日正式启动应对寨卡病毒病疫情联防联控工作机制,由国家卫计委牵头,明确了“密切关注、防控为主、科学应对”的原则,坚持“以防控疫情输入为主、以专群结合预防为主、以重点地区防控为主”的“三防为主”的防控策略。
3.2 控制技术 3.2.1 成蚊控制 3.2.1.1 物理防治主要是通过使用纱门、纱窗、蚊帐等传统防蚊工具,并提醒居民于媒介伊蚊活动高峰时段外出时要穿浅色的长袖、长裤等衣服防止伊蚊叮咬。有条件的地方可以使用药浸蚊帐进行更好的个人防护。
3.2.1.2 化学防治在寨卡病毒病暴发时,使用化学杀虫剂快速杀灭成蚊是控制疫情最有效的措施之一。超低容量喷雾和滞留喷洒技术是实现这一目标的重要手段。对于超低容量喷雾的定义,国家推荐标准《病媒生物化学防治技术指南空间喷雾(GB/T 31714-2015)》中,将雾滴直径<30 μm的喷雾称之为超低容量喷雾;1980年出版的《WHO媒介生物学及防制技术访华团资料选编》(中央爱国卫生运动委员会)中,有关超低容量的灭蚊资料《媒蚊防制中使用的超低容量喷雾器和杀虫剂(朱成璞译)》,将喷洒方式分为3种:高容量、低容量和超低容量,根据用药量的不同,将超低容量喷雾定义为施药量0.23~2.4 L/hm2;美国Mount将超低容量喷雾定义为直接喷洒未稀释的杀虫剂,施药量达到最低,但对灭蚊超低容量喷雾最适合的雾滴为ø 8~15 μm[25]。滞留喷洒主要用于室内和重点场所成蚊杀灭,例如病房、患者居住房间、绿化带、阴凉场所和社区卫生死角等。能进行滞留喷洒的喷雾器包括压缩喷雾器、机动泵式喷雾机、背负式手动喷雾器、踏板式喷雾器等,可根据拟处理面积的大小或高度选择单用或兼用。
寨卡病毒病疫点处置时,室外成蚊杀灭应以超低容量喷雾为主,配合重点场所的滞留喷洒;室内成蚊杀灭以滞留喷洒为主,重点场所在滞留喷洒的同时还需要进行超低容量喷雾。关于喷雾器械,目前超低容量喷雾机包括车载超低容量喷雾机、便携式超低容量喷雾机、烟雾机等多种类型。喷雾器械的选择需与环境相匹配,并注意喷施时的气象条件。车载超低容量喷雾机适合外环境大范围速杀成蚊;便携式超低容量喷雾机适合速杀室内蚊虫,以及室外车辆无法进入的地方的成蚊,是车载超低容量喷雾机的补充;烟雾机穿透力强,适合树林、竹林、灌木丛等植物比较密集的地方蚊虫速杀。此外,超低容量喷雾对于施药时的气象条件也有相应的要求,理想状态为风速1~4 m/s,当风速>4 m/s时,无法进行室外超低容量喷雾。超低容量喷雾时要求地面气流较小,或气流无垂直运动,或仅接近地表的气流有些流动。此外,利用驱避剂进行防护对于寨卡病毒病疑似及确诊病例非常重要,临床医生应告知寨卡病毒病疑似及确诊病例使用驱避剂防护及自我防护。
3.2.1.3 遗传防治通过遗传操纵可以减少或替代目标蚊虫种群,改变其作为病媒的特性。早在30多年前,研究者就通过改变媒介昆虫染色体产生大量绝育雄虫,将其释放到野外以抑制蚊媒种群数量或降低某蚊媒传播疾病的效能。利用蚊虫细胞共生菌-沃尔巴克氏体(Wolbachia)是另一种遗传操控的策略。70多年前Wolbachia首先在淡色库蚊(Culex pipiens pallens)的卵巢和睾丸中发现,其广泛分布于无脊椎动物,可感染多种昆虫但未发现其感染脊椎动物。感染Wolbachia雌蚊可与所有雄蚊交配(包括已感染和未感染Wolbachia雄蚊),其后代全部感染
清除伊蚊孳生地一直是伊蚊防制的根本措施,采用环境改造和环境处理等手段实现。伊蚊孳生地主要包括饮水缸、储水池或缸、花瓶、花盆等功能性积水容器,闲置的瓶、罐、缸等容器积水,市政管网的管井、地下室集水井、楼房反墚、竹筒、树洞、植物叶腋、雨水沟及绿化带的塑料薄膜等。环境处理时尽量清除伊蚊孳生地,对于无法清除的孳生地投放灭蚊幼剂以防蚊虫孳生。例如,饮用水容器或功能性容器积水要求严密加盖,每5~7 d换水1次;种养水生植物的花瓶,每5~7 d换水1次,冲洗植物根部,彻底洗刷容器内壁;公园、学校、园林景点的竹筒、树洞要用灰沙等堵塞,或对留根的竹筒,采用“十”字砍刀法,使其有裂缝不再积水;轮胎要求叠放整齐并存放在室内或避雨的场所,如堆放室外,要用防雨布严密遮盖,不积雨水。如不能有效遮盖,需对废弃轮胎进行打孔处理,防止积水。
3.2.2.2 化学防治对于不能清除的孳生地可以使用双硫磷、倍硫磷、吡丙醚等化学杀虫剂进行处理,例如密闭市政管网管道井、地下室或地下车库集水井、建筑工地积水等。徐仁权等[27]通过实验研究和现场试验证实1 mg/L吡丙醚可用于孳生地的伊蚊控制。与此同时,随着居民健康及低碳环保意识增强,卫生杀虫剂产业在追求高效的同时,应更多关注对环境的影响。传统的化学杀虫剂由于抗药性产生使其应用受到极大的限制。生物源(昆虫天敌防治、虫生真菌、昆虫致病菌、生物代谢产物)、植物源、微生物源及昆虫生长调节剂等鉴于其靶标专一性强、不易产生抗性、环境友好,具有许多化学合成农药无可比拟的优势,为未来研发重点方向[28]。多杀菌素(spinosad)是在刺糖多孢菌(Saccharopolyspora spinosa)发酵液中提取的一种大环内酯类无公害高效广谱的生物农药,杀虫活性远远超过有机磷、氨基甲酸酯、环戊二烯和其他杀虫剂,对有益昆虫的高度选择性,广泛应用于埃及伊蚊和白纹伊蚊的杀灭。墨西哥南部一项研究发现,多杀菌素对于白纹伊蚊和埃及伊蚊幼虫控制非常有效[29]。
3.2.2.3 生物防治(1)病原体:用病原体防制蚊虫的研究很多,其中细菌是应用最为广泛、研究最为深入的一类生物杀虫剂。细菌中具有良好生物效应并大规模生产的主要为苏云金杆菌以色列变种(Bti)。Bti属于革兰阳性菌,可以形成芽孢,同时在其体内会形成数个具有杀虫活性的晶体。晶体内含物是原毒素,在适当宿主肠内,它很快转化为有毒物质,引起蚊虫中肠细胞解体而死亡。经过生物测定发现,伊蚊对Bti制剂敏感性最高,继而是库蚊和按蚊[30],幼龄比老龄幼虫更为敏感。常用Bti剂型为悬乳剂和可湿性粉剂,但该种剂型投入水体后很快下沉,被水底的污泥吸附,不利于伊蚊取食,因此效果持续时间较短,一般只有3~5 d[31],基于上述不足,国内研制了漂浮颗粒剂、块剂和发泡剂,其中块剂在现场试验中杀灭白纹伊蚊可以持效15 d[32]。近年来,有公司开发出苏云金杆菌水扩散颗粒剂,与传统的悬乳剂比较,这种新剂型稳定性更好,便于运输,且容积密度更低,易于在水中扩散,使用更方便[33]。基于Bti目前出现了一种新的生物防治技术,该技术的核心就是将Bti的水扩散颗粒通过液氮加工成为一种名为“冰珠”的物质,然后通过直升飞机进行大面积的喷洒[34]。由于其活性成分包埋于冰珠内,在喷洒过程中不会受到摩擦而损失,该剂型会在水表面融化并释放出杀蚊毒蛋白晶体,且易于穿透孳生地的各种水草遮蔽物,效果良好。
(2)捕食性天敌:应用天敌控制媒介伊蚊需要有适宜的自然条件、丰富的天敌资源和适合应用环境为基础。蚊幼虫的捕食性天敌很多,通常是指鱼、剑水蚤、巨蚊、水螅、涡虫、负子虫、松藻虫等,但应用最早和最广泛的是鱼类。常用鱼类包括柳条鱼、金鱼、鲤鱼、鲫鱼、中华斗鱼、非洲鲫鱼等。黄健人等[35]比较了几种不同方法防制埃及伊蚊,发现以水缸养鱼效果最好。剑水蚤广泛分布于自然界多种淡水中,其繁殖力强,嗜食蚊幼虫,是有应用潜力的蚊虫捕食性天敌。越南学者在伊蚊孳生场所投放剑水蚤,最终成功控制了整个社区埃及伊蚊密度[36]。Nam等[37]在越南登革热流行区应用剑水蚤、划椿和鱼类控制埃及伊蚊幼虫密度,从而有效遏制了登革热流行。
(3)寄生物:蚊虫寄生物中研究较多的是大链壶菌(Lagenidium giganteum),它在寄生阶段游动孢子附着在蚊幼虫体壁,菌丝在血腔中生长而导致宿主在短期内死亡。苏晓庆等[38]利用大链壶菌进行庭院灭蚊实验,发现投放一次后,连续18 d内该菌对白纹伊蚊和致倦库蚊(Culex pipiens quinquefasciatus)均有显著效果。另一种蚊虫寄生物罗索线虫对库蚊和伊蚊有较强的感染力,但由于罗索线虫感染蚊幼虫时间长,且对高龄蚊幼虫感染率不高,它们与宿主蚊幼虫关系也受密度的制约。
(4)转基因工程蓝藻:蓝藻在幼虫孳生地广泛存在,是蚊幼虫的食物之一。可将Bti与球形芽孢杆菌(Bs)杀虫毒素基因转入蓝藻中,使杀虫工程蓝藻在蚊虫孳生地杀灭蚊幼虫。朱嵩等[39]观察转苏云金杆菌CrylVD基因蓝藻对不同蚊幼虫杀灭效果,发现其对白纹伊蚊幼虫杀灭效果较高,48 h对白纹伊蚊的杀灭率达100%,且对低龄幼虫的杀灭效果高于高龄幼虫。
3.3 WHO及成员国寨卡病毒病媒介控制措施 3.3.1 WHO总部相关措施2016年2月1日,WHO将寨卡病毒病升级为全球紧急公共卫生事件[3]。寨卡病毒病暴发后,WHO与成员国正在采取一系列措施进行媒介伊蚊控制。WHO不同区域的合作中心已经开展了媒介伊蚊监测与控制技术培训。WHO还支持成员国卫生主管部门执行蚊媒控制战略,对难以清洗、倒空及覆盖的积水用杀幼剂处理。在寨卡疫情流行地区居住或旅行者,WHO建议其尽可能避免皮肤暴露,穿着浅色、长袖、稍显宽松衣裤,衣物面料较为紧密最为理想。鉴于寨卡病毒和新生儿小头症之间可能的关联,WHO于2月10日发布了针对女性的寨卡病毒预防指导,强调防范蚊虫叮咬是女性,特别是孕妇预防感染寨卡病毒的最佳途径。
3.3.2 WHO美洲区相关措施巴西国家生物安全委员会最近批准在全国各地大量释放转基因埃及伊蚊。通过在伊蚊DNA中插入一种自我毁灭基因,该基因会制造一种蛋白质,称“四环素可抑制活化剂变体”(tTAV),可阻碍细胞运作,并阻止对生存有关键作用的其他基因的表达。美国CDC建议,在美国环境保护署注册认证的驱蚊液中,含有避蚊胺、派卡瑞丁、伊默宁和柠檬桉叶油这4种成分的驱蚊产品效果最为理想。美国儿科学会建议,避蚊胺含量在10%~30%的驱蚊产品对儿童和成年人均安全,2个月以下的婴儿最好不要使用含有该成分的驱蚊产品。可根据户外停留时间的长短,选择不同避蚊胺浓度的驱蚊产品。避蚊胺浓度30%的驱蚊液有效时间可达6 h。
3.3.3 WHO西太区相关举措我国国家卫计委在发布的《寨卡病毒病防控方案(第一版)》中提出控制媒介密度是预防控制寨卡病毒病最重要的措施。对于媒介监测与控制,分日常监测与控制、应急监测与控制两个方面,并对媒介控制要点及技术进行了阐述,并于近日组织相关专家对该方案进行了修订完善。此外,2月23日,中国CDC召开了寨卡病毒病疫情应急响应工作会,对于寨卡病毒病媒介伊蚊的监测控制进行相关部署。
4 展 望随着全球气候变化[17]和城市化等因素影响,社会经济及人文因素变化,寨卡病毒媒介伊蚊分布区域不断扩大,寨卡病毒病暴发流行风险进一步增加,很有可能会在全球更广范围内传播与蔓延[40],媒介伊蚊防控任重而道远。亟待提高对寨卡病毒病媒介蚊虫防控工作的认识,加大媒介蚊虫防控人力、财力、物力投入,规范媒介蚊虫监测工作,开展种群分布及抗药性调查、新技术在寨卡病毒病媒介伊蚊防控中的应用及效果评价,并且加强媒介伊蚊可持续控制策略的研究、应用及验证等工作。及时跟踪国际疫情发展趋势,不断更新及调整我国寨卡病毒病媒介伊蚊的控制策略,切实保障依法、科学及有效开展寨卡病毒病防控工作。
| [1] | Samarasekera U, Triunfol M. Concern over Zika virus grips the world[J]. Lancet,2016,387(10018):521-524. |
| [2] | Musso D, Cao-Lormeau VM, Gubler DJ. Zika virus: following the path of dengue and chikungunya?[J]. Lancet,2015,386(9990):243-244. |
| [3] | Gulland A. Zika virus is a global public health emergency, declares WHO[J]. BMJ,2016,352:i657. |
| [4] | Wu F, Liu QY, Lu L, et al. Distribution of Aedes albopictus(Diptera: Culicidae) in northwestern China[J]. Vector Borne Zoonotic Dis,2011,11(8):1181-1186. |
| [5] | Yakob L, Walker T. Zika virus outbreak in the Americas: the need for novel mosquito control methods[J]. Lancet Global Health,2016,4(3):e148-149. |
| [6] | Brown C. Zika virus outbreaks in Asia and South America[J].CMAJ,2016,188(2):e34. DOI:10.1503/cmaj.109-5212. |
| [7] | Chen LH, Hamer DH. Zika virus: rapid spread in the Western Hemisphere[J/OL]. Ann Intern Med,2016[2016-02-02]. DOI:10.7326/M16-0150. |
| [8] | Marchette NJ, Garcia R, Rudnick A. Isolation of Zika virus from Aedes aegypti mosquitoes in Malaysia[J]. Am J Trop Med Hyg,1969,18(3):411-415. |
| [9] | Wong PS, Li MZ, Chong CS, et al. Aedes (Stegomyia)albopictus(Skuse): a potential vector of Zika virus in Singapore[J]. PLoS Negl Trop Dis,2013,7(8):e2348. |
| [10] | Grard G, Caron M, Mombo IM, et al. Zika virus in Gabon (Central Africa)-2007: a new threat from Aedes albopictus?[J].PLoS Negl Trop Dis,2014,8(2):e2681. |
| [11] | Haddow AJ, Williams MC, Woodall JP, et al. Twelve isolations of Zika virus from Aedes (Stegomyia) africanus (Theobald) taken in and above a Uganda forest[J]. Bull World Health Organ,1964,31(1):57-69. |
| [12] | Ayres CFJ. Identification of Zika virus vectors and implications for control[J]. Lancet Infect Dis,2016,16(3):278-279. |
| [13] | Ledermann JP, Guillaumot L, Yug L, et al. Aedes hensilli as a potential vector of Chikungunya and Zika viruses[J]. PLoS Negl Trop Dis,2014,8(10):e3188. |
| [14] | 杨明东,姜进勇,郑宇婷,等. 云南省边境地区埃及伊蚊分布调查[J]. 中国媒介生物学及控制杂志,2015,26(4):406-408. |
| [15] | Wang G, Zhang HD, Cao X, et al. Using GARP to predict the range of Aedes aegypti in China[J]. Southeast Asian J Trop Med Public Health,2014,45(2):290-298. |
| [16] | Chadee DD, Martinez R. Aedes aegypti (L.) in Latin American and Caribbean region: with growing evidence for vector adaptation to climate change?[J]. Acta Trop,2016,156:137-143. |
| [17] | Paz S, Semenza JC. El Niño and climate change-contributing factors in the dispersal of Zika virus in the Americas?[J]. Lancet,2016,387(10020):745. |
| [18] | Fatima SH, Atif S, Rasheed SB, et al. Species distribution modeling of Aedes aegypti in two dengue-endemic regions of Pakistan[J]. Trop Med Int Health,2016,21(3):427-436. DOI: 10.1111/tmi.12664. |
| [19] | WHO. Global strategic framework for integrated vector management[J]. Geneva:World Health Organization,2004: 10-11. |
| [20] | 刘起勇. 媒介生物控制面临的挑战与媒介生物可持续控制策略[J]. 中华流行病学杂志,2012,33(1):1-8. |
| [21] | 姜志宽,吴光华,丁凌云,等. 主要虫媒病的流行概况与媒介防控策略的探讨[J]. 中华卫生杀虫药械,2008,14(6):440-444. |
| [22] | Carneiro LAM, Travassos LH. Autophagy and viral diseases transmitted by Aedes aegypti and Aedes albopictus[J/OL]. Microbes Infect,2016[2016-01-14]. DOI:10.1016/j.micinf.2015.12.006. |
| [23] | Fauci AS, Morens DM. Zika virus in the Americas-yet another Arbovirus threat[J]. New Engl J Med,2016,374(7):601-604. |
| [24] | 肖东楼. 登革热防治手册[M]. 2版. 北京:人民卫生出版社, 2008:44-53. |
| [25] | Mount GA. A critical review of ultralow-volume aerosols of insecticide applied with vehicle-mounted generators for adult mosquito control [J]. J Am Mosq Control Assoc,1998,14(3):305-334. |
| [26] | McMeniman CJ, Lane RV, Cass BN, et al. Stable introduction of a life-shortening Wolbachia infection into the mosquito Aedes aegypti [J]. Science,2009,323(5910):141-144. |
| [27] | 徐仁权,刘红霞,冷培恩,等. 0.5%吡丙醚颗粒剂对白纹伊蚊控制效果的研究[J]. 中国媒介生物学及控制杂志,2010,21(4):297-299. |
| [28] | 王东,王永明,卫春秀,等. 环境友好型卫生杀虫剂的研究进展[J]. 中国媒介生物学及控制杂志,2012,23(5):485-488. |
| [29] | Marina CF, Bond JG, Casas M, et al. Spinosad as an effective larvicide for control of Aedes albopictus and Aedes aegypti, vectors of dengue in southern Mexico[J]. Pest Manag Sci,2011,67(1):114-121. |
| [30] | Foo AE,Yap HH. Comparative bioasssays of Bacillus thuringiensis H-14 formulations against four species of mosquitoes in Malaysia[J]. Southeast Asian J Trop Med Public Health,1982,13(2):206-210. |
| [31] | 喻子牛. 苏云金芽孢杆菌制剂的生产和应用[M]. 北京:农业出版社,1993:248-250. |
| [32] | 张吉斌,明桂珍,袁方玉,等. 苏云金芽孢杆菌以色列变种发泡块剂灭白纹伊蚊幼虫的效果研究[J]. 中国媒介生物学及控制杂志,1997,8(3):169-171. |
| [33] | 薛金伟,姬晨,朱晓博,等. 蚊虫的生物防治[J]. 中国热带医学,2014,14(4):490-495. |
| [34] | Becker N. Ice granules containing endotoxins of microbial agents for the control of mosquito larvae-a new application technique[J]. J Am Mosq Control Assoc,2003,19(1):63-66. |
| [35] | 黄健人,李继龙,王树声,等. 广西清除埃及伊蚊研究[J]. 广西预防医学,2005,11(3):Ⅱ. |
| [36] | Vu SN,Nguyen TY, Kay BH, et al. Eradication of Aedes aegypti from a village in Vietnam, using copepods and community participation[J]. Am J Trop Med Hyg,1998,59(4):657-660. |
| [37] | Nam VS, Yen NT, Holynska M, et al. National progress in dengue vector control in Vietnam: survey for Mesocyclops (Copepoda), Micronecta (Corixidae), and fish as biological control agents[J]. Am J Trop Med Hyg,2000,62(1):5-10. |
| [38] | 苏晓庆,贾少华,许厚明. 大链壶菌灭庭院积水蚊虫的现场实验研究[J]. 菌物系统,1997,16(1):74-77. |
| [39] | 朱嵩,闫歌,刘相萍,等. 转苏云金杆菌CrylVD基因蓝藻实验室杀蚊幼毒效的观察[J]. 中国热带医学,2013,13(8):935-937. |
| [40] | Lucey DR. Time for global action on Zika virus epidemic[J]. BMJ,2016,352:i781. |
 2016, Vol. 27
2016, Vol. 27

