扩展功能
文章信息
- 廖虹瑜, 蒋德勇, 母永贵, 杨小蓉
- LIAO Hong-yu, JIANG De-yong, MU Yong-gui, YANG Xiao-rong
- 巢式PCR及序列分析用于攀枝花市恙虫病东方体检测
- Detection of Orientia tsutsugamushi in Panzhihua city by SN-PCR and sequence analysis
- 中国媒介生物学及控制杂志, 2016, 27(1): 38-41
- Chin J Vector Biol & Control, 2016, 27(1): 38-41
- 10.11853/j.issn.1003.4692.2016.01.011
-
文章历史
- 收稿日期: 2015-10-23
2. 泸州市疾病预防控制中心, 四川 泸州 646699;
3. 米易县疾病预防控制中心, 四川 米易 617200
2. Luzhou Center for Disease Control and Prevention;
3. Miyi Center for Disease Control and Prevention
恙虫病是经恙螨叮咬而传播给人的一种自然疫源性疾病,其病原体为恙虫病东方体(Orientia tsutsugamushi,Ot),以鼠类为主要储存宿主。临床特征为突然起病、发热、患处有焦痂或溃疡、淋巴结肿大、皮疹,发病后一般可自愈,少数病例发生严重并发症甚至死亡[1]。恙虫病主要在亚太地区的热带及亚热带地区流行,以东南亚、远东地区及澳大利亚常见[2]。1985年以来我国恙虫病仅在北纬31°以南的广大地区流行,如台湾、福建、四川、云南、海南等地区。四川省攀枝花市自建市以来一直存在恙虫病的发生和流行,1980年已有恙虫病病例报道[3],但均为临床诊断,未进行实验室检测,本实验室收集攀枝花市48例疑似病例的全血样本,运用巢式PCR检测恙虫病东方体,并对2份巢式PCR阳性样本的Ot sta56基因片段进行序列分析,现将结果报告如下。
1 材料与方法 1.1 样本采集样本来自2013年7-10月攀枝花市疾病预防控制中心采集的恙虫病疑似病例的全血样本,共48份。其中男性21例,女性27例,年龄1~76岁;地域分布:盐边县16例,米易县31例,云南省丽江市1例。采集健康志愿者全血样本作为阴性对照。
1.2 核酸提取采集的全血样本应避免反复冻融。取100 μl血液,使用QIAamp DNA Micro Kit(QIAGEN公司)提取血液基因组DNA,提取的核酸于-30 ℃保存备用。
1.3 巢式PCR检测根据参考文献[4]中检测Ot sta-58编码基因的2对引物进行巢式PCR,引物由英潍捷基(上海)贸易有限公司合成。 巢式PCR反应体系和扩增条件:第一轮PCR反应体系为20 μl加样体系,其中 Green Master Mix 10 μl,ddH2O 7 μl,上游引物F1(10 μmol/L)1 μl,下游引物R1(10 μmol/L)1 μl,模板1 μl。PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,48 ℃退火1 min,72 ℃延伸1 min,35个循环;72 ℃延伸5 min。
取第一轮PCR产物1 μl为模板,进行第二轮PCR扩增。反应体系与扩增条件同第一轮PCR。取第二轮PCR扩增产物5 μl加入2%浓度的琼脂糖凝胶中电泳,GelDoc XR System凝胶成像系统(Bio-Rad公司)检测PCR结果。
1.4 sta56基因片段的扩增及测序随机挑选2份巢式PCR阳性核酸样本,使用传统PCR法检测sta56基因片段并测序。根据Ot 56×103主要外膜蛋白抗原的编码基因,参考文献[5, 6]设计1对引物进行PCR,上游引物OtsuF(5′~3′) AAT TGC TAG TGC AAT GTC TG,下游引物OtsuR (5′~3′) GGC ATT ATA GTA GGC TGA G;扩增产物大小为410 bp。PCR体系和扩增条件:PCR体系为20 μl加样体系,其中Green Master Mix(Promega公司) 10 μl,ddH2O 7 μl,上游引物OtsuF(10 μmol/L)1 μl,下游引物OtsuR(10 μmol/L)1 μl,模板1 μl。PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,57 ℃退火1 min,72 ℃延伸1 min,40个循环;72 ℃延伸5 min。取PCR扩增产物5 μl加入2%浓度的琼脂糖凝胶中电泳,GelDoc XR System凝胶成像系统检测目的条带。
PCR产物使用离心柱型PCR产物纯化试剂盒(北京天为时代有限公司)纯化后,取2 μl进行双向测序反应。使用BigDye Terminator v3.1 Cycle Sequencing Kit(Applied Biosystems)配制13 μl测序反应体系,其中BigDye Sequencing 2 μl,Buffer 2 μl,ddH2O 5 μl,引物OtsuF(10 μmol/L)2 μl或OtsuR(10 μmol/L)2 μl,模板2 μl。扩增条件:96 ℃预变性1 min;96 ℃变性10 s,50 ℃退火5 s,60 ℃延伸4 min,25个循环。测序反应产物以BigDye- XTerminatorTM Purification Kit(Applied Biosystems)进行纯化,3500xL Genetic Analyzer(Applied Biosystems)进行测序,获得Ot sta56基因片段碱基序列。使用Blast软件(http://www.ncbi.nlm.nih.gov/blast/)将序列与GenBank中已知序列进行比对,并运用Clustal X 2.0和Mega 5.1软件以Neighbor-Joining法构建系统发育树。参比序列[7]取自GenBank,收录号为:Karp (M33004)、Kato (M63382)、Boryong (L04956)、Kanda (AF173039)、Kawasaki (M63383)、Kuroki (M63380)、Oishi (AF173037)、Shimokoshi (M63381)、Sxh951 (AF050669)、Taitung-2 (AY335819)、TW461 (AY222631)、Yonchon (U19903)、KM16-1 (GU446597)、T0224198 (HQ718432)、OI05-2 (GU446614)和Zhou/2013 (KJ001163)。
2 结 果 2.1 巢式PCR检测结果本实验运用巢式PCR检测攀枝花市恙虫病疑似病例全血样本中Ot sta-58编码基因,第二轮PCR扩增产物的琼脂糖凝胶电泳结果见图 1,48份全血样本中,巢式PCR检测阳性样本18份(37.50%)。
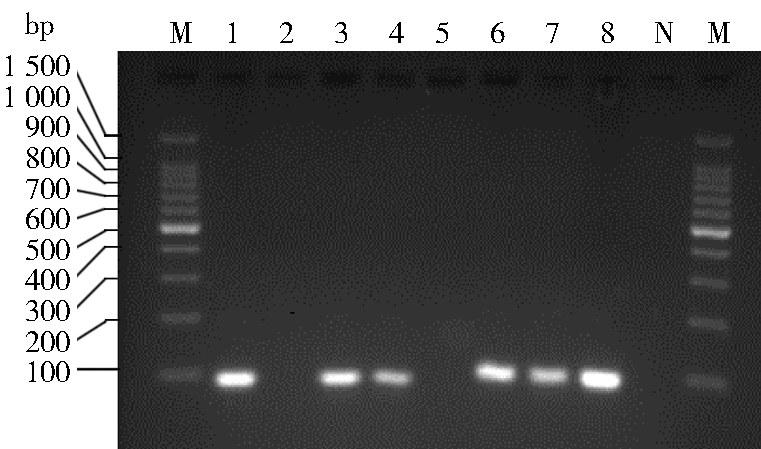
|
| 注:M. 100 bp Ladder Marker;N. 阴性对照;1~8. 血液样本扩 增结果。 图 1 巢式PCR检测Ot电泳结果 Figure 1 The SN⁃PCR detection of O. tsutsugamushi electrophoresis figure |
随机挑选2份样本,编号分别为Panzhihua43和Panzhihua45,扩增sta56基因片段并测序,测序所得序列提交GenBank,获得收录号分别为KP334158和KP334159,测序结果在GenBank中进行Blast比对证实为Ot sta56基因片段,2条序列相似性为95.9%(325/339),Panzhihua43与来自台湾地区的Ot KM16-1株相似性为98.8%(396/401),Panzhihua45与来自浙江省的Ot Zhou/2013株相似性为100%。
Panzhihua43和Panzhihua45株sta56基因片段与Karp、Kato、Boryong、je-cheon、Kanda、Kawasaki等参考株进行同源性比较,构建系统发育树,见图 2。可见Panzhihua43与来自中国台湾地区的KM16-1株、柬埔寨的T0224198株Ot位于同一分支,相似性均高达99.0%。Panzhihua45与来自浙江省的Ot Zhou/2013株位于同一分支,与来自台湾地区的Ot OI05-2株相似性高达99.0%。Panzhihua43和Panzhihua45与Karp株位于同一分支,相似性均为91.0%,提示其基因型为Karp型。
3 讨 论恙虫病是因Ot感染而引起的自然疫源性疾病,鼠类为主要传染源,经恙螨叮咬传播,在我国分布广泛,近年来在全国流行呈上升趋势[8]。目前恙虫病的实验室诊断方法主要分为血清学试验和分子生物学方法。血清学试验主要有外斐氏试验(Weil-Felix)、补体结合试验(CFT)、间接免疫荧光法(IFA)、ELISA等[9]。早期恙虫病诊断主要使用Weil-Felix,虽成本低,易操作,隔夜可获得实验结果,但灵敏度和特异度低[10]。CFT同样用于早期恙虫病诊断,能有效地鉴定出Karp、Kato和Gilliam 3种原始血清型[11],但影响因素复杂,操作繁琐。IFA是目前恙虫病诊断的参考标准检测方法,其灵敏度和特异度均较佳[9]。但是,血清学试验无法克服不同种属之间因具有相同的抗原成分而出现的交叉反应,且无法在抗体产生前作出早期诊断。分子生物学方法的兴起,尤其是PCR技术为恙虫病早期诊断提供强有力的手段。巢式PCR法与传统PCR法相比,具有更好的特异性和灵敏度,能获得更准确的检测结果。四川省攀枝花自建市以来一直有恙虫病流行,恙虫病病例均根据临床症状进行诊断,部分病例临床症状不明显,在初诊时易被误诊为伤寒、支气管肺炎等[3]。四川省恙虫病诊断缺乏特异的实验室诊断依据[12],亟需快速、灵敏、准确的实验室诊断方法。本研究在四川省范围内首次运用巢式PCR法对48份疑似病例血液样本进行Ot检测,其中18份阳性(37.50%),检出率与于昌军等[13]报道相符。
Ot抗原型具有多样性和混合性,Karp株、Kato株和Gilliam株是国际标准株,随着分离鉴定技术的进步,更多东方体类型被分离[11]。我国长江以南地区以Karp型为主,长江以北地区以Gilliam型居多。杨占清等[14]研究表明,1988年山东省费县和济南市等地Ot为Gilliam型。林碧瑚等[15]调查显示,海南岛Ot为Karp型。冯锡光等[16]研究表明,云南省北部金沙江流域Ot流行型别以Karp型为主,其次为Gilliam型,并有少量Kato型存在。亚红祥和王静林[17]研究发现,云南省大理地区恙虫病患者由Ot Karp或者Kato型感染,个别患者可能为Karp+Kato型混合感染,Karp+Kato混合血清型菌株可能在遗传进化上与某些Ot台湾株关系密切。
Ot 56×103蛋白具有型或株特异性,sta56基因通常应用于Ot的型别鉴定。本研究对巢式PCR阳性的2份血液样本扩增到sta56基因片段,其序列分析结果表明,该2株Ot均与某些Ot台湾株关系密切。Panzhihua43与来自中国台湾地区的KM16-1株、柬埔寨的T0224198株Ot位于同一分支。Panzhihua45与来自浙江省的Ot Zhou/2013株及来自台湾地区的Ot OI05-2株关系密切。Panzhihua43、Panzhihua45与Karp株位于同一个分支,提示其基因型为Karp型。冯锡光等[16]研究表明,云南北部金沙江流域Ot流行型别以Karp型为主,攀枝花市地理位置与大理市较接近,地理情况与宿主分布情况也大致相近,本研究也表明攀枝花市存在Karp型Ot。
| [1] | Razak A, Sathyanarayanan V, Prabhu M, et al. Scrub typhus in Southern India: are we doing enough?[J].Trop Doct,2010,40 (3):149-151. |
| [2] | Jeong YJ, Kim S, Wook YD, et al. Scrub typhus: clinical pathologic, and imaging findings[J].Radiographics,2007,27 (1):161-172. |
| [3] | 张洁. 攀枝花恙虫病37例临床分析[J].中国冶金工业医学杂志,1998,15(2):91. |
| [4] | Park HS,Lee JH,Jeong EJ,et al. Rapid and simple identification of Orientia tsutsugamushi from other group rickettsiae by duplex PCR assay using groEL gene[J].Microbiol Immunol,2005,49(6):545-549. |
| [5] | Mahajan SK, Rolain JM, Kashyap R, et al. Scrub typhus in Himalayas[J].Emerg Infect Dis,2006,12(10):1590-1592. |
| [6] | Janardhanan J, Prakash JAJ, Abraham OC,et al. Comparison of a conventional and nested PCR for diagnostic confirmation and genotyping of Orientia tsutsugamushi[J].Diagn Micr Infec Dis, 2014,79(1):7-9. |
| [7] | 刘运喜,张倩,赵仲堂,等. 恙虫病东方体山东分离株Sta56基因全序列扩增及酶切分析[J].中华流行病学杂志,2007,28 (9):886-890. |
| [8] | 张萌,王显军,赵仲堂. 中国恙虫病流行态势及预防控制[J].中华流行病学杂志,2011,32(4):419-423. |
| [9] | 方益荣,叶冬青,朱保平. 恙虫病流行病学研究进展[J].中国农村卫生事业管理,2013,33(4):426-430. |
| [10] | Shishido A. Identification and serological classification of the causativeagent of Scrub typhus in Japan[J].Jpn J Sci Biol, 1962,15:308-321. |
| [11] | Kelly DJ, Fuerst PA, Ching WM, et al. Scrub typhus: the geographic distribution of phenotypic and genotypic variants of Orientia tsutsugamushi[J].Clin Infect Dis,2009,48 Suppl 3:203-230. |
| [12] | 蒋德勇,王静,余卓君,等. 2006-2008年攀枝花市恙虫病流行病学分析[J].中国媒介生物学及控制杂志,2010,21(4): 387-389. |
| [13] | 于昌军,张守印,李国兰,等. 巢式PCR及序列分析用于恙虫病早期诊断的实验研究[J].中国卫生检验杂志,2009,19 (11):2524-2525. |
| [14] | 杨占清,刘运喜,于晓敏,等. 山东省秋冬型恙虫病自然疫源地调查[J].中华流行病学杂志,2000,21(4):283-286. |
| [15] | 林碧瑚,詹志农,王华民,等. 海南岛恙虫病立克次体研究[J].海南医学院学报,2003,9(5):261-264. |
| [16] | 冯锡光,陈渊民,自登云,等. 云南北部金沙江流域恙虫病调查研究[J].中国媒介生物学及控制杂志,2001,12(2): 120-121. |
| [17] | 亚红祥,王静林. 云南大理地区恙虫病血清学诊断及病原体基因序列分析[J].中国人兽共患病学报,2013,29(9): 899-903. |
 2016, Vol. 27
2016, Vol. 27


