扩展功能
文章信息
- 曹玉玺, 赫晓霞, 付士红, 李浩, 梁国栋, 王环宇
- CAO Yu-xi, HE Xiao-xia, FU Shi-hong, LI Hao, LIANG Guo-dong, WANG Huan-yu
- 巴泰病毒实时荧光定量PCR检测方法的建立
- Development of a TaqMan Real-time PCR assay for detection of Batai virus
- 中国媒介生物学及控制杂志, 2016, 27(1): 1-4
- Chin J Vector Biol & Control, 2016, 27(1): 1-4
- 10.11853/j.issn.1003.4692.2016.01.001
-
文章历史
- 收稿日期: 2015-11-23
巴泰病毒(Batai virus,BATV)是布尼亚病毒科(Bnuyaviridae)布尼亚病毒属(Orthobunyavirus)布尼亚姆韦拉(Bunyamwera)血清组的成员,主要分布于亚洲和欧洲,以库蚊和按蚊为主要传播媒介,具有广泛的动物宿主,感染后可引起人类发热和病毒性脑炎症状[1, 2, 3, 4]。BATV于1955年首先分离自马来西亚的库蚊,随后陆续在欧亚多个国家和地区的多种昆虫和哺乳动物中分离到该病毒,并在人、马、牛等血清标本中检测到该病毒抗体[3]。我国于1998年首次从云南省的菲律宾按蚊(Anopheles philippinensis)中分离到1株BATV[5],且该病毒在当地发热患者中的抗体阳性率为4.17%[6],表明自然界和人群中存在BATV感染。布尼亚病毒属成员的基因组为分节段RNA病毒,具有较高的重配可能。已经发现重配产生的BATV新变异株引起多起疾病流行[7, 8, 9, 10],因此,为加强我国对BATV的监测,本研究利用TaqMan实时荧光定量(Real-time)PCR技术建立了针对BATV的特异、快捷、敏感、高效的分子检测方法,为今后BATV的检测和相关研究提供技术手段。
1 材料与方法 1.1 引物、探针与克隆质粒的设计合成选择GenBank发表的BATV全基因组或保守性较高编码非结构蛋白的S片段基因序列,用生物信息学分析软件ClustalX 1.8进行基因的序列比对,根据TaqMan Real-time PCR引物、探针设计原则[11],选择最为保守的区域作为目的基因片段。在此区域内利用Primer Express 3.0(AB公司,美国)辅助设计引物及探针序列,Blast分析验证该片段基因的广谱性和特异性。引物由北京梓熙生物科技有限公司合成,探针由生工生物工程(上海)股份有限公司合成并标记。
1.2 BATV的TaqMan Real-time PCR检测体系每个反应体系中包括2×Reaction Buffer 12.5 μl和Enzyme Mix 1 μl(AB公司,AgPath-IDTM One-step RT-PCR Kit),10 μmol/L上下游引物、5 μmol/L探针各1 μl,RNA模板1 μl,DEPC-treated water将体积补充至25 μl。置于Mx3000P Real time System(Stratagene公司)进行反应,反应条件:45 ℃ 10 min,95 ℃ 10 min,95 ℃ 15 s和60 ℃ 60 s,40次循环。
1.3 检测体系的特异性实验应用的黄病毒科黄病毒属登革热病毒血清1~4型、西尼罗病毒、流行性乙型脑炎病毒(基因Ⅰ型、基因Ⅲ型)、蜱传脑炎病毒和库蚊黄病毒,布尼亚病毒科Tahyna病毒,披膜病毒科甲病毒属盖塔病毒,呼肠孤病毒科的版纳病毒、辽宁病毒共4科9种13株病毒均为本实验室保存。提取BATV的RNA,与上述13株病毒RNA进行BATV TaqMan Real-time PCR检测体系的特异性验证。
1.4 检测体系的标准曲线绘制合成BATV(参考株,巴泰病毒G-20217) 的S片段高度保守区域(198~343 bp)作为检测目的基因,并克隆至PGEM-Teasy载体中。对克隆质粒中目的片段进行普通PCR扩增后回收纯化(QIAgen公司Gel Extraction Kit),利用紫外核酸蛋白定量仪对回收的线性化DNA模板定量,用RiboMAX Large Scale RNA Production System T7(Promega公司)进行RNA体外转录。对阳性质粒体外转录的RNA去除残留DNA模板后,利用紫外核酸蛋白定量仪对转录得到的RNA进行定量,按照公式(6.02×1023)×(转录产物浓度ng/μl)/(转录产物分子质量)=拷贝/μl计算RNA拷贝数。系列稀释得到101~104拷贝/μl 4个样品浓度,进行TaqMan Real-time PCR扩增与分析。根据不同浓度样品的分拷贝数和循环阈值(Ct)绘制标准曲线,构建病毒基因拷贝数定量分析模型。
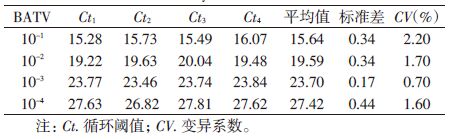
1.5 检测体系的稳定性实验将BATV不同稀释度10-1~10-4的RNA模板样品分别进行4次平行重复检测实验,对得到的实验Ct值进行统计学分析,计算各检测样品Ct值的平均值、标准差及变异系数(CV),以评价检测体系稳定性。
2 结 果 2.1 检测BATV特异的引物与探针设计合成的BATV特异性引物与探针序列信息见表 1,扩增目的片段长度为146 bp,探针5′、3′端分别标记荧光报告基团FAM和荧光淬灭基团TAMRA。
 |
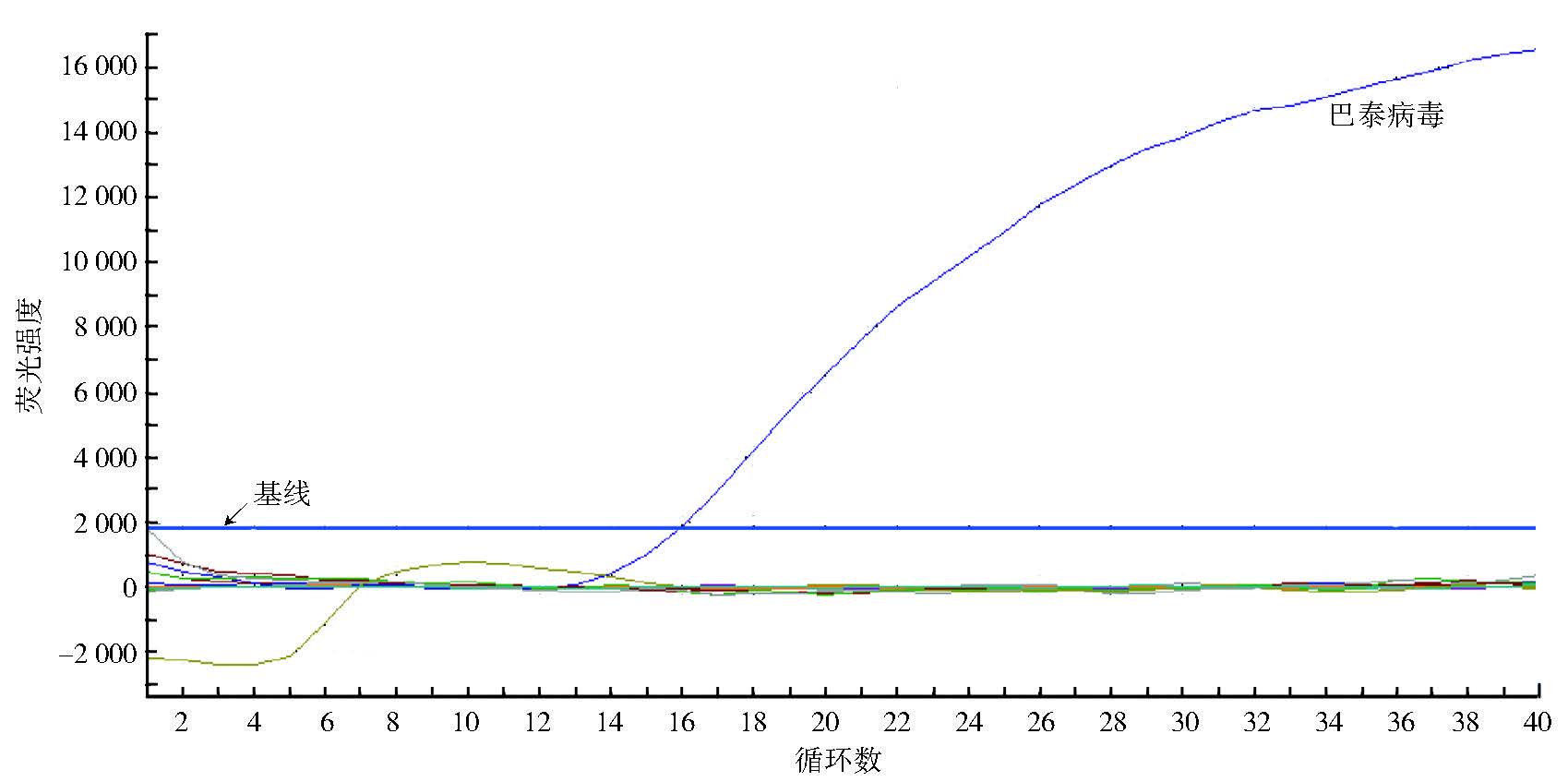
只有BATV的RNA成功扩增,得到阳性结果,其他毒株的RNA均无阳性扩增信号,见图 1。
|
| 注:BATV的RNA有明显扩增;基线下为对照病毒(9种13株)的荧光信号,无明显扩增。 图 1 BATV检测体系特异性验证结果 Figure 1 Results of the specifity test for detection method of BATV |
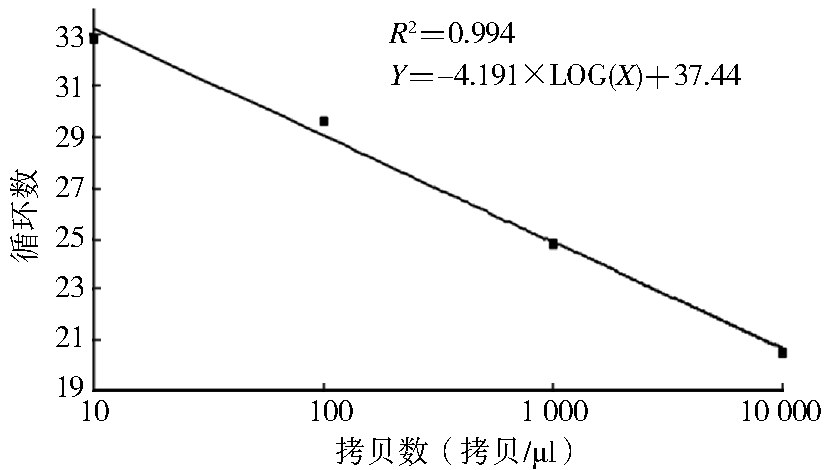
获得检测体系标准曲线方程为Y=-4.191×LOG(X)+37.44,R2=0.994。所建立方法最低检测限为10拷贝/μl,见图 2。
|
| 图 2 BATV基因拷贝数定量分析标准曲线 Figure 2 Quantitative standard curve of BATV based on the genomic copy |
4次平行重复实验Ct值的标准差均<0.50,CV均<2.50%,该检测体系具有良好的稳定性,见表 2。
BATV作为布尼亚病毒科中的重要成员具有显著的分子特征,核酸为单股负链的3片段RNA(L、M、S片段),其中以编码核衣壳蛋白和非结构蛋白的S片段较为保守[12, 13]。因此,本研究针对BATV的S片段最为保守的区域(198~343 bp)建立TaqMan Real-time PCR检测方法,对其特异性、稳定性和敏感性进行了验证与评价,并构建了病毒基因拷贝数定量分析模型的标准曲线方程。实验结果表明,所建立的针对BATV S片段的一步法TaqMan Real-time PCR检测方法具有较高的特异性、稳定性和敏感性。
由于其分子结构特征,BATV很容易与其他布尼亚病毒通过基因重组产生新的“嵌合(mosaic)株”[14, 15],且这些新产生的毒株可引起疾病的流行与暴发[2, 4, 16]。此外,由于其媒介蚊种的广泛,使该病毒具有较大的传播扩散风险,已经在多种动物和人体内查到该病毒的中和抗体[17]。因此,对BATV的调查与研究已经越来越引起人们的重视。章域震等[18]的研究表明,乳小白鼠和幼年小白鼠对BATV高度易感,BHK-21和Vero细胞对BATV敏感,可用于BATV的分离培养和空斑测定,其建立的免疫荧光和空斑减少中和试验可用于BATV的抗体检测。目前,对BATV的检测方法除了上述的病毒分离与病毒抗体检测外,还常用普通PCR扩增基因序列的方法进行病毒核酸的检测与鉴定[5, 6, 13]。
本研究所建立的针对BATV的检测方法是基于RNA为模板的一步法TaqMan Real-time PCR,是一种利用反应体系中实时荧光信号的动态变化,最终通过标准曲线对未知模板进行定量分析的方法[19, 20, 21]。可直接用于多种被检标本提取RNA后的直接检测,不仅缩短了检测时间、实现了对模板的定量、具有更高的灵敏度和特异性,且自动化程度高、污染低,更避免了病毒分离培养中因细胞传代老化、敏感性下降和因病毒无细胞病变增殖现象所产生的实验误差,从而得到更加准确、敏感和有效的定量检测结果。该技术已广泛应用于多种病毒的快速检测[22, 23, 24, 25, 26]。因此,本研究所建立的针对BATV的一步法TaqMan Real-time PCR检测方法为今后进一步开展BATV的分布监测、临床诊断及其相关研究提供了快速便捷的技术手段,从而更好地了解该病毒。
| [1] | 自登云,陈柏权,俞永新. 虫媒病毒与虫媒病毒病[M]. 昆明: 云南科技出版社,1995:261-264. |
| [2] | Waiters LL,Tirrell SJ,Shope RE. Seroepidemiology of California and Bunyamwera serogroup (Bunyaviridae) virus infections in native populations of Alaska [J]. Am J Trop Med Hyg,1999,60(5):806-821. |
| [3] | 王凤田,吕志,王志玉,等. 巴泰病毒研究进展[J]. 中国人兽共患病学报,2009,25(4):365-367. |
| [4] | Briese T, Bird B, Kapoor V, et al. Batai and Ngari viruses: M segment reassortment and association with severe febrile disease outbreaks in East Africa[J]. J Virol,2006,80(11):5627-5630. |
| [5] | 陶三菊,张海林,杨冬荣,等. 云南省澜沧江下游地区虫媒病毒的调查研究[J]. 中华实验和临床病毒学杂志,2003,17(4):322-326. |
| [6] | 黄文丽,张海林,侯宗柳,等. 云南省西双版纳发热病人血清虫媒病毒抗体调查[J]. 地方病通报,2001,16(2):29-30. |
| [7] | Korobeinikova AS,Nafeev AA, Skvortsova TM. Specific markers for the detection of circulation of Tahyna, Inko and Batai viruses (Bunyaviridae, Bunyavirus) in humans, mosquitoes, ticks and cattle of the Ul’ianovsk region[J]. Vopr Virusol,2003,48(1):45-46. |
| [8] | Nashed NW, Olson JG, el-Tigani A. Isolation of Batai virus (Bunyaviridae:Bunyavirus) from the blood of suspected malaria patients in Sudan[J]. Am J Trop Med Hyg,1993,48(5):676-681. |
| [9] | Shcherbakova SA, Golovinskaia ON, Kliueva EV, et al. Antiarbovirus antibodies positive serum screening in population of Saratov[J]. Vopr Virusol,2002,47(3):32-34. |
| [10] | L’vov SD, Gromashevski VL, Kanev EF, et al. The circulation of viruses of the California encephalitis and Bunyamwera groups (Bunyaviridae, Bunyavirus) on the northeastern Russian plain [J]. Vopr Virusol,1991,36(1):31-34. |
| [11] | Livak KJ, Flood SJA, Marmaro J, et al. Oligonucleotides with fluorescent dyes at opposite ends provide a quenched probe system useful for detecting PCR product and nucleic acid hybridization[J]. PCR Methods Applicat,1995,4(6):357-362. |
| [12] | Yadav PD,Sudeep AB,Mishra AC,et al. Molecular characterization of Chittoor (Batai) virus isolates from India[J]. Indian J Med Res,2012,136(5):792-798. |
| [13] | 付士红,孙肖红,王环宇,等. 我国首次分离巴泰病毒的分子生物学鉴定[J]. 中华实验和临床病毒学杂志,2005,19(4):331-334. |
| [14] | Cheng LL, Rodas JD, Schultz KT, et al. Potential for evolution of California serogroup bunyaviruses by genome reassortment in Aedes albopictus [J]. Am J Trop Med Hyg,1999,60(3):430-438. |
| [15] | Borucki MK, Chandler LJ, Parker BM, et al. Bunyavirus superinfection and segment reassortment in transovarially infected mosquitoes[J]. J Gen Virol,1999,80(12):3173-3179. |
| [16] | Gerrard SR, Li L, Barrett AD, et al. Ngari virus is a Bunyamwera virus reassortant that can be associated with large outbreaks of hemorrhagic fever in Africa[J]. J Virol,2004,78(16):8922-8926. |
| [17] | CDC. Virus Name/Prototype#[EB/OL].(2010-06-17)[2012-12-01]. http://www.cdc.gov/arbocat/catalog-listing.asp?VirusID=52&SI=1. |
| [18] | 章域震,张海林,杨卫红,等. 巴泰病毒云南株生物学性状研究[J]. 中国人兽共患病学报,2013,29(6):527-532. |
| [19] | Heid CA, Stevens J, Livak KJ, et al. Real time quantitative PCR[J]. Genome Res,1996,6(10):986-994. |
| [20] | Bustin SA. Quantification of mRNA using real-time reverse transcription PCR (RT-PCR): trends and problems[J]. J Mol Endocrinol,2002,29(1):23-39. |
| [21] | 欧阳松应,杨冬,欧阳红生,等. 实时荧光定量PCR技术及其应用[J]. 生命的化学,2004,24(1):74-76. |
| [22] | 徐丽宏,曹玉玺,何丽芳,等. Banna 病毒TaqMan探针法RT-PCR检测方法的建立[J]. 中华实验和临床病毒学杂志,2006,20(1):47-51. |
| [23] | Santhosh SR, Parida MM, Dash PK, et al. Development and evaluation of SYBR GreenⅠ-based one-step real-time RT-PCR assay for detection and quantitation of Japanese encephalitis virus[J]. J Virol Methods,2007,143(1):73-80. |
| [24] | 张强,唐青,刘卫滨,等. 狂犬病毒TaqMan PCR 检测方法的建立[J]. 中华流行病学杂志,2006,27(10):889-892. |
| [25] | 刘卫滨,付士红,宋宏,等. 乙型脑炎病毒TaqMan PCR 检测方法的建立及初步应用[J]. 中华微生物学和免疫学杂志,2005,25(8):656-662. |
| [26] | 赫晓霞,何英,付士红,等. Kadipiro病毒TaqMan Real-time PCR检测方法的建立[J]. 中华实验和临床病毒学杂志,2013,27(6):480-482. |
 2016, Vol. 27
2016, Vol. 27