文章信息
- 陈胤忠
- CHEN Yin-zhong
- 我国沿海地区医学媒介生物及其所致传染病分布状况
- The distribution of the medical vectors distribution and its spreading infectious diseases in the coastal areas of China
- 中国媒介生物学及控制杂志, 2015, 26(6): 637-640
- Chin J Vector Biol & Control, 2015, 26(6): 637-640
- 10.11853/j.issn.1003.4692.2015.06.027
-
文章历史
- 收稿日期: 2015-06-25
- 网络出版时间: 2015-10-14 14:57
沿海开发战略是我国长期坚定不移贯彻执行的国家发展战略,其中沿海滩涂的开发是极其重要的一环。沿海滩涂开发涉及港口、产业、城镇互动发展,进而推动区域集聚发展。在沿海滩涂开发过程中对生态环境的影响,尤其是生态环境对人类健康的影响显得十分重要。生态环境中对人类健康有直接影响的医学媒介生物,后者包括医学昆虫、啮齿类动物等。医学昆虫不仅能传播多种虫媒性疾病,而且还可叮刺吸血、严重骚扰和影响居民的正常工作与生活。啮齿类动物可通过携带大量的医学昆虫作为媒介传播病毒、立克次体、细菌、螺旋体和原虫等多种病原体引起虫媒传染病。为阐述我国沿海地区医学媒介生物及其所致传染病的研究现况,及时研究沿海开发过程中医学媒介生物对居民健康的影响,从而有助于预警媒介传染病流行的风险和制订有效的预防控制策略提供科学依据,进而保证和促进沿海地区的经济发展和社会稳定,保障广大居民的身体健康,现综述如下。
1 沿海地区医学媒介生物分布沿海地区不但有广袤的滩涂湿地与自然保护区,更有日益发展的口岸、工业区和港城。掌握上述不同生境医学媒介生物的分布,对预防和控制媒介生物性传染病尤其重要。王海军等[1]对中国口岸医学媒介生物区系研究表明,口岸的 医学媒介生物从1980 年的7 类(鼠、蚤、蚊、蝇、蜱、螨、蜚蠊)327种,到2006年增加至11 类760 种,新增430 余种。说明随着对外开放的深入,伴随着国际间交通工具、货物、进出境人员的剧增,无疑加大了医学媒介生物和病媒传染病传入传出的概率和风险。吴争鸣等[2]调查江苏省射阳县新洋港滩涂湿地盐城国家级珍禽自然保护区内外蚊虫密度及蚊种组成,自然保护区中华按蚊(Anopheles sinensis)占60.6%,淡色库蚊(Culex pipiens pallens)占37.1%,三带喙库蚊(Cx. tritaeniorhynchus)占2.2%。居民区淡色库蚊占76.1%,中华按蚊占20.3%,三带喙库蚊占3.5%,骚扰阿蚊(Armigeres subalbatus)占0.1%。自然保护区蚊虫总数占总捕获数的92.0%,居民区占8.0%。保护区优势蚊种为中华按蚊,居民区为淡色库蚊。保护区7月中、下旬和9 月中旬为蚊虫密度高峰期,蚊虫密度与气温变化呈正相关(r=0.765,P=0.005),表明滩涂湿地是中华按蚊和淡色库蚊的适宜孳生地,应当重视蚊媒对有关重要病原传播潜能的监测研究。
2 啮齿类动物及其寄生虫传播的传染病 2.1 肾综合征出血热(HFRS)沿海地区可能存在的啮齿动物包括黑线姬鼠(Apodemus agrarius)、小家鼠(Mus musculus)、褐家鼠(Rattus norvegicus)、黄胸鼠(R. tanezumi)、黑家鼠(R. rattus)和食虫动物臭鼩鼱(Suncus murinus)等。其中,野外以黑线姬鼠所占比例居多,生活区以小家鼠和褐家鼠居多。上述动物主要通过其寄生的螨传播而至人感染HFRS。感染的形式以散发为主,暴发疫情一般见于大型工地且有大量人员涌入而防制措施未到位的情形[3]。如江苏省大丰市“竹川围垦工程”,围垦土地面积4000 hm2,垦期约110 d,民工约4万人,施工期间发生HFRS暴发,发生病例63例,罹患率为157.5/10万;死亡1例,病死率为1.59%[4]。传播HFRS为革螨,主要通过叮咬而感染,且通过实验证实[5, 6]。邓小昭等[7]应用地理景观和血清流行病学方法对东南沿海地区HFRS的流行特点、疫源地类型、宿主动物等进行调查。东南沿海HFRS疫区以平原、丘陵、山区为主,属于热带和温带的湿润区及半湿润区,具有广泛的域草和常绿阔叶等,姬鼠型HFRS重疫区大部分局限于这些地区。该地区的地理景观、年降雨量、平均气温、相对湿度为HFRS主要宿主动物提供了良好的栖息繁殖和食物条件,其中黑线姬鼠和褐家鼠是HFRS主要宿主动物和传染源,是此类地理景观中的优势种,分布广泛、数量多、带病毒率高,宿主动物携带的HFRS病毒可相互感染,具有宿主更替的生态学基础,为维持HFRS疫源地起了重要作用,因此做好HFRS监测和预防工作十分必要。
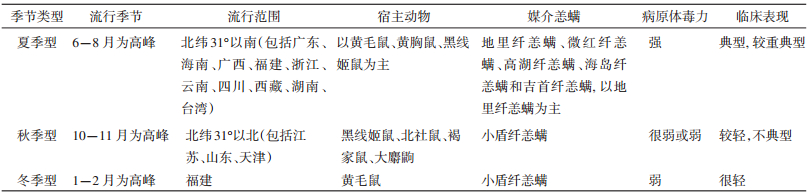
2.2 恙虫病我国从1952年开始有恙虫病疫情报告,至1985 年每年报告发病数在1000 例左右,1986年后每年报告发病数增加到2000 例以上,1990年后恙虫病未列入法定报告传染病,具体报告发病数据不详。目前研究发现[8],我国的恙虫病按照流行季节、流行范围、宿主动物、媒介恙螨、病原体毒力和临床表现分为3种季节类型(表 1)。
恙虫病在江苏省沿海地区发生最早报道见于1986年[9],9-11月间疫情发生的东台县安丰镇芦东村发病率高达2.06%。2006年10-12月,江苏省滨海县发生了恙虫病流行[10],共发现恙虫病病例214 例(含主动搜索),其中疑似病例13 例,临床诊断病例113 例,实验室确诊病例88 例。邻近沿海滩涂的滨海港镇罹患率高达125.9/10万,对该镇三洪村鼠密度调查,其密度高达4.8%,优势鼠种为黑线姬鼠、褐家鼠和臭鼩鼱,恙螨的携带率为83.3%,优势螨种为小盾纤恙螨(Leptotrombidium scutellare)。郭恒彬等[11]研究报道该地区存在秋冬型恙虫病,研究发现该地的自然地理条件适于秋冬型恙虫病的储存宿主和媒介恙螨——小盾纤恙螨生长繁殖。小盾纤恙螨于9月开始出现,密度于10月中旬至1月中旬达到高峰,发病亦随之达到高峰,12月随着螨密度的急骤减少,发病亦随之终止。患者主要为农民,与他们在生产中和杂草地、农田等恙螨孳生场所密切接触有关。张云等[12]对东南沿海地区的地理景观与恙虫病的流行特征研究发现,东南沿海地区恙虫病按季节分布主要有夏季型和秋冬型。夏季型流行于福建、浙江省,主要宿主动物为黄毛鼠(R. losea)、黄胸鼠,主要媒介为地里纤恙螨(L. deliense),流行季节一般为5-10月,恙虫病东方体为Gilliam型。秋冬型流行于江苏省,主要宿主动物为黑线姬鼠、褐家鼠,主要媒介为小盾纤恙螨,流行季节为10-12月,恙虫病东方体为Kawasaki型。研究表明,福建、浙江、江苏省恙虫病的病原体型别、储存宿主、媒介恙螨与流行特征均有所不同,因此,采取的预防措施亦应有所区别。
2.3 蜱传疾病蜱是一种寄生在动物体表的吸血寄生虫,具有从宿主获得多种病原体的能力。包括83种病毒(如森林脑炎、HFRS)、14 种细菌(如布鲁氏菌)、20 种立克次体(如Q热、蜱传斑疹热)、18 种螺旋体(如莱姆病)、32种原虫(如巴贝斯虫)、1种衣原体、1 种支原体、1种巴尔通体和2种线虫[13]。中国已知的蜱媒人畜共患病主要有5类10种,包括森林脑炎、HFRS、Q热、斑点热、莱姆病、回归热、野兔热、鼠疫、布鲁氏菌病和巴贝斯虫病等。蜱传疾病多发生在开阔的自然界,如森林、灌木丛、草原和半荒漠地带。上述蜱传疾病在我国的分布不均匀,其中云南、甘肃、新疆、台湾、西藏、福建等省(自治区)种类最多(30~46种),河南、江西省种类最少(4~6种)[14]。而与沿海地区相关的蜱传疾病可能包括莱姆病和新发的人粒细胞无形体病、新型布尼亚病毒引起的发热伴血小板减少综合征(SFTS)等,但相关报道较少。
2.3.1 莱姆病潘亮等[15]报道了1990-1995年福建省莱姆病疫区的蜱媒及其宿主调查结果,查出蜱类19种,宿主包括家野鼠类、野猪、野兔、獾、山羊等野生动物和犬、牛等家畜。从粒形硬蜱(Ixodes granulatus)、台湾角血蜱(Haemaphysalis cornigera)和北社鼠(Niviventer confucianus)、褐家鼠分离出莱姆病病原体,粒形硬蜱可能是福建省莱姆病的主要蜱媒。叶曦等[16]报道了厦门地区部分人群莱姆病感染及蜱媒调查结果,以间接免疫荧光抗体试验检测人群血清莱姆病IgG抗体,以PCR法检测蜱类可能携带的病原体DNA片段。结果显示,检测239份人血清,阳性率为2.09%;检测蜱媒499只,均为阴性,证实厦门地区存在莱姆病感染者。王丽娟等[17]于1992-1999年对山东省费县等6县(市)莱姆病调查发现,从鼠类肾脏中分离培养出莱姆病螺旋体(6/46,13.04%),其中黑线姬鼠的感染率最高(3/46,6.52%,),该结果提示黑线姬鼠可能是山东省莱姆病的主要宿主动物。同时,王丽娟等[18]于1996年从长角血蜱(H. longicornis)也分离到了莱姆病螺旋体,证实山东省存在莱姆病的自然疫源地。
2.3.2 人粒细胞无形体病张丽娟等[19]于2007年在山东省沂源县开展了无形体病感染情况调查,家犬人粒细胞无形体IgG抗体阳性率为87.5%(7/8),黑山羊人粒细胞无形体IgG抗体阳性率为90.0%(9/10),提示家犬和黑山羊可能是山东省人粒细胞无形体的重要储存宿主。研究发现当地主要优势蜱种为长角血蜱及嗜群血蜱(H. concinna),所采集的170只蜱标本中人粒细胞无形体核酸阳性率为17.6%。于强等[20]对莱州湾地区蜱调查发现,在优势蜱种长角血蜱中,其人粒细胞无形体检测阳性率高达43.5%。说明山东省存在人粒细胞无形体自然疫源地。
2.3.3 SFTS我国发现病例较少。2007-2010年,陶文元和陶欣[21]在江苏省溧水地区共报道8例SFTS病例。2010年,Yu等[22]在山东省发现类似SFTS病例93例,在对辽宁、河南、湖北、山东、安徽、江苏省发病地区的长角血蜱检测中发现SFTSV核酸并分离出该病毒,阳性率为5.4%(10/186),提示该病的主要传播媒介可能是长角血蜱。2012年Zhao等[23]采用双抗原夹心ELISA法对山东省沂源县正常人群和山羊进行SFTSV血清抗体检测,正常人中抗体阳性率较低(2/237,0.8%),山羊的抗体阳性率高(111/134,82.8%),提示山东省可能存在SFTSV流行,山羊可能是该地区SFTSV的潜在宿主。
3 蚊传播疾病 3.1 流行性乙型脑炎(乙脑)我国在20世纪50-80年代该病曾一直高发,病例主要分布于东南沿海地区,年平均发病率最高达20.92/10万。自我国广泛实施乙脑疫苗的扩大免疫规划策略以来,乙脑的控制取得了举世瞩目的成就,特别是我国沿海地区乙脑发病得到了有效控制,2014年全国乙脑仅报告858例。但我国乙脑防制仍存在一些不容忽视的问题,如中西部地区乙脑发病率仍然较高,局部地区时有乙脑暴发,且成年人病例增多;乙脑病毒的储存宿主和传播媒介依然存在,且带病毒率较高。李燕婷等[24]调查了上海地区健康人群抗体水平、中间宿主猪的感染状况。结果显示,流行前期健康人群乙脑抗体阳性率为60.4%,流行后期为85.4%;中间宿主3月龄肉猪IgG抗体阳性率为26.9%;屠宰肉猪抗体阳性率为14.9%;媒介蚊中检测到的乙脑病毒为基因1型。表明东南沿海地区尽管乙脑发病处于较低水平,健康人群乙脑抗体阳性率较高,中间宿主猪中存在乙脑病毒感染,蚊虫乙脑病毒基因分型为1型,应引起重视。
3.2 登革热我国在1873年首次报道厦门市发生登革热疫情,20世纪40年代初,该病在我国东南沿海省份和台湾地区有流行,但1949-1977年鲜有病例报告。1978年广东省佛山市发生登革热暴发,此后,该病在我国一直间断流行,病例分布的范围也不断扩大,而广东省为主要流行区。在此期间,福建、浙江省曾发生输入性的局部暴发,北京、江苏等地区也有登革热输入病例报告。2014年广东地区又发生大规模流行,共报告45 189例登革热病例,流行规模为1986年以来的最大,引起了社会各界的广泛关注。造成上述如此流行规模的因素较多[25, 26],如登革热病毒4个血清型同时存在;亚临床病例和隐性感染者发挥重要传染源作用;非人灵长类动物(如黑猩猩、长臂猿、猕猴等)等宿主动物可能成为传染源,且可携带登革热病毒在自然界中循环;人群普遍易感,感染后对异型病毒缺乏免疫力;适宜的自然因素有利于媒介伊蚊的生长繁殖和发挥其人与动物间嗜血习性,且蚊虫能通过卵及其子代传递登革热病毒;人口密集、人群防控意识差、不良居住卫生条件与习惯及人员与商品流动等社会因素为登革热传入传播创造了条件。这些因素均是登革热发生和流行的重要影响因素,也是较难控制的因素,未来我国登革热流行趋势可能更加严峻。因此,应针对登革热流行的关键环节,开展以切断传播途径为重点的综合防控措施。
3.3 其他蚊传疾病 疟疾曾是我国重要传染病之一,20世纪40年代每年至少有3000万以上患者,病死率约为1.0%;50年代初期,全国有疟疾流行的县(市)占当时县(市)总数的70%~80%,据1954年疫情报告,疟疾发病数为697万例,发病率为1229/10万,疟疾病例数占传染病报告总数的61.8%,给居民健康造成了严重威胁。在各级政府的高度重视下,经过几代人的不懈努力,我国疟疾防治取得了举世瞩目的成就[27]。2014年全国疟疾发病数仅有2921例,除云南省存在本地感染恶性疟、间日疟病例外,其他地区均为输入性病例。基孔肯雅热在我国一直以来以散在的输入性病例为主,主要发生于广东、海南、云南等南部地区。2010年10月,广东省东莞市发生了我国首起基孔肯雅热社区聚集性疫情[28]。上述疾病均以输入性传播方式出现,一般会首先发生于沿海开放城市或地区,传入地区存在适宜传播扩散的媒介蚊种(前者以按蚊为主、后者以伊蚊为主)和自然条件,继而可能向内陆地区扩展。
4 蝇传播疾病蝇类主要通过机械传播方式传播肠道传染病。黄建可等[29]对温州口岸不同蝇种在不同季节及不同场所携带肠道致病菌情况调查结果显示,蝇类体表、体内携带的细菌很多,致泻性的弧菌属河弧菌、大肠埃希菌、变形杆菌等均有检出。陈秀锦等[30]调查了宁德市常见蝇类携带病原菌情况,结果显示,常见的大头金蝇(Chrysomyia megacephala)、家蝇(Musca domestica)、丝光绿蝇(Lucilia sericata)、铜绿蝇(L. cuprina)、麻蝇(Boettcherisca)5种蝇类携带2.0×107 cfu/只以上细菌,每组蝇大肠菌群高达2.4×108 cfu/只以上,并且携带变形杆菌、霉菌、铜绿假单胞菌、致病性大肠埃希菌、沙门菌。赵志晶和刘秀梅[31]建立了由蝇类传播引起Escherichia coli O157∶H7感染暴发的评估模型,由蝇类交叉污染引起人群感染的概率为10-5~10-3/餐,模型预测的结果与暴发调查数据基本吻合。由此模型分析可知,蝇类排泄物中的含菌量及其数量是影响人群感染危险性的重要因素。
5 蜚蠊传播疾病蜚蠊携带的细菌以肠道菌为主,大肠埃希菌检出率最高,其次是蜡样芽孢菌、痢疾、绿脓杆菌、变形杆菌。哈尔滨市疾病预防控制中心在医院、浴池等地采集了143份蜚蠊样品,从其体内外检出痢疾杆菌2株,绿脓杆菌3 株,变形杆菌3株,F群沙门菌2 株。南京市从采集的238只蜚蠊中分离出83株病毒,其中腺病毒60 株,ECMO 15株,POLIO 8株,在另外的134份蜚蠊标本中分离出肠道病毒8株,脊髓灰质炎病毒4株。
| [1] | 王海军,李俊成,汪仁杰,等.中国口岸医学媒介生物区系研究[J].中国国境卫生检疫杂志,2009,32(2):102-112. |
| [2] | 吴争鸣,朱淮民,常唐喜,等.盐城国家级珍禽自然保护区蚊虫密度调查与分析[J].中国寄生虫学与寄生虫病杂志, 2007,25(4):310-313. |
| [3] | 明小燕,余青,李燕,等.大型水利工程对疾病相关危险因素的影响[J].公共卫生与预防医学,2013,24(6):75-76. |
| [4] | 王福泉,刘光连,邵荣标,等.一起滩涂开发工地流行性出血热暴发的调查分析[J].中国媒介生物学及控制杂志,1991,2 (6):391-393. |
| [5] | 张云,朱进,邓小昭,等.革螨、恙螨传播肾综合征出血热病毒的实验研究[J].中华流行病学杂志,2001,22(5):352-354. |
| [6] | 张云,张炳根,邓小昭,等.革螨通过叮刺在黑线姬鼠间传播流行性出血热病毒的实验观察[J].江苏医药,1986(11): 585-587. |
| [7] | 邓小昭,张云,王忠灿,等.东南沿海地区地理景观与HFRS流行特征关系[J].中国公共卫生,2010,26(2):176-177. |
| [8] | 吴光华.我国恙虫病流行病学研究现状与展望[J].中华传染病杂志,2000,18(2):142-144. |
| [9] | 姜仁杰,苏德茂.江苏首次发现恙虫病流行[J].中国人兽共患病杂志,1989,5(1):53. |
| [10] | 姜仁杰,沈进进,张盐珠,等.盐城市2006年恙虫病暴发的流行病学调查[J].疾病控制杂志,2007,11(6):636-638. |
| [11] | 郭恒彬,吴光华,徐毛华,等.秋冬型恙虫病自然疫源地的调查研究[J].中华流行病学杂志,1994,15(1):27-30. |
| [12] | 张云,吴光华,邓小昭,等.东南沿海地区地理景观与恙虫病流行特征关系[J].中国公共卫生,2010,26(2):174-175. |
| [13] | 张西臣,张同新,赵权.动物寄生虫病学[M].长春:吉林人民出版社,2001:125-126. |
| [14] | 陈泽,杨晓军,杨晓红,等.中国蜱类地理分布及区系分析[J].四川动物,2008,27(5):820-823. |
| [15] | 潘亮,陈振光,黄耀平,等.福建莱姆病蜱媒及其宿主调查研究[J].中国媒介生物学及控制杂志,1996,7(6):437-439. |
| [16] | 叶曦,王榕峰,李国伟.厦门地区部分人群莱姆病感染及蜱媒调查[J].预防医学情报杂志,2007,23(3):282-283. |
| [17] | 王丽娟,万康林,刘士礼,等.首次调查发现山东省存在莱姆病自然疫源地[J].中华流行病学杂志,2000,21(4): 292-294. |
| [18] | 王丽娟,陈志林,万康林,等.山东省莱姆病螺旋体的首次分离与鉴定[J].中国媒介生物学及控制杂志,1997,8(2): 127-128. |
| [19] | 张丽娟,崔峰,王玲,等.山东省沂源县无形体病实验室调查分析[J].传染病信息,2009,22(1):21-25. |
| [20] | 于强,刘庆辉,张丽娟,等.山东莱州湾湿地长角血蜱无形体 16S rRNA检测分析[J].中国人兽共患病学报,2012,28(4): 323-326. |
| [21] | 陶文元,陶欣.新型布尼亚病毒感染致发热伴血小板减少综合征8例报告[J].江苏大学学报:医学版,2011,21(1): 91-92. |
| [22] | Yu XJ,Liang MF,Zhang SY,et al. Fever with thrombocytopenia associated with a novel Bunyavirus in China[J]. N Engl J Med, 2011,364:1523-1532. |
| [23] | Zhao L, Zhai SY, Wen HL, et al. Severe fever with thrombocytopenia syndrome virus,Shandong province,China[J]. Emer Infect Dis,2012,18(6):963-965. |
| [24] | 李燕婷,朱奕奕,金必红,等.上海市流行性乙型脑炎流行病学分析[J].中国疫苗和免疫,2009,15(6):507-510. |
| [25] | 吴德仁,谢平.我国亚热带地区登革热流行概况[J].应用预防医学,2009,15(3):190-192. |
| [26] | 熊益权,陈清. 1978-2014年我国登革热的流行病学分析[J].南方医科大学学报,2014,34(12):1822-1825. |
| [27] | 汤林华.我国疟疾防治研究成就[J].中国寄生虫学与寄生虫病杂志,1999,17(5):257-259. |
| [28] | 熊劲光,黄振宇,陈平华,等.一起登革热和一起基孔肯雅热暴发疫情的对比分析[J].中华疾病控制杂志,2012,16(4): 328-331. |
| [29] | 黄建可,杨寿旺,徐建设,等.温州口岸不同蝇种在不同季节与不同场所携带肠道致病菌情况分析[J].中国国境卫生检疫杂志,2009,32(2):121-123. |
| [30] | 陈秀锦,袁高林,叶恩禧.宁德市常见蝇类携带病原菌情况分析[J].现代预防医学,2002,29(5):639-640. |
| [31] | 赵志晶,刘秀梅.由苍蝇传播引起E. coli O157:H7感染暴发的评估模型的建立[J].疾病控制杂志,2005,9(1):23-28. |
 2015, Vol. 26
2015, Vol. 26