文章信息
- 郭颂, 凌锋, 王金娜, 吴瑜燕, 侯娟, 龚震宇
- GUO Song, LING Feng, WANG Jin-na, WU Yu-yan, HOU Juan, GONG Zhen-yu
- 浙江省中东部白纹伊蚊共生菌沃尔巴克氏体的调查研究
- Investigation on symbiotic bacteria (Wolbachia) in Aedes albopictus from central and eastern Zhejiang province, China
- 中国媒介生物学及控制杂志, 2015, 26(6): 545-549
- Chin J Vector Biol & Control, 2015, 26(6): 545-549
- 10.11853/j.issn.1003.4692.2015.06.002
-
文章历史
- 收稿日期: 2015-07-16
- 网络出版时间: 2015-10-14 14:57
沃尔巴克氏体(Wolbachia)属于变形菌门(Proteobacteria),变形菌纲α亚门(Alphaproteobacteria),立克次体目(Rickettsiales),立克次体科(Rickettsiaceae),沃尔巴克氏体属(Wolbachia),是一类在节肢动物体内广泛存在、能经卵传播的革兰阴性胞内共生菌。据研究估计,在约28%的蚊虫种类中均发现该共生菌的存在[1]。沃尔巴克氏体通过胞质不相容性影响蚊虫的繁殖,并能诱导蚊虫对于多种流行性传染病病原体(如登革热病毒、基孔肯雅病毒和疟原虫等)产生抗性[2, 3],而且该共生菌对于人和环境安全性高[4],因此基于沃尔巴克氏体的蚊虫和蚊媒传染病的生物控制策略成为研究热点。
沃尔巴克氏体的多个基因序列(如16S rRNA、wsp、rps6和ftsZ基因等)已经用于系统分析[5]。wsp基因编码沃尔巴克氏体主要表面蛋白,进化速率是所有已知沃尔巴克氏体基因中最快的[6],被广泛地用于各个沃尔巴克氏体菌株的分子检测和系统进化分析中。昆虫体内最常见感染的是A和B亚组的沃尔巴克氏体[7],蚊虫感染不同类型的沃尔巴克氏体对其繁殖力和对病毒的抵抗力有不同的影响,区分不同基因型的沃尔巴克氏体是将其应用于蚊媒防制的前提。
浙江省属亚热带地区,与非洲和东南亚等地区交流频繁,历史上东部的慈溪市和中部的义乌市相继暴发了由输入性病例导致的登革热疫情,登革热等蚊媒传染病的防控面临很大压力。伊蚊控制是登革热防制的重要手段[8],利用沃尔巴克氏体控制蚊虫的繁殖和预防疾病的传播给疾病控制工作带来了新的思路。本研究对浙江省中东部地区白纹伊蚊(Aedes albopictus)的沃尔巴克氏体感染情况进行调查,并通过wsp基因进行系统进化分析,为进一步的应用提供理论基础。
1 材料与方法 1.1 白纹伊蚊样本的获取和总基因组DNA的提取综合考虑浙江省登革热输入性病例情况、历史流行情况及中东部地理区域代表性,选择6个白纹伊蚊采样点:杭州市、宁波市、嵊泗县、义乌市、丽水市和温州市。其中义乌和宁波市为登革热历史流行区。每个采样点按照东、南、西、北4个方位通过诱蚊灯法和人诱法捕捉白纹伊蚊雌性成蚊,采集标本浸入无水乙醇置于-80 ℃冰箱保存。采用DNA提取试剂盒(QIAGEN:69506)提取单个白纹伊蚊总基因组DNA,-20 ℃保存备用。
1.2 wsp基因的扩增和测序参考Zhou等[9]扩增wsp基因的通用引物,上游引物为81F: 5′-TGG TCC AAT AAG TGA TGA AGA AAC-3′,下游引物为691R:5′-AAA AAT TAA ACG CTA CTC CA-3′,引物由生工生物工程(上海)股份有限公司合成。以单个蚊虫基因组DNA为模板扩增wsp基因片段,采用25 μl反应体系:PCR预混液(TaKaRa)12.5 μl,上、下游引物(10 pmol/μl)各0.5 μl,DNA模板1.5 μl,ddH2O 10 μl。反应条件:94 ℃预变性3 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,共35个循环;72 ℃后延伸7 min。扩增后4 ℃保存,通过1%的琼脂糖电泳检测各个地区白纹伊蚊种群中沃尔巴克氏体的核酸阳性情况。
1.3 PCR产物的克隆和鉴定每个地区随机检测3个样本,PCR产物经琼脂糖凝胶回收后与pGEM-T载体(Promega)连接。取连接产物转化大肠埃希菌JM109感受态细胞,经蓝白斑筛选和特异PCR鉴定重组质粒。
1.4 wsp基因序列的测定与分析每个样本选取2个阳性克隆送生工生物工程(上海)股份有限公司进行测序。将所测序列与GenBank中相关序列在Mega 5.2软件中进行比对,分析基因的基本特征,在Megalign中分析序列核酸和氨基酸同源性,利用Mega 5.2软件进行系统进化分析和Neighbor-jointing进化树的制作(Bootstrap值为1000)。
2 结 果 2.1 白纹伊蚊采集和wsp基因的扩增从浙江省中东部6个采样点各采集到192只白纹伊蚊雌性成蚊,分别提取单个白纹伊蚊的基因组DNA并扩增wsp基因,通过1%的琼脂糖电泳检测阳性产物(图1),产物片段大小在550~650 bp之间,符合理论设计大小范围。6个采样点所采集到的白纹伊蚊均检测出沃尔巴克氏体(表1),所有地区的核酸阳性率在25.0%~96.9%之间,其中核酸阳性率最高的是杭州种群(96.9%),其次是义乌种群(93.8%),最低的是宁波种群(25.0%)。
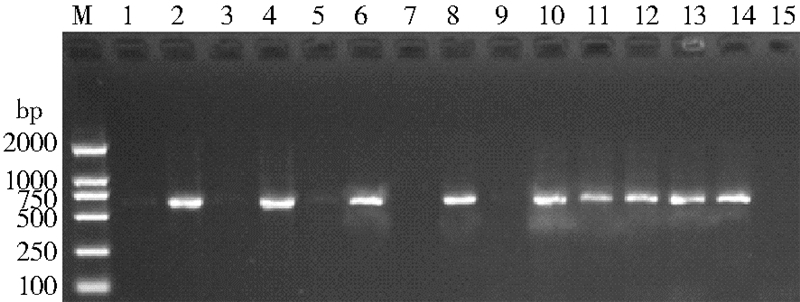
|
| 注:M. 2000 bp分子质量标准;1~14. 扩增wsp 基因的PCR产物;15. 阴性对照。 图 1 wsp基因1%琼脂糖凝胶电泳 Figure 1 1% agarose gel electrophoresis of wsp gene |
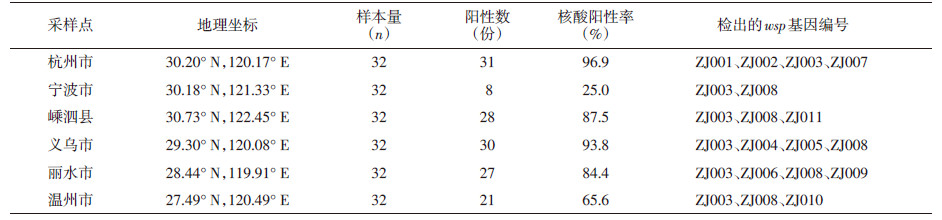
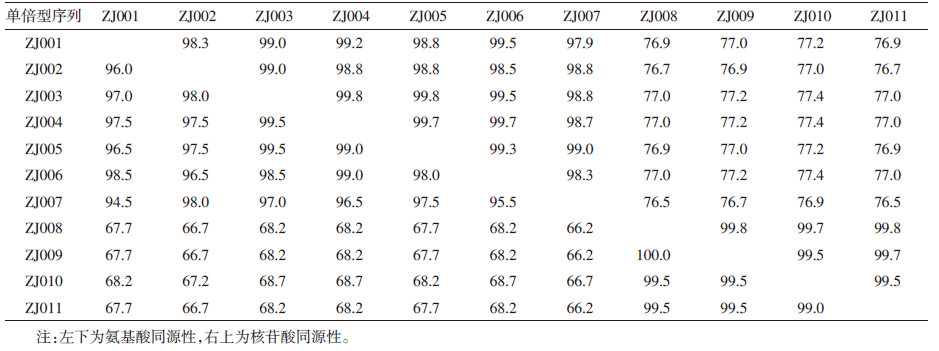
通过克隆测序共获得11个wsp单倍型序列(ZJ001~ZJ0011),各个采样点检出的wsp基因类型见表1,其中ZJ003在6个采样点均有检出,ZJ008在除杭州市以外的其余5个采样点有检出。11个序列的长度在581~605 bp之间,碱基A、T、G、C的平均含量分别为31.4%、31.1%、21.5%和16.0%。所有wsp序列的同源性在76.5%~99.8%之间,对应的氨基酸序列同源性在66.2%~100%之间(表2)。这11个序列明显处于2个超级组别中。ZJ001~ZJ007序列长度605 bp,无插入缺失突变,共有15个多态性位点,包含4个A-G转换位点,3个T-C转换位点,4个G-C颠换位点,1个A-C颠换位点,2个T-A颠换位点和1个T-G颠换位点,这些位点中同义突变为2个,错义突变为13个,碱基A、T、G、C的平均含量分别为32.0%、30.9%、20.8%和16.3%。ZJ008~ZJ0011序列长度为581 bp,无插入缺失突变,共有4个多态性位点,包含2个A-G转换位点,1个T-C转换位点和1个A-C颠换位点,这些位点中同义突变为2个,错义突变为2个,碱基A、T、G、C的平均含量分别为30.3%、31.5%、22.8%和15.4%(图2)。
 |
 |

|
| 图 2 沃尔巴克氏体wsp氨基酸序列比对 Figure 2 Alignments of amino acid sequences of wsp from Wolbachia |
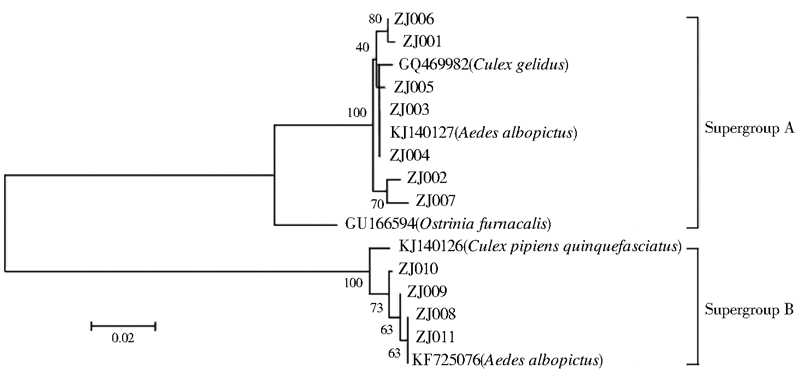
将所获得的11个wsp序列与GenBank中的wsp序列共同进行分析,GenBank中所选取的wsp基因序列号为GU166594、GQ469982、KF725076、KJ140127和KJ140126,其中KF725076和KJ140127的沃尔巴克氏体来源为白纹伊蚊。系统进化分析结果显示,11个序列被划分在2个超级组别中(图3),其中ZJ001~ZJ007为wAlbA型沃尔巴克氏体,属于Supergroup A,ZJ002和ZJ007的核酸同源性为98.8%,处于单独的一个进化支上,ZJ001和ZJ006的核酸同源性为99.5%,形成另外一个进化支,ZJ003、ZJ004和ZJ005之间的核酸同源性在99.7%~99.8%之间,与来自白纹伊蚊的一个wsp基因序列共同形成一个进化支。ZJ008和ZJ011为wAlbB型沃尔巴克氏体,属于Supergroup B,其核酸同源性为99.8%,与来自白纹伊蚊的一个wsp基因序列共同形成一个进化支。
|
| 图 3 沃尔巴克氏体wsp序列系统进化分析 Figure 3 Phylogenetic analysis of wsp genes from Wolbachia |
浙江省具有典型的亚热带季风气候,气温适中,四季分明,光照充足,雨量充沛。省内地形复杂,山地和丘陵占70.4%,平原和盆地占23.2%,河流和湖泊占6.4%,适合白纹伊蚊的生长繁殖。本次调查研究显示浙江省中东部白纹伊蚊的沃尔巴克氏体核酸阳性率较高,多个采样点白纹伊蚊的携带率>80%,在杭州市采集的白纹伊蚊样本中沃尔巴克氏体核酸阳性率甚至>95%,仅宁波市白纹伊蚊种群携带率较低,由于各采样点的样本采集、样本保存和运输以及实验检测的标准均保持一致,宁波市白纹伊蚊沃尔巴克氏体的低携带率可能是采样带来的选择偏倚。白纹伊蚊中沃尔巴克氏体的较高携带率与其他研究中的情况类似[10, 11],显示出沃尔巴克氏体在昆虫中广泛和长期的共生关系,同时,其他种类蚊虫同样也会携带沃尔巴克氏体[12],这些为沃尔巴克氏体在登革热等蚊媒传染病的防控上提供了先决条件。
Zhou等[9]利用沃尔巴克氏体外壳蛋白wsp基因进行系统进化研究表明其可以划分成12个小组,其中8个组成A大组,4个组成B大组,这种分类随着新的wsp基因型的发现不断进行调整。本研究共获得11条wsp基因序列,这些序列共划分成4个进化支,其中3个小组来自超级组别A,1个小组来自超级组别B,这些序列的划分均未超出目前已知的分类范围,且A组分支数量多于B组。分清蚊虫感染沃尔巴克氏体的种类是其用于控制蚊媒及其传染病的前提,从本研究可知浙江省中东部白纹伊蚊种群天然携带wAlbA和wAlbB两型沃尔巴克氏体,通过胞质不相容原理,感染不同类型沃尔巴克氏体的白纹伊蚊雌雄虫之间交配,其子代发生双向胞质不相容而不能存活,从而起到降低白纹伊蚊种群密度的作用。特定类型的沃尔巴克氏体在伊蚊体内对蚊媒病毒有抑制作用,Blagrove等[13]发现wMel型的沃尔巴克氏体能强烈地抑制白纹伊蚊体内的登革热病毒,降低蚊虫传播登革热病毒的能力,为利用沃尔巴克氏体防控登革热提供理论依据。提示在浙江省释放携带wMel型沃尔巴克氏体的白纹伊蚊种群对于重点地区的登革热防控能起到一定作用。
近年来登革热疫情在中国南方时有发生,研究表明登革热病毒可能在当地存在自然循环[14]。浙江省媒介监测显示白纹伊蚊密度较高,布雷图指数高于安全系数,而且浙江省与东南亚和非洲人员来往频繁,每年登革热输入性病例较多,给全省登革热防制带来了巨大挑战。2004年和2009年东部的慈溪市和中部的义乌市相继暴发了登革热疫情,在流行区实施以灭蚊为主的防控措施,使得白纹伊蚊种群密度迅速下降。但是以化学防治为主的蚊虫控制效果是暂时性的,容易诱导蚊虫的抗药性,同时对于生态环境和人产生难以估量的后果。应用沃尔巴克氏体控制媒介伊蚊属于生物防制的范畴,其具有很高的生物安全性,结合化学防治能取得有效的蚊虫控制效果,在倡导媒介生物可持续控制的今天具有较高的推广意义。
| [1] | Kittayapong P, Baisley KJ, Baimai V, et al.Distribution and diversity of Wolbachia infections in Southeast Asian mosquitoes (Diptera:Culicidae)[J]. J Med Entomol, 2000, 37(3): 340-345. |
| [2] | Bian G, Xu Y, Lu P, et al.The endosymbiotic bacterium Wolbachia induces resistance to dengue virus in Aedes aegypti [J]. PLoS Pathogens, 2010, 6(4):e1000833. |
| [3] | 潘晓玲,刘起勇,奚志勇.基于昆虫共生菌沃尔巴克氏体的蚊媒和蚊媒病控制研究进展[J].中国媒介生物学及控制杂志, 2014, 25(1):1-7. |
| [4] | 郑小英,刘起勇,奚志勇.基于沃尔巴克氏体的蚊媒和蚊媒病控制的生物安全性[J].中国媒介生物学及控制杂志, 2014, 25(2):93-96. |
| [5] | Baldo L, Dunning Hotopp JC, Jolley KA, et al.Multilocus sequence typing system for the endosymbiont Wolbachia pipientis [J]. Appl Environ Microbiol, 2006, 72(11):7098-7110. |
| [6] | 郑雅.Wolbachia诱导昆虫宿主细胞质不亲和的分子机理研究 [D].武汉:华中师范大学, 2012. |
| [7] | Werren JH, Baldo L, Clark ME.Wolbachia:master manipulators of invertebrate biology[J]. Nat Rev Microbiol, 2008, 6(10): 741-751. |
| [8] | 孟凤霞,王义冠,冯磊,等.我国登革热疫情防控与媒介伊蚊的综合治理[J].中国媒介生物学及控制杂志, 2015, 26(1): 4-10. |
| [9] | Zhou W, Rousset F, O'Neil S.Phylogeny and PCR-based classification of Wolbachia strains using wsp gene sequences[J]. Proc R Soc Lond B, 1998, 265(1395):509-515. |
| [10] | Kitrayapong P, Baimai V, O'Neill SL.Field prevalence of Wolbachia in the mosquito vector Aedes albopictus[J]. Am J Trop Med Hyg, 2002, 66(1):108-111. |
| [11] | 杨筱慧,朱道弘,刘志伟,等.湖南三地区麦氏安瘿蜂体内 Wolbachia的感染及其wsp基因序列分析[J].昆虫学报, 2012, 55(2):247-254. |
| [12] | 林立丰,吴德,张欢,等.广东省蚊虫感染沃尔巴克氏体初步调查研究[J].中国媒介生物学及控制杂志, 2014, 25(2): 113-115. |
| [13] | Blagrove MS, Arias-Goeta C, Failloux AB, et al.Wolbachia strain wMel induces cytoplasmic incompatibility and blocks dengue transmission in Aedes albopictus[J]. Proc Natl Acad Sci USA, 2012, 109(1):255-260. |
| [14] | 周健明,王德全,林琳,等.深圳市龙岗区2009-2011年登革热媒介监测分析[J].中国公共卫生, 2012, 28(12): 1628-1630. |




