扩展功能
文章信息
- 刘师文, 徐刚, 龚甜, 熊英, 施勇, 李健雄, 刘晓庆, 肖芳, 张艳妮, 周珺
- LIU Shi-wen, XU Gang, GONG Tian, XIONG Ying, SHI Yong, LI Jian-xiong, LIU Xiao-qing, XIAO Fang, ZHANG Yan-ni, ZHOU Jun
- 江西省鼠类携带汉坦病毒基因特征研究
- nalysis on genetic characteristics of Hantavirus from rodents in Jiangxi province
- 中国媒介生物学及控制杂志, 2015, 26(5): 475-479
- Chin J Vector Biol & Control, 2015, 26(5): 475-479
- 10.11853/j.issn.1003.4692.2015.05.011
-
文章历史
- 收稿日期: 2015-04-23
- 网络出版时间:2015-08-12
人类感染汉坦病毒(Hantavirus,HV)可引起肾综合征出血热(HFRS)和汉坦病毒肺综合征[1]。已发现的 HV 至少可分为40 种血清型或基因型,我国从宿主动物中发现的HV有许多种,但是目前只有汉滩型病毒(HTNV)和汉城型病毒(SEOV)被证实可引起我国人类的HFRS[2]。江西省曾是HFRS高发地区,从20世纪60年代以来就一直有病例报告,但是江西省HFRS的病原学检测一直停留在免疫学水平。为了解江西省HV的流行情况及基因特征,以及与国内外其他地区HV的进化关系,为HFRS防控提供科学依据,本研究于2011年对6个县(市)开展了HV的分子流行病学调查,对采集的鼠肺标本进行了HV检测及基因分析,现将结果报告如下。
1 材料与方法 1.1 标本采集于2011年春秋季,在江西省高安市、安义县、新建县、上饶县、上高县、浮梁县室内外以夹夜法捕鼠(高安市、安义县鼠肺由监测点送样),无菌解剖取鼠肺,-70 ℃保存。
1.2 主要试剂Rneasy Mini Kit (Qiagen)、SuperScript® Ⅲ First-Strand synthesis system for RT-PCR(Invitrogen)、2000 bp DNA Marker、Pyrobest® DNA Polymerase(TaKaRa)、PCR相关试剂(Promega)、荧光素标记的HV抗体购自第四军医大学。
1.3 直接免疫荧光检测鼠肺经冷冻切片机切片后冷丙酮固定20 min,PBS冲洗2次,蒸馏水漂洗1次,吹干,滴加荧光素标记HV抗体,置湿盒内37 ℃水浴30 min取出,用PBS冲洗3次,蒸馏水漂洗1次,吹干;甘油封片后在荧光显微镜下观察结果。
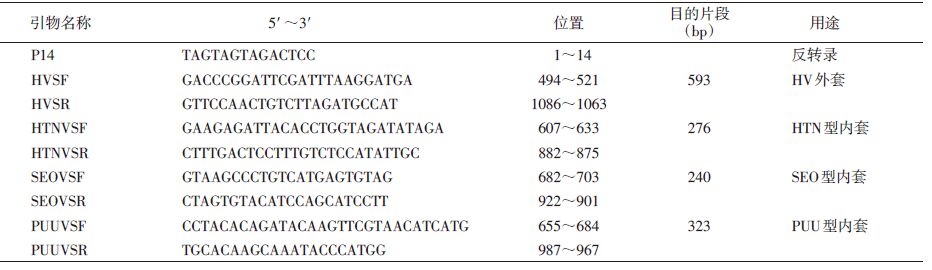
1.4 引物设计与合成参照已知HV国际标准株76-118株S基因片段及文献[3]核苷酸序列设计特异性的反转录引物 、分型引物和全S片段扩增引物委托生工生物工程(上海)股份有限公司合成,引物序列见表 1;扩增全S片段引物S1/S2参照文献[4]。M片段引物参照《全国肾综合征出血热监测方案(试行)》。
采用P14引物及SuperScript® Ⅲ First-Strand synthesis system for RT-PCR试剂盒合成cDNA,反应体系和反应条件参照试剂盒说明书进行。 巢式PCR分两轮进行,首轮应用HV S基因通用上下游引物HVSF/HVSR进行扩增,扩增产物采用S基因上下游分型引物进行第二轮扩增。反应体系及条件参照试剂盒说明书。
1.6 基因测序参照文献[4]扩增全S片段PCR产物送生工生物工程(上海)股份有限公司进行克隆并测序,另外扩增部分M片段送生工生物工程(上海)股份有限公司测序。
1.7 序列分析运用DNAStar 软件(SeqMan)对测定的序列进行拼接,得到全S和部分M片段基因的核苷酸序列。选择GenBank公布的国内外HV代表株基因序列用于比较分析。运用Mega 3.1和DNAStar软件包进行系统发生分析。以邻位相连法构建系统发生树。
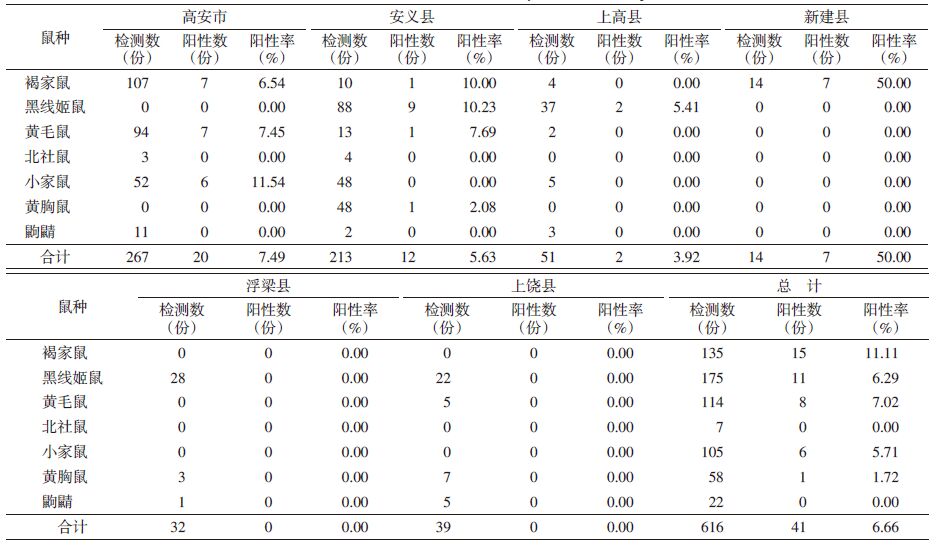
2 结 果 2.1 鼠肺标本采集及免疫荧光检测在江西省6个县(市)共捕获鼠类616只,其中包括褐家鼠(Rattus norvegicus,135/616,21.92%)、黑线姬鼠(Apodemus agrarius,175/616,28.41%)、小家鼠(Mus musculus,105/616,17.05%)、黄胸鼠(Rattus tanezumi,58/616,9.41%)、黄毛鼠(R. lossea,114/616,18.50%)、北社鼠(Niviventer confucianus,7/616,1.14%)和鼩鼱(Sorex araneus,22/616,3.57%)7种。616份鼠肺标本中,41份免疫荧光阳性,阳性率为6.66%。各县(市)鼠标本的HV携带情况见表 2。对不同地区、不同鼠种的鼠肺阳性率进行χ2检验,发现不同鼠种的HV阳性率差异无统计学意义(P>0.05 ),各县(市)间HV阳性率差异有统计学意义(P<0.05);新建县以外的其他县(市)之间鼠肺HV阳性率差异无统计学意义(P>0.05)。
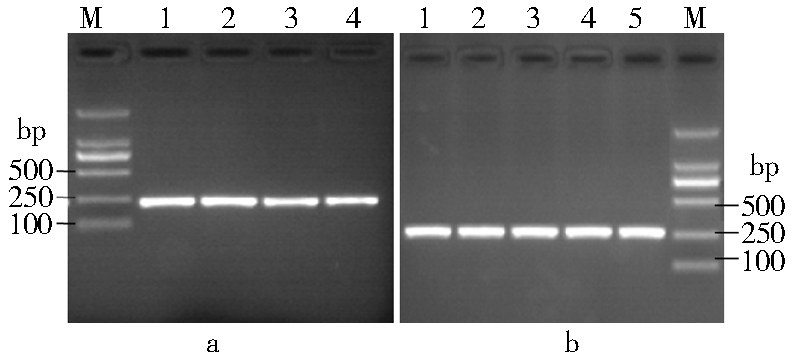
对32份鼠肺免疫荧光阳性标本进行核酸提取和反转录,反转录产物经S片段通用引物扩增后再用分型引物进行巢式PCR,产物经1.5%的琼脂糖凝胶电泳,结果10份为SEOV型,13份为HTNV型。分型引物可以特异地将两个型别病毒区分开来,片段大小分别为240 bp(SEOV型)和276 bp(HTNV型),分型电泳图见图 1,有9份直接免疫荧光阳性标本未能用分型引物检测到。
|
| 注:a. SEOV型分型引物(SEO SF/SR);M. Marker;1~4. 样本。 b. HTNV型分型引物;M. Marker;1~5. 样本。 图 1 HV基因分型巢式PCR产物电泳结果 Figure 1 Electrophoresis patterns of nested PCR products using the type⁃specific primer |
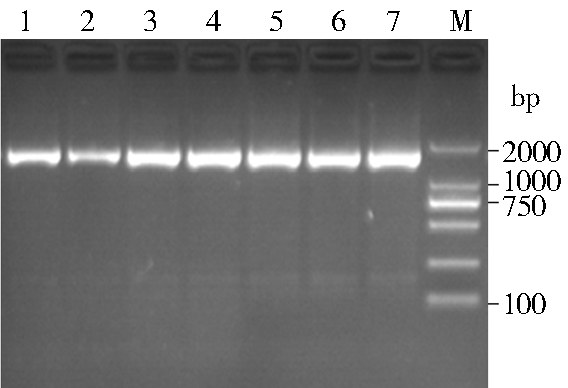
S全长基因的扩增产物预期为1700 bp左右。对7份标本XJ2、XJ5、SG42、 GA13、GA19、GA21、AY133进行全S片段扩增,结果见图 2,在预期位置出现电泳条带。
|
| 注:M. Marker;1~7. 分别为AY133、SG42、XJ2、XJ5、GA13、 GA19、GA21。 图 2 全S片段的扩增产物电泳结果 Figure 2 Electrophoresis patterns of PCR products of complete S genes |
本研究源自鼠肺的7份HV S全基因核苷酸序列长度为1699~1773 bp,均编码429个氨基酸。
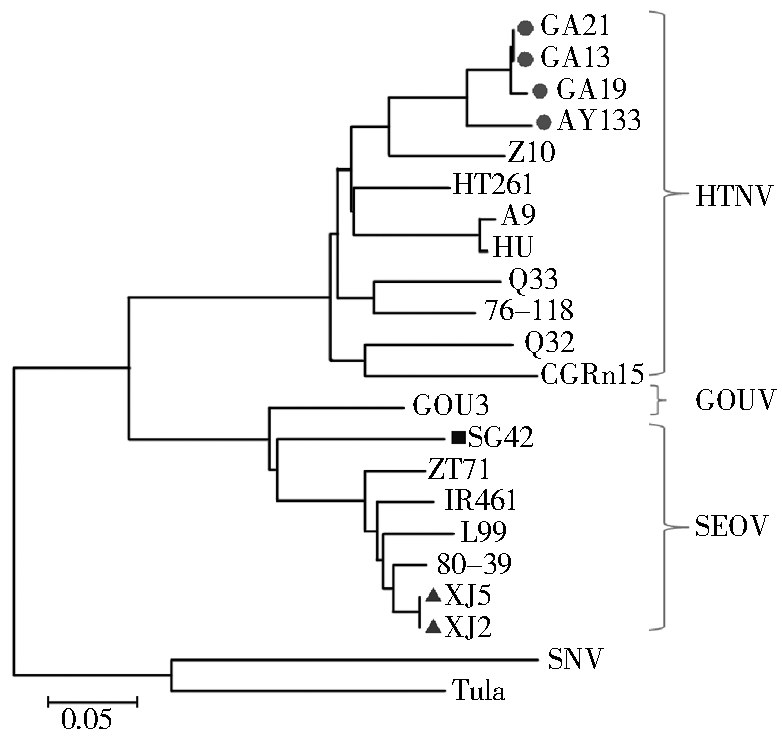
2.4 HV系统进化分析S全长基因的核苷酸系统发生树见图 3。XJ2、XJ5病毒分布在HV SEOV进化支,与浙江省分离株ZT71、河北省分离株93HBX12亲缘关系比较近。GA13、GA19、GA21、AY133分布在HTNV进化支。 SG42病毒单独分布一支与国内外SEOV比较株亲缘关系相对较远,而与沟型病毒(GOU hantavirus,GOUV)的Gou3、ZJ5株亲缘关系较近。

|
| 图 3 HV全S片段核苷酸系统发生树 Figure 3 Phylogenetic tree of HV based on complete S segment |
M片段的核苷酸系统发生树见图 4。XJ2、XJ5病毒分布在SEOV进化支,GA13、GA19、GA21、AY133分布在HTNV进化支,SG42病毒分布在SEOV进化支,但与SEOV进化支内的病毒亲缘关系较远。
|
| 图 4 HV部分M片段核苷酸系统发生树(2003~2302 bp) Figure 4 Phylogenetic tree of HV based on partial M segment(2003-2302 bp) |
XJ2、XJ5与SEOV的同源性最高,与SEOV国际标准株80-39 S片段的核苷酸同源性为96.7%~96.9%,与HTNV、SNVT、TULV核苷酸同源性均低于75%。XJ2、XJ5来自新建县褐家鼠,2株病毒的S片段核苷酸序列同源性为99.5%,与20世纪80年代从江西省分离的 L99株同源性分别为95.4%和95.7%。同国内外其他SEOV比较,这两株病毒与ZT71、93HBX13同源性最高,同源性分别为96.8%~96.9%。
GA13、GA19、GA21、AY133与HTNV的核苷酸同源性最高,与HTNV型病毒国际标准株76-118 S片段序列同源性为84.7%~85.5%,与HV的SNV、TULV、SEOV同源性更低,均低于75%。而与其他HTNV型之间的同源性为83.4%~85.8%,其中与浙江株Z5的差异最小,但核苷酸的同源性最高也只有85.8%。
SG42核苷酸序列同国内外的SEOV S片段的核苷酸同源性仅为88.5%~88.9%,与HTNV、SNVT、TULV的同源性均低于74%,与 GOUV型浙江株Gou3、ZJ5的差异最小,核苷酸同源性最高为90.1%。
2.5.2 部分M片段核苷酸同源性分析XJ2、XJ5与SEOV型同源性最高,与国际标准株80-39株核苷酸同源性为96.7%,与HTNV、SNVT、TULV核苷酸同源性均低于73%,XJ2、XJ5之间M片段同源性为100%;GA13、GA19、GA21、AY133与HTNV的核苷酸同源性最高,与HTNV型病毒国际标准株76-118 S片段序列同源性为84.4%~84.7%,浙江株Z10的差异最小,但核苷酸的同源性最高也只有87.4%;SG42与SEOV型80-39株同源性只有87.4%,与HTNV型76-118株同源性为69.8%,与GOUV型Gou3株同源性为85.4%。
3 讨 论据王世文等[5]报道中国流行的 HTNV 可分为9 个亚型,SEOV 可分为4~6 个亚型。随着新的检测技术以及分子生物学的发展,新的型别和亚型的HV不断被发现[6, 7, 8, 9, 10]。 为更好地了解江西省HV流行情况和基因型特征,我们在江西省有代表性的县(市)捕鼠,采用直接免疫荧光法检测HV抗原,对阳性鼠肺进行核酸检测并分型。在使用分型引物对免疫荧光阳性标本分型时发现大部分标本可以被检测到并能分型,但是部分标本却不能被检测,可能是鼠肺标本在运输或保存过程中核酸发生降解,也可能是病毒基因有变化。
我们随机选择了7份来自不同地区携带HV的阳性鼠肺标本进行全S片段、部分M片段扩增测序,其中XJ2、XJ5来自新建县褐家鼠,SG42来自上高县黑线姬鼠,GA13、GA19、GA21来自高安市小家鼠,AY133来自安义县黑线姬鼠。基于全S片段的核苷酸分型结果与基于部分M片段的分型结果基本一致。SG42全S片段分型属GOUV型,而部分M片段分型属SEOV型,XJ2、XJ5属SEOV型,GA13、GA19、GA21属HTNV型,从基因水平证实了江西省是家鼠型和野鼠型混合疫区。
不论基于全S片段,还是部分M片段的系统进化树分析,来自江西省的GA13、GA19、GA21、AY133在HTNV进化支中独立分支,与国内外HTNV型病毒亲缘关系较远,提示江西地区可能存在新亚型的HTNV。SG42的全S片段的核苷酸同源性与GOUV型的Gou3株同源性最高为90.1%;部分M片段的核苷酸同源性与SEOV型80-39株同源性最高为87.4%,推测SG42可能是SEOV或者GOUV内的新亚型。
不同型别的病毒对宿主具有相对的选择性,SEOV型以褐家鼠为主要宿主动物,HTNV型以黑线姬鼠为主要宿主动物,本研究发现存在以小家鼠为宿主的HTNV(高安市的GA13、GA19、GA21)和以黑线姬鼠为宿主的GOUV(上高县的SG42)。系统进化树显示GA13、GA19、GA21在HTNV进化支上独立分支,可能是新的HTNV亚型;SG42与GOUV、SEOV、HTNV型毒株亲缘关系均较远,他们的基因进化特点是否与“宿主溢出”现象有一定的关系[11],还将继续加强监测研究。
XJ2、XJ5全S片段的核苷酸同源性为99.5%,部分M片段核苷酸同源性为100%;GA13、GA19、GA21之间的部分M片段核苷酸同源性为99.0%~100%,全S片段同源性为99.3%~100%,体现了地理位置的聚集性[12]。
鼠类携带HV,可传播至人引起人间HV流行或暴发[13],此次研究发现HV阳性鼠肺主要分布在高安市、安义县、新建县和上高县,而上饶县和浮梁县未检测到HV,各县(市)的鼠肺HV阳性率差异有统计学意义。除新建县采集的标本较少,采样点集中导致阳性率特别高外,高安市的鼠肺携带率最高,且检测到HV阳性鼠肺的县(市)均与高安市相邻,提示需加强高安市及其周边地区HFRS的防控。 综上所述,江西地区鼠类携带的HV型别主要为SEOV和HTNV型,可能存在新亚型的HV。
| [1] | Hussein ITM, Haseeb A, Haque A, et al. Recent advances in Hantavirus molecular biology and disease[J]. Adv Appl Microbiol, 2011, 74:35-75. |
| [2] | Wang W, Wang MR, Lin XD, et al. Ongoing Spillover of Hantaan and Gou Hantaviruses from rodents is associated with hemorrhagic fever with renal syndrome (HFRS) in China[J]. PLoS Negl Trop Dis, 2013, 7(10):e2484. |
| [3] | 董雪, 张永振, 李欣, 等. 辽宁地区汉坦病毒分离株的基因分型[J]. 中华实验和临床病毒学杂志, 2005, 19(1):39-42. |
| [4] | 张文增. 河北省汉坦病毒的分离及其代表毒株S片段全基因序列分析[D]. 石家庄:河北医科大学, 2007. |
| [5] | 王世文, 杭长寿, 王华, 等. 我国汉坦病毒基因型和基因亚型的分布研究[J]. 病毒学报, 2002, 18(3):211-216. |
| [6] | 刘师文, 龚甜, 熊英. 汉坦病毒检测方法研究进展[J]. 现代预防医学, 2014, 41(13):2420-2422. |
| [7] | Wang H, Yoshimatsu K, Ebihara H, et al. Genetic diversity of Hantaviruses isolated in China and characterization of novel Hantaviruses isolated from Niviventer confucianus and Rattus rattus[J]. Virology, 2000, 278(2):332-345. |
| [8] | 张海林, 张云智. 中国汉坦病毒基因型及分布[J]. 中国媒介生物学及控制杂志, 2011, 22(5):417-420. |
| [9] | King AMQ, Lefkowitz E, Adams MJ, et al. Virus taxonomy:ninth report of the international committee on taxonomy of viruses[M]. San Diego: Elsevier, 2011:693-709. |
| [10] | Li JL, Ling JX, Liu DY, et al. Genetic characterization of a new subtype of Hantaan virus isolated from a hemorrhagic fever with renal syndrome (HFRS) epidemic area in Hubei province, China[J]. Arch Virol, 2012, 157(10):1981-1987. |
| [11] | 邹洋, 张海林, 张云智, 等. 云南省褐家鼠与黄胸鼠中汉坦病毒的流行病学研究[J]. 中国媒介生物学及控制杂志, 2006, 17(5):399-403. |
| [12] | 姚苹苹, 朱函坪, 邓小昭, 等. 浙江省汉坦病毒基因分子进化分析[J]. 病毒学报, 2010, 26(6):465-470. |
| [13] | Zhang YZ, Dong X, Li X, et al, Seoul virus and Hantavirus disease, Shenyang, People’s Republic of China[J]. Emerg Infect Dis, 2009, 15(2):200-206. |
 2015, Vol. 26
2015, Vol. 26