扩展功能
文章信息
- 桑少伟, 刘起勇
- SANG Shao-wei, LIU Qi-yong
- 广东省2003-2012年登革热本地病例时空分析
- Spatial and temporal analysis of indigenous dengue cases in Guangdong province during 2003-2012
- 中国媒介生物学及控制杂志, 2015, 26(5): 451-453
- Chin J Vector Biol & Control, 2015, 26(5): 451-453
- 10.11853/j.issn.1003.4692.2015.05.005
-
文章历史
- 收稿日期: 2015-05-14
- 网络出版时间: 2015-08-12 13: 54
登革热是一种蚊媒传播病毒性疾病,主要发生在热带和亚热带区域,其发病率在过去的50年增加了30倍[1]。据估算,世界范围内每年有3.9亿人感染登革热病毒[2]。登革热的主要传播媒介是埃及伊蚊(Aedes aegypti)和白纹伊蚊(Ae. albopictus),由于白纹伊蚊的广泛分布,目前登革热本地传播已发生在法国[3]、葡萄牙[4]等欧洲国家。新中国成立后,广东省在1978年发生了中国第一次登革热暴发,自此,登革热在中国南部沿海省份慢慢扩散开来,其中发生登革热暴发的省份有海南、广东、云南、福建和浙江省以及广西壮族自治区[5],而且中原河南省在2013年发生了首次登革热暴发[6]。自1997年以后,广东省的登革热发病水平最高[7],而且有愈演愈烈之势。本文主要研究广东省登革热时空分布特征,明确登革热高发的热点区域及高发时间,为登革热防控提供依据。 1 材料与方法 1.1 登革热病例数据
2003-2012年登革热个案数据来自中国法定传染病监测系统,其中包括患者年龄、性别、发病日期、是否为输入病例等,本研究将输入病例剔除,并将病例按月、区汇总,分析广东省登革热本地病例的时空分布特点。 1.2 方法
本研究采用时间序列加性模型(additive model)将登革热本地病例分解,提取出趋势成分、季节性成分以及随机项,即此部分分析采用R3.1.1软件;本研究采用SaTScan软件中单纯空间聚集性分析来探测广东省登革热发生的高风险区域,其中病例文件采用了各区(县)按月汇总数据,空间最大扫描窗口采用研究区域50%人口,模型采用经过人口调整后的泊松回归模型。根据似然比检验给出第一、二聚集区,聚集区的统计学差异通过蒙特卡罗9999次模拟评价。 2 结 果 2.1 登革热描述性流行病学分析
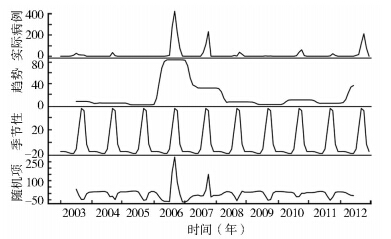
2003-2012年广东省共报告本地病例2152例,其中2006年发生了登革热大暴发(图 1),此次暴发报告本地病例1008例,占病例总数的46.80%。男女性发病率之比为0.89∶1。
|
| 图 1 2003-2012年广东省登革热本地病例时间序列分解结果 Figure 1 Decomposition of local dengue cases time series,Guangdong province,2003-2012 |
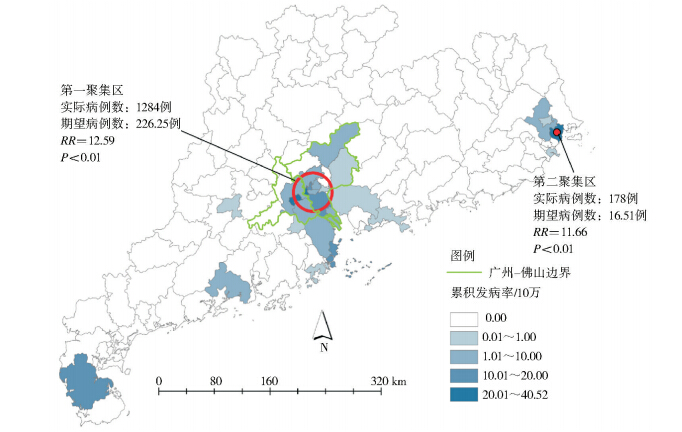
登革热本地病例时间序列分解显示本地登革热发生具有严格的季节性,登革热多发生于8-10月,其中又以9、10月高发(表 1)。2003-2012年数据显示,登革热本地病例主要出现在珠江三角洲、潮汕地区以及雷州半岛等地。空间聚集性分析发现,登革热本地病例主要聚集在广州和佛山市,其中包括广州市越秀区、荔湾区、白云区、海珠区、天河区、番禺区和佛山市禅城区;第二聚集区是汕头市的澄海区(图 2)。
 |
|
| 图 2 2003-2012年广东省登革热本地病例累积发病率及空间聚集性分析结果 Figure 2 The results of accumulative incidence of local cases and spatial clusters,Guangdong province,2003-2012 |
广东省出现登革热已有近40年历史,近几年有愈演愈烈之势,但是登革热本地病例在广东省并不是随机分布的,登革热本地病例的出现具有明显的地域异质性,2003-2012年登革热出现本地病例的地域局限在珠江三角洲、潮汕等地,其中高发在广州市和佛山市少数区,而且时间上高发在9、10月。
登革热传播是人、登革热病毒、媒介三者相互作用的结果,其中媒介是传播的关键环节。易彬樘等[8]研究发现珠江三角洲及潮汕地区蚊虫密度高于其他区域,为本地登革热的流行创造了条件。媒介密度与居民生活方式及环境因素密切相关。广州市越秀区、荔湾区、海珠区是3个老城区,居民有种植富贵竹、万年青等水生植物习惯,为白纹伊蚊提供了良好孳生环境;1978年中国登革热第一次暴发发生在佛山市禅城区,此后,1979、1980、1985、2012年发生过登革热流行[9],佛山市禅城区是著名的陶瓷之乡,当地雨量充沛,积水陶瓷为白纹伊蚊提供了良好孳生环境。
登革热在中国目前仍被视为输入性疾病,输入性病例在登革热中国本地发生方面发挥了重要作用[10]。广州、潮汕地区是广东省富庶之地,与周边登革热流行国家交流频繁,登革热输入机会大,为当地登革热流行创造了条件[11]。因此在控制蚊虫密度的同时,应同时加强对前往东南亚、非洲等疫区旅游或劳务输出人员有关登革热防治知识的宣传,并加强与检验检疫、旅游等部门的沟通和合作,及早发现登革热输入病例。
登革热是一种气候敏感疾病,其中温度对蚊虫发育及登革热病毒的传播发挥了重要作用。研究发现,白纹伊蚊的发育时间随着温度增加呈现倒“V”形,最佳发育温度是29.74 ℃,超过30 ℃后,蚊虫的发育开始受到抑制,温度达到35 ℃后,只有2.5%的卵发育为成虫[12]。登革热病毒的传播需要经过病毒在蚊虫体内外潜伏期的发育过程,研究发现,在18~36 ℃范围内,随着温度增加,登革热病毒在蚊虫体内的发育时间缩短,并在31 ℃达到高峰,然后出现下降,而且<18 ℃时,登革热病毒在蚊虫体内不能发育[13]。这些因素可以解释广东省登革热在9、10月高发的原因。因此对登革热蚊虫的控制应提前,在5、6月就应加强宣传、清理孳生地、增强居民意识,将登革热流行期蚊虫密度控制在较低水平。登革热在广东省流行具有明显的空间和时间异质性,因此应重点加强针对登革热高发区域及高发时间的监测,并将有限的公共卫生资源合理倾斜,降低甚至抑制登革热暴发。
| [1] | World Health Organization. Global strategy for dengue prevention and control, 2012-2020[M]. Genvea:WHO Press, 2012:1-35. |
| [2] | Bhatt S, Gething PW, Brady OJ, et al. The global distribution and burden of dengue[J]. Nature, 2013, 496(7446):504-507. |
| [3] | La Ruche G, Souares Y, Armengaud A, et al. First two autochthonous Dengue virus infections in metropolitan France, September 2010[J]. Euro Surveill, 2010, 15(39):19676. |
| [4] | Wilder-Smith A, Quam M, Sessions O, et al. The 2012 dengue outbreak in Madeira: exploring the origins[J]. Euro Surveill, 2014, 19(8):20718. |
| [5] | Wu JY, Lun ZR, James AA, et al. Dengue fever in mainland China[J]. Am J Trop Med Hyg, 2010, 83(3):664-671. |
| [6] | Huang XY, Ma HX, Wang HF, et al. Outbreak of dengue fever in central china, 2013[J]. Biomed Environ Sci, 2014, 27(11):894-897. |
| [7] | Wang CG, Yang WZ, Fan JC, et al. Spatial and temporal patterns of dengue in Guangdong province of China[J]. Asia Pac J Public Health, 2013, 27(2):NP844-853. |
| [8] | 易彬樘, 张治英, 徐德忠, 等. 广东省登革热及媒介种群的空间分布[J]. 第四军医大学学报, 2003, 24(17):1623-1627. |
| [9] | 何粤发. 佛山市禅城区石湾镇登革热疫情爆发流行病学调查[J]. 社区医学杂志, 2013, 11(10):20-22. |
| [10] | Sang SW, Yin WW, Bi P, et al. Predicting local dengue transmission in Guangzhou, China, through the influence of imported cases, mosquito density and climate variability[J]. PLoS One, 2014, 9(7):e102755. |
| [11] | Liu CX, Liu QY, Lin HL, et al. Spatial analysis of dengue fever in Guangdong province, China, 2001-2006[J]. Asia Pac J Public Health, 2014, 26(1):58-66. |
| [12] | Delatte H, Gimonneau G, Triboire A, et al. Influence of temperature on immature development, survival, longevity, fecundity, and gonotrophic cycles of Aedes albopictus, vector of chikungunya and dengue in the Indian Ocean[J]. J Med Entomol, 2009, 46(1):33-41. |
| [13] | Xiao FZ, Zhang Y, Deng YQ, et al. The effect of temperature on the extrinsic incubation period and infection rate of Dengue virus serotype 2 infection in Aedes albopictus[J]. Arch Virol, 2014, 159(11):3053-3057." |
 2015, Vol. 26
2015, Vol. 26


