扩展功能
文章信息
- 梁克峰, 刘渠, 王德全, 周健明, 金玉娟, 陈应坚, 李静媚, 甘莉萍, 杨慧
- LIANG Ke-feng, LIU Qu, WANG De-quan, ZHOU Jian-ming, JIN Yu-juan, CHEN Ying-jian, LI Jing-mei, GAN Li-ping, YANG Hui
- 实时荧光PCR检测Nam Dinh病毒方法的建立及初步应用
- The establishment and initial application of real-time fluorescent PCR detection of Nam Dinh virus
- 中国媒介生物学及控制杂志, 2015, 26(5): 447-450
- Chin J Vector Biol & Control, 2015, 26(5): 447-450
- 10.11853/j.issn.1003.4692.2015.05.004
-
文章历史
- 收稿日期: 2015-05-04
- 网络出版时间: 2015-08-12 13: 54
2 深圳市龙岗区疾病预防控制中心
2 Longgang Center for Disease Control and Prevention
Nam Dinh 病毒(NDiV)是一种在我国新发现的昆虫套式病毒。2002年由Nga等[1]从越南急性病毒性脑炎综合征患者的脑脊液中分离出全球首株NDiV。研究者根据病毒的分离地点将其命名为Nam Dinh virus。2013年,中国首次在深圳市龙岗地区的致倦库蚊(Culex pipiens quinquefasciatus)中发现并成功分离到NDiV[2]。目前,关于昆虫套式病毒的文献报道不多,2011年mBio杂志报道了首篇昆虫套式病毒的研究[3],在科特迪瓦的原始森林库蚊中首次发现昆虫套式病毒并命名为Cavally virus(CAVV)。同年,PLoS Pathogens刊登同为昆虫套式病毒的研究,发现它们可能是套式病毒中如猪生殖与呼吸综合征病毒的短基因病毒(small genomes)与SARS冠状病毒的长基因病毒(large genomes)之间的进化连接[4, 5]。
实时荧光定量RT-PCR ( real?time fluorescentquantitative RT-PCR)是采用特异性标记的探针进行实时监控扩增产物的方法,如今已广泛应用于各种病原检测[6]。MGB是新型的核酸类似物,TaqMan?MGB探针能提高杂交效率和增强热稳定性,同时加强杂交的特异性。本研究设计特异性引物和TaqMan?MGB探针,建立了NDiV荧光RT-PCR的检测方法[7]。 1 材料与方法 1.1 试剂和仪器
One Step RT-PCR( Perfect Real?time)Kit试剂盒和MgCl2(25 mmol/L)购自TaKaRa大连宝生物工程有限公司。TrizolRNA 提取试剂由美国Invitrogen 公司生产。主要仪器:ABI 7500荧光定量PCR仪、Roche LightCycler 480Ⅱ荧光定量PCR仪、PCR仪、凝胶成像仪、Millipore超纯水系统、Beckman超速离心机、Sanyo CO2培养箱、美国热电生物安全柜、电泳仪。
病毒株:登革热病毒1~4个血清型标准株、流行性乙型脑炎(乙脑)病毒标准株、人呼吸道合胞病毒标准株,均由广州军区疾病预防控制中心提供;轮状病毒、星状病毒、腺病毒、NDiV标准株,均由本实验室保存。 1.2 引物、探针合成
应用MegAlign软件对GenBank中公开发表的NDiV(GenBank no. 02VN178)序列以及本实验室分离鉴定的NDiV株的全基因组序列(GenBank no. SZ11706Z)做序列比对,选取序列基因中的特异性保守序列(RdRp),利用Primer Premier 5.0和Oligo软件设计引物和探针。将所设计引物进行Blast比对,分析并确定所用引物的特异性[8, 9]。所用引物和TaqMan?MGB 探针由上海基康生物技术有限公司合成,探针5′端标记FAM,3′端标记MGB,其序列见表 1。
应用High Puer Viral RNA Kit(Roche,德国)提取样本核酸,方法:取200 μl蚊虫研磨液,加入500 μl裂解液A,振荡器混匀制成悬液,加入装有纯化柱的离心管中,10 000×g离心1 min,弃废液。加入试剂B 500 μl,10 000×g离心1 min,弃废液。加入试剂C 450 μl,10 000×g离心1 min,弃废液,此步骤重做一次,空管10 000×g离心1 min,最后加入100 μl去离子水12 000×g离心1 min,得到样本核酸。 1.4 实时荧光RT-PCR 引物反应性实验
使用One Step RT-PCR Kit对NDiV进行RT-PCR反应,反应体系为25 μl,反应体系组分如下:12×One Step RT-PCR bufferⅢ12.5 μl,Mg2+(25 mmol/L)1 μl,TaKaRa Ex Taq HS 0.5 μl,PremeScript RT Enzyme MixⅡ 0.5 μl,上、下游引物(10 μmol/L)各1 μl,RNase Free dH2O 3.5 μl,NDiV RNA模板为5 μl。循环参数:反转录反应 42 ℃ 30 min;95 ℃ 10 min;PCR反应:95 ℃ 10 s,55 ℃ 30 s,40个循环。PCR产物在2%琼脂糖凝胶上进行电泳,电压120 V,电流25 mA,电泳30 min,经紫外分光透射分析仪分析。 1.5 TaqMan?MGB 探针实时荧光PCR 反应体系的建立和优化
按照One Step RT-PCR Kit(Perfect Real?time)试剂盒推荐的反应体系和循环参数,在此基础上对反应体系中的探针和引物的浓度进行优化,建立一步法TaqMan?MGB 探针实时荧光RT-PCR反应体系,反应体系体积为25 μl。根据引物、探针的退火温度,在LightCycler 480荧光定量仪器中进行一步法检测,并调整选择最佳反应温度。 1.6 TaqMan?MGB探针实时荧光PCR
反应体系的评估 1.6.1 特异性实验
病毒株包括登革热1~4血清型病毒、乙脑病毒、人呼吸道合胞病毒、轮状病毒、星状病毒、腺病毒、NDiV标准株。提取上述10种病毒的核酸。用建立的NDiV荧光定量RT-PCR系统进行检验,以验证所建立体系的特异性。 1.6.2 灵敏度实验
选取NDiV病毒标准株作为灵敏度的研究对象,该病毒株用50%终点法进行病毒滴度计算,最后确定病毒滴度浓度为1.41×106 PFUs/ml,用RNase Free dH2O 将病毒液10倍系列稀释至0.1 PFUs/ml。以浓度1×106 PFUs/ml~0.1 PFUs/ml 的7个线性梯度进行荧光定量RT-PCR反应,同时制定标准曲线,确定检测范围。 1.6.3 稳定性实验
将NDiV核酸含量不同的4份样品(A、B、C、D)进行5管反应量平行检测,对得到的Ct值进行统计学分析,计算各样品Ct值的均值、标准差和变异系数,以评价反应的稳定性。 1.7 蚊媒携带NDiV情况
通过布放诱蚊灯,按照每个采集点的实际情况,设为居民区、学校、医院、工地、公园、场馆共6个不同区域,采集蚊虫标本,标本采集后及时进行处理。将蚊虫研磨液的上清提取RNA。用新建立的RT-PCR方法检测蚊虫携带NDiV情况。 2 结 果 2.1 TaqMan?MGB
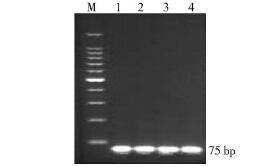
探针实时荧光PCR反应性结果探针与引物组合到One step RT-PCR Kit(Perfect Real?time)反应体系中,进行实时荧光PCR 检测,荧光曲线图呈“S”形。将RT-PCR产物在2%琼脂糖凝胶进行电泳,经紫外透射仪观察,发现在约75 bp处有一特异亮带,而无其他非特异扩增带,与预期扩增片段大小一致(图 1)。说明设计的引物能有效扩增目的靶基因。
|
| 注: M. 100 bp DNA Marker; 1~4. 深圳分离的4株NDiV的RT?PCR产物。 图 1 RT-PCR产物结果 Figure 1 RT-PCR product results |
反应体系的优化结果 在One step RT-PCR Kit(Perfect Real?time)试剂盒推荐反应条件的基础上,经过多次实验,得到RT-PCR最佳反应条件。优化参数:42 ℃ 30 min;95 ℃ 10 min;95 ℃ 5 s,54 ℃ 30 s,40个循环,退火/延伸阶段采集荧光信号。固定上、下游引物浓度相同进行优化,结果显示上、下游引物、探针三者浓度比为2∶2∶1(引物为0.4 μmol/L,探针为0.2 μmol/L)时扩增效果最好。
在One Step RT-PCR(Perfect Real?time) 试剂盒已知Mg2+浓度的条件下,调整Mg2+浓度增加0.1 μmol/L。反应体系体积为25 μl,各组分如下:2×buffer(内含Mg2+、dNTP) 12.5 μl,TaKaRa Ex Taq HS(5 U/μl) 0.5 μl,PremeScript RT Enzyme MixⅡ0.5 μl,上、下游引物(10 μmol/L)各2 μl,TaqMan?MGB探针(10 μmol/L)1 μl,Mg2+(50 mmol/L)0.5 μl,RNase Free dH2O 1.5 μl,RNA 模板5 μl。 2.3 特异性实验结果
TaqMan?MGB荧光PCR结果显示登革热1~4血清型病毒、乙脑病毒、人呼吸道合胞病毒、轮状病毒、星状病毒、腺病毒均无特异扩增,只与NDiV病毒株有特异性扩增曲线。 2.4 灵敏度实验结果
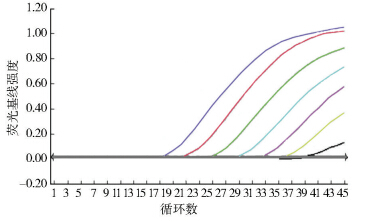
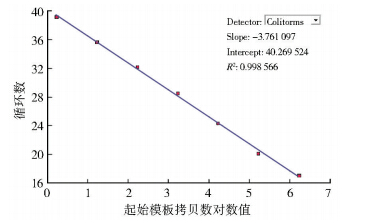
将标准株核酸用RNase Free dH2O稀释成1×106 PFU/ml~0.1 PFU/ml共7个梯度,经一步法实时荧光RT-PCR得到标准曲线图(图 2、3),发现7个线性梯度的检测标准曲线呈等距性和平行性,具有较好的梯度性。以Ct值<38为阳性判定结果,最低检测下限为1 PFU,标准曲线相关系数为0.998 566。
|
| 图 2 不同梯度标准株核酸RT-PCR扩增曲线 Figure 2 Amplification curve of TaqMan MGB RT-PCR for a different gradient standard of plasmid DNA |
|
| 图 3 不同梯度标准株核酸扩增形成的标准曲线 Figure 3 Standard curve of a different gradient standard strains of plasmid DNA by TaqMan MGB RT-PCR assay |
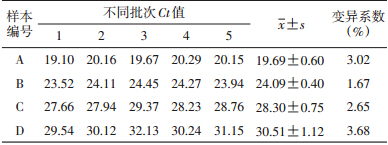
将4份核酸含量不同的样本(A、B、C、D)重复检测5次,将得到的Ct值计算平均值、标准差及变异系数(表 2),各批次样本Ct 值均为阳性,变异系数范围在1.67%~3.68%,稳定性较好。
在龙岗区采集的蚊虫标本中,将蚊虫标本研磨液分178批,其中致倦库蚊占93.76%,为优势蚊种,而伊蚊标本占总采集标本的4.10%。对蚊虫研磨液标本进行检测,发现NDiV 32份(18.00%),检测到NDiV核酸阳性的标本样本全部为致倦库蚊,说明龙岗区携带NDiV的主要蚊种是致倦库蚊。在6个不同区域中,以居民区、医院和场馆的蚊虫携带NDiV比例最高,分别为22.00%、25.00%和31.00%。其他区域蚊虫携带NDiV比例较低。 3 讨 论
越南的NDiV毒株主要从杂鳞库蚊(Culex vishnui)和三带喙库蚊(Culex tritaeniorhymchus)中分离,而龙岗区监测的NDiV毒株是从致倦库蚊中发现,提示NDiV可能以库蚊作为主要传播媒介。同时,龙岗区蚊类构成主要以库蚊为主,为NDiV的传播提供了有利条件。从遗传进化关系发现,深圳市NDiV与越南病毒株归于同一进化支,两者同属蚊虫传播的新型套式病毒,机构和转录机制等方面同样相似,以NDiV代表的虫媒套式病毒与冠状病毒的进化分支相近,提示两种病毒存在遗传进化关系,由于冠状病毒的宿主主要为哺乳类动物,以NDiV代表的虫媒套式病毒的宿主是否也包括人及有关的哺乳类动物,有待进一步研究。
据报道,每年在越南有30%~50%的急性病毒性脑炎综合征患者是由肠道病毒、黏液病毒、单纯疱疹病毒和乙脑病毒引起,且大多数病例的病原体未能确定,而在越南急性病毒性脑炎综合征患者脑脊液中的NDiV可能是引起急性脑炎综合征的新型病原体之一,因此NDiV是否有可能成为新发的虫媒病毒仍需进行深入的研究及论证。本研究使用的TaqMan?MGB 探针不同于普通的TaqMan探针,能提高探针的TM值和信噪比,使探针长度缩短,从而增加探针的灵敏度及稳定性。此外,TaqMan?MGB探针在3′端的淬灭基团为不发光荧光基团,并且与报告基因在空间的位置更接近,实验结果更精确,分辨率更高,从而降低非特异性荧光背景,提高敏感性。本研究选取NDiV的RdRp保守区域,较易设计出高特异性的探针。本研究方法具有特异和快速的特点,为病毒的检测提供了重要方法。在病毒检测中,RT-PCR和病毒分离鉴定可以互为补充,以达到准确检测的目的。
| [1] | Nga PT, del Carmen Parquet M, Lauber C, et al. Discovery of the first insect nidovirus, a missing evolutionary link in the emergence of the largest RNA virus genomes[J]. PLoS Path, 2011, 7(9):e1002215. |
| [2] | 刘渠, 林琳, 周健明, 等. 中国国内首次发现 Nam Dinh 病毒[J].病毒学报, 2013, 29(1):1-6. |
| [3] | Zirkel F, Kurth A, Quan P-L, et al. An insect nidovirus emerging from a primary tropical rainforest[J]. mBio, 2011, 2(3):e00077-11. |
| [4] | Gorbalenya AE, Enjuanes L, Ziebuhr J, et al. Nidovirales:evolving the largest RNA virus genome[J]. Virus Res, 2006, 117(1):17-37. |
| [5] | Phan TN, Nguyen TT, Komichi M, et al. Emerging viruses associated with acute encephalitis syndrome in vietnam[C]//Scientific conference of the institut pasteur international network:emerging and re-emerging viral infections. Hanoi:National Institute of Hygiene and Epidemiology, 2006. |
| [6] | 沃恩康, 王怡婷, 吴海波, 等. 双重实时荧光PCR对流感病毒检测及分型方法的研究[J]. 中国卫生检验杂志, 2013, 23(1):1-4, 8. |
| [7] | 周其伟, 高秀洁, 陈华云, 等. H7N9禽流感病毒实时荧光RT-PCR检测方法的建立与评价[J]. 热带医学杂志, 2015, 15(1):36-39, 61. |
| [8] | 罗雅艳, 冯俊杰, 方丹云, 等. 登革病毒TaqMan MGB实时荧光定量PCR检测方法的建立及初步应用[J]. 分子诊断与治疗杂志, 2012, 4(3):158-162. |
| [9] | 谭翰清, 郭赐贶, 谭海芳, 等. 诺如病毒遗传组Ⅰ型TaqMan-MGB探针实时荧光RT-PCR的研究[J]. 热带医学杂志, 2008, 8(10):1030-1033, 1040." |
 2015, Vol. 26
2015, Vol. 26