扩展功能
文章信息
- 潘婧, 邱星辉
- PAN Jing, QIU Xing-hui
- 不同家蝇种群拟除虫菊酯杀虫剂抗性基因频率的比较研究
- Population-specific frequency change of pyrethroid resistance alleles in different Musca domestica populations in China
- 中国媒介生物学及控制杂志, 2015, 26(5): 443-446
- Chin J Vector Biol & Control, 2015, 26(5): 443-446
- 10.11853/j.issn.1003.4692.2015.05.003
-
文章历史
- 收稿日期: 2015-06-11
- 网络出版时间: 2015-08-12 13: 54
2 中国科学院大学, 北京 100049
2 University of Chinese Academy of Sciences, Beijing 100049, China
家蝇(Musca domestica)是一种重要的疾病传媒。长期以来,家蝇的控制依赖于杀虫剂的使用,其中拟除虫菊酯类杀虫剂的使用最为广泛,使家蝇对其普遍产生了抗药性。通常认为,杀虫剂抗性等位基因在种群中的出现是昆虫适应杀虫剂选择压的结果,由此推测,抗性等位基因在无杀虫剂选择下具有适合度代价。抗性适合度是昆虫抗药性研究的一个核心内容,这方面的知识对于预测抗性的发生发展具有重要指导意义。有关家蝇对拟除虫菊酯类杀虫剂抗药性与家蝇适合度之间关系的研究很少,为此我们在检测了我国5个家蝇种群钠离子通道和细胞色素P450(CYP6D1v1)抗性等位基因的分布与频率的基础上[1],分析了在无杀虫剂选择压下抗性等位基因频率的变化,由此推测不同抗性等位基因的适合度效应,为家蝇抗药性风险防范和治理对策的制定提供参考。 1 材料与方法 1.1 家蝇
本研究涉及5个家蝇种群,于2009年分别采自广东、上海、山东、北京和吉林省(直辖市)[1]。 5个种群均表现出对拟除虫菊酯类杀虫剂的抗性[1, 2]。各地种群分别在实验室条件下25 ℃常规饲养,每代以500~1000只成虫传代,期间不接触任何杀虫剂。 1.2 主要仪器与设备
PCR试剂盒和相关限制性DNA内切酶(TaKaRa大连宝生物工程有限公司)、DNA Marker(天根生化科技有限公司)、琼脂糖(西班牙Biowest公司);PCR仪(MyCyclerTM thermal cycler,美国 Bio?RAD公司)、电泳仪(美国Bio?RAD公司)、凝胶紫外分析仪(美国Bio?RAD公司)。 1.3 家蝇拟除虫菊酯杀虫剂抗性基因的基因型测定
参考Rinkevich等[3]的方法提取单只家蝇的基因组DNA。每个种群样本数不少于30个。家蝇个体的细胞色素P450基因(CYP6D1)和钠离子通道基因的基因型分别采用 Qiu等[4]和Rinkevich等[3]建立的限制性片段长度多态性聚合酶链反应(PCR?RFLP)方法进行测定。出于比较目的,本研究引用了2009年笔者所在实验室已发表的研究结果[1]。 1.4 钠离子通道基因单倍型分析
参考Rinkevich等[3]的方法,采用PCR扩增方法,扩增出包含抗性突变位点约350 bp的钠离子通道基因片段。PCR产物经胶纯化后,与pGEM载体连接后,转化大肠埃希菌细胞。筛选出阳性克隆,送华大基因公司测序。根据测序结果和比对分析,区分出不同的单倍型。 2 结 果 2.1 CYP6D1v1抗性基因频率变化
如图 1所示 ,2012年与2009年比较,广东、上海、北京家蝇种群CYP6D1v1抗性等位基因的频率升高,广东种群由起始的0.22上升到0.68,北京和上海种群分别由0.10上升到0.30和0.24。山东、吉林种群的CYP6D1v1等位基因频率分别由0.01和0.04下降至不可检测和0.01。
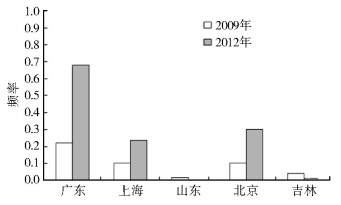
|
| 图 1 5个家蝇种群CYP6D1v1基因的频率 Figure 1 Frequency of CYP6D1v1 allele in five housefly populations |
各地区家蝇种群CYP6D1基因型频率见图 2。与2009年的数据比较,这些种群在实验室饲养3年后,CYP6D1基因型频率发生了种群特异性变化。广东种群变化显著,抗性纯合子频率上升为0.49,敏感纯合子频率下降至0.13,而杂合子频率变异不大。上海种群家蝇也表现为抗性纯合子频率上升和敏感纯合子频率下降的变化趋势,只是杂合子频率增加了1倍。北京种群表现为敏感纯合子频率的显著下降,以及杂合子和抗性纯合子频率的成倍上升。而山东和吉林种群则表现为敏感纯合子频率增加,杂合子频率下降。
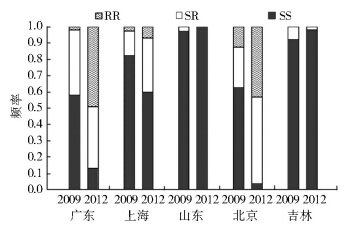
|
| 注: RR. 抗性纯合子; SR. 杂合子; SS. 敏感纯合子。 图 2 2009和2012年5个家蝇种群CYP6D1基因型频率 Figure 2 Frequency of CYP6D1 genotypes in five housefly populations |
5个地区采集的家蝇kdr?his抗性等位基因频率见图 3。从图中可以看到,抗性等位基因频率增加的有上海和北京种群,其中上海种群由0.04上升到0.10,北京种群由0.05上升到0.08。 其他3个种群(广东、山东和吉种群)下降,特别引人注意的是山东种群,kdr?his基因频率由起始较高的0.33降至0。
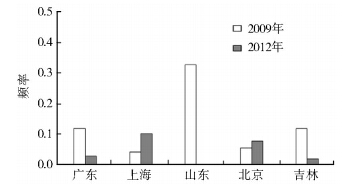
|
| 图 3 5个家蝇种群kdr-his基因频率 Figure 3 Frequency of kdr?his allele in five housefly populations |
在5个研究种群中,只在广东种群检测到kdr抗性等位基因,以杂合子基因型存在(L/F),其频率3年后无明显改变。在这些种群中,广东、山东和吉林种群伴随着杂合子(H/L)频率的下降,敏感纯合子(L/L)频率上升,其中山东种群变化的程度大(敏感纯合子0.44上升为1.00,杂合子消失)。相反,北京和上海种群表现敏感纯合子频率下降而杂合子频率上升。抗性纯合子(H/H)在2009年只在广东和山东种群检测到,其频率至2012年有所下降,但在2012年上海种群样品中也检测到抗性纯合子的存在,频率上升(图 4)。
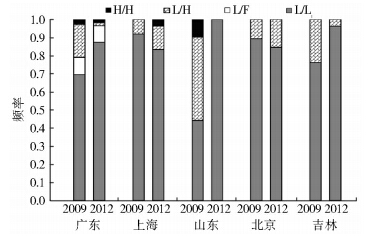
|
| 注: H/H. 抗性纯合子; L/H. 杂合子; L/F. 杂合子; L/L. 敏感纯合子。 图 4 2009和2012年5个家蝇种群钠离子通道基因型频率 Figure 4 Frequency of Vssc genotypes in five |
通过对广东、山东、北京和上海家蝇种群包含kdr?his等位突变的个体其钠离子通道基因片段的序列测定和比对分析,鉴别出3种不同的单倍型。其中来源于广东种群的单倍型(GD)核苷酸序列变异最大,而北京种群和上海种群具有相同的kdr?his单倍型(图 5)。

|
| 注: *表示各序列中该位点具有相同的核苷酸。 图 5 包含kdr?his抗性突变的钠离子通道单倍型序列比对 Figure 5 Alignment of fragment sequences of voltage?sensitive sodium channel gene containing the kdr?his mutation |
现有的研究结果表明,家蝇对拟除虫菊酯的抗性有两个主要机制:靶标钠离子通道基因突变导致的杀虫剂不敏感性(靶标抗性)和细胞色素P450基因上调表达导致的杀虫剂代谢作用增强(代谢抗性)[5]。钠离子通道是拟除虫菊酯杀虫剂的主要靶标,其关键氨基酸位点的突变可以改变其对杀虫剂的敏感性。在家蝇的钠离子通道基因中发现了3类抗性相关的突变,即kdr(L1014F)、kdr?his(L1014H) 和superr?kdr(M918T+L1014F),其中kdr?his在我国家蝇中普遍分布且频率更高[1]。细胞色素P450 CYP6D1的过量表达与家蝇对拟除虫菊酯类农药抗性相关,现只鉴定CYP6D1的一个抗性等位基因(CYP6D1v1),其显著特征是该基因的5′-侧翼区存在一个15 bp的插入片段[6, 7],在亚洲、欧洲和美洲的家蝇种群中有分布[5],在我国家蝇种群中也普遍存在[1, 2]。
比较我国不同种群基因频率的变化,可以看到在无杀虫剂选择下3年后,CYP6D1v1基因频率在广东、上海、北京种群中大幅上升,而且敏感纯合子频率显著下降(图 1、2)。从中可以推测,CYP6D1v1抗性等位基因不存在适合度代价,甚至表现出一定的适合度优势,这一结果与美国的研究结果相同[8]。CYP6D1v1在山东与吉林种群中消失可能不是因为适合度代价,而是由于其起始频率太低(图 1),在实验室长期传代过程中基因遗传漂变的结果。
kdr?his的基因频率变化因种群的不同而有所不同,在广东、山东、吉林3个种群中下降,在上海和北京种群中上升(图 3),而敏感纯合子频率在广东、山东、吉林种群中上升,在上海和北京种群中下降(图 4)。基因频率变动表现出种群差异的原因可能是不同种群中钠离子通道基因虽然均存在1014H(kdr?his)位点突变,但其他位点的核苷酸有所不同而形成不同的单倍型,且不同的单倍型具有不同的适合度,这一推测得到了序列比对结果的支持(图 5)。基因序列比对结果表明不同种群kdr?his等位基因可以进一步区分为不同的单倍型。频率上升的上海和北京种群拥有相同的kdr?his单倍型(BJ、SH),频率下降的单倍型为广东(GD)和山东(SD)种群。
综上所述,家蝇杀虫剂抗性的进化是复杂的,而且往往是种群特异性的。不同的野外家蝇种群其抗性等位基因类型和频率因种群遗传背景、当地使用的杀虫剂种类和强度的不同而有所不同。在一定环境条件下,抗性基因频率的变化受种群中各等位基因的相对适合度以及基因型(等位基因组合)的相对适合度制约,而且因环境的变化而变化[8]。考虑到不同家蝇种群因等位基因组成和个体基因型的不同,即使种群具有相同的抗性等位基因,其适合度表现也会因环境的不同而改变,因此抗性检测和抗性治理要因地制宜、因时制宜。 志谢 家蝇的采集得到广东省疾病预防控制中心(CDC)蔡松武、上海市CDC冷培恩、山东省CDC霍新北、吉林省CDC彭渤等的帮助,特此志谢
| [1] | Wang QM, Li M, Pan J, et al. Diversity and frequencies of genetic mutations involved in insecticide resistance in field populations of the house fly (Musca domestica L.) from China[J]. Pestic Biochem Physiol, 2012, 102(2):153-159. |
| [2] | Gao Q, Li M, Sheng CF, et al. Multiple cytochrome P450s overexpressed in pyrethroid resistant house flies (Musca domestica)[J]. Pestic Biochem Physiol, 2012, 104(3):252-260. |
| [3] | Rinkevich FD, Zhang L, Hamm RL, et al. Frequencies of the pyrethroid resistance alleles of Vssc1 and CYP6D1 in house flies from the eastern United States[J]. Insect Mol Biol, 2006, 15(2):157-167. |
| [4] | Qiu XH, Pan J, Li M, et al. PCR-RFLP methods for detection of insecticide resistance-associated mutations in the house fly (Musca domestica)[J]. Pestic Biochem Physiol, 2012, 104(3):201-205. |
| [5] | 邱星辉. 细胞色素P450在家蝇抗药性中的作用[J]. 中国媒介生物学及控制杂志, 2014, 25(6):591-593. |
| [6] | Scott JG, Liu NN, Wen ZM, et al. House-fly cytochrome P450 CYP6D1: 5′flanking sequences and comparison of alleles[J]. Gene, 1999, 226(2):347-353. |
| [7] | Seifert J, Scott JG. The CYP6D1v1 allele is associated with pyrethroid resistance in the house fly, Musca domestica[J]. Pestic Biochem Physiol, 2002, 72(1):40-44. |
| [8] | Rinkevich FD, Leichter CA, Lazo TA, et al. Variable fitness costs for pyrethroid resistance alleles in the house fly, Musca domestica, in the absence of insecticide pressure[J]. Pestic Biochem Physiol, 2013, 105(3):161-168." |
 2015, Vol. 26
2015, Vol. 26


