扩展功能
文章信息
- 阳帆, 张仁利, 刘阳, 张韶华, 黄达娜, 吴春利, 李玥, 唐屹君
- YANG Fan, ZHANG Ren-li, LIU Yang, ZHANG Shao-hua, HUANG Da-na, WU Chun-li, LI Yue, TANG Yi-jun
- 深圳市白纹伊蚊细胞色素C氧化酶亚基Ⅰ基因多态性分析
- Genetic polymorphism analysis on mtDNA-COⅠ of Aedes albopictus in Shenzhen, China
- 中国媒介生物学及控制杂志, 2015, 26(4): 337-340
- Chin J Vector Biol & Control, 2015, 26(4): 337-340
- 10.11853/j.issn.1003.4692.2015.04.002
-
文章历史
- 收稿日期:2015-05-01
登革热是由登革热病毒(dengue virus,DEN)1~4型引起的急性蚊媒传染病,已成为全球性的严重公共卫生问题[1, 2]。登革热病毒主要传播媒介为埃及伊蚊(Aedes aegypti)和白纹伊蚊(Ae. albopictus)。目前,我国城市化的快速发展改变了伊蚊赖以生存的生态环境,导致埃及伊蚊种群分布受限,而白纹伊蚊种群分布越来越广泛,使其成为我国传播登革热病毒的主要媒介[3]。深圳市地处南海之滨,属亚热带海洋性气候,适宜白纹伊蚊的生存繁殖,加之处于登革热流行地区的包围中,国内、国际交往日益频繁,人员流动性大,增加了其传播的危险性,应加大监测和防治力度。由于对登革热尚无有效的药物和疫苗,因此预防和控制登革热取决于有效的病媒控制措施。蚊虫传播病原体的能力受其遗传因素的控制,在长期的进化过程中,因环境的选择压力导致种群间基因交流、种群遗传结构出现变化,从而产生蚊虫遗传多样性。利用多种分子生物学技术对不同地区蚊虫种群进行遗传分析,了解它们的差异与传播疾病能力之间的关系对控制虫媒传染病具有重要价值。线粒体细胞色素氧化酶亚基Ⅰ(mtDNA-COⅠ)作为编码线粒体细胞色素3个亚单位中最大最保守的基因片段,是研究蚊虫分子遗传进化常用的分子标记靶点[4]。目前,关于白纹伊蚊种群mtDNA-COⅠ基因特征和系统进化关系国内报道不多,深圳地区尚未见报道。本研究尝试对深圳市不同地理株的白纹伊蚊种群COⅠ基因多态性进行分析,探讨不同种群COⅠ基因遗传差异和分化现象,从分子水平上探索其与登革热流行的关系,为制定登革热防控策略提供理论依据。 1 材料与方法 1.1 白纹伊蚊标本来源
根据以往登革热曾暴发流行以及媒介调查显示布雷图指数较高存在流行危险的原则,选择深圳市8个不同区域,包括龙岗、光明、福田、大鹏、罗湖、龙华、南山和宝安区,按每个地区的东、西、南、北、中分不同5个点,捕捞各类积水容器中的蚊幼虫和蛹,做好标记带回实验室分类鉴定。 1.2 白纹伊蚊饲养
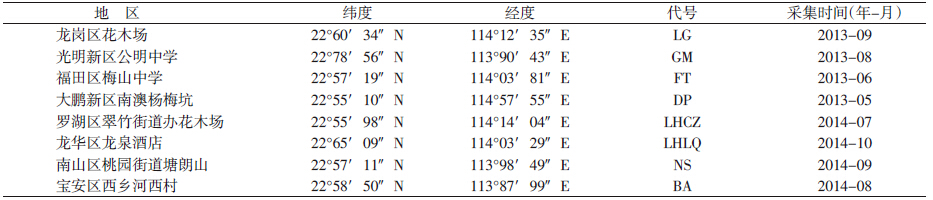
在室内温度(27±1)℃、相对湿度(70±5)%的实验条件下,每日光照12 h,用酵母粉喂养白纹伊蚊幼虫,收集羽化1~2 d的成蚊,干燥,经鉴定后储存于75%乙醇,-20 ℃冰箱备用(表 1)。
 |
采用天根生物TIANampMicro DNA Kit(DP316)微量样品基因组DNA提取试剂盒(离心柱型)提取单蚊基因组DNA,具体操作步骤详见试剂盒说明书,最后将40 μl 蚊虫基因组DNA溶液收集到离心管中,置-20 ℃冰箱保存待用。 1.4 mtDNA-COⅠ基因序列扩增
按照文献[5]设计2对引物分别扩增COⅠ基因片段,预期扩增序列完全覆盖COⅠ基因区域。引物具体序列见表 2,均由TaKaRa公司合成。
 |
采用常规方法用TaKaRa 公司高保真酶PrimeSTAR HS DNA Polymerase(DR010S)进行扩增。50 μl 反应体系中包括5×PCR buffer 10 μl,2.5 mmol/L MgCl2 4 μl,Taq DNA聚合酶0.5 μl,正、反向引物各1 μl,双蒸水28.5 μl,DNA模板5 μl。COⅠ-1的反应条件:98 ℃预变性2 min;98 ℃变性10 s,50 ℃退火10 s,72 ℃延伸45 s,共30个循环;72 ℃后延伸5 min。COⅠ-2 的反应条件:98 ℃预变性2 min;98 ℃变性10 s,54 ℃退火10 s,72 ℃延伸1 min,共30个循环;72 ℃后延伸5 min。扩增后4 ℃保存,每次扩增设立阴性对照。用1%的琼脂糖凝胶电泳检测PCR产物,凝胶成像系统观察分析并记录结果。 1.5 DNA序列测定和分析
分别取深圳市8个地区5 个点共40 只白纹伊蚊的PCR 产物进行测序。获得的COⅠ基因PCR产物由TaKaRa公司纯化后,使用ABI373 DNA序列自动测序仪进行序列测定,经正、反方向测序后,互补配对验证。用DNAStar软件中的seqMan拼接成完整的COⅠ基因序列。测出的序列用NCBI BLASTn 对GenBank 数据库进行同源性检索,并应用Clustal X 1.83软件进行排序及同源性分析,用Mega 3.1软件构建系统发生树,采用基于Kimura 双参数校正模型的邻接法(neighbor-joining,NJ)方法,并用Bootstraping法对系统发生树进行评估,Bootstrap次数设置为1000。其他参考序列来自GenBank。 2 结果 2.1 mtDNA-COⅠ基因扩增
应用上述引物PCR扩增深圳市8个不同地区白纹伊蚊mtDNA-COⅠ基因,在1%琼脂糖凝胶电泳上分别获得707和860 bp左右的扩增片段,与预期大小相符(图 1)。

|
| 图 1 深圳市不同采集点白纹伊蚊mtDNA-COⅠ基因PCR扩增结果 Figure 1 PCR products of mtDNA-COⅠ genes of Ae. albopictus from different collection sites |
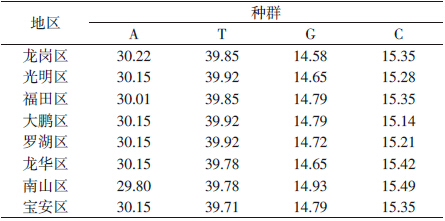
测序得到的40个白纹伊蚊样品mtDNA-COⅠ基因碱基序列长度相同,均为1433 bp,所有序列均未发现碱基插入和缺失,而同一地理环境的5只白纹伊蚊mtDNA-COⅠ基因序列无差异。将这8个区的样品序列与GenBank收录的白纹伊蚊线粒体全序列(NC_006817.1)进行比较,与其中编码COⅠ基因的序列相似性均达到99%以上。8条COⅠ基因序列中A、T、G、C碱基的平均含量为30.10%、39.84%、14.74%和15.32%,A+T的平均含量为69.94%,明显高于G+C的平均含量(30.06%),符合昆虫线粒体A、T碱基偏好性的基因规律(表 3)。
 |
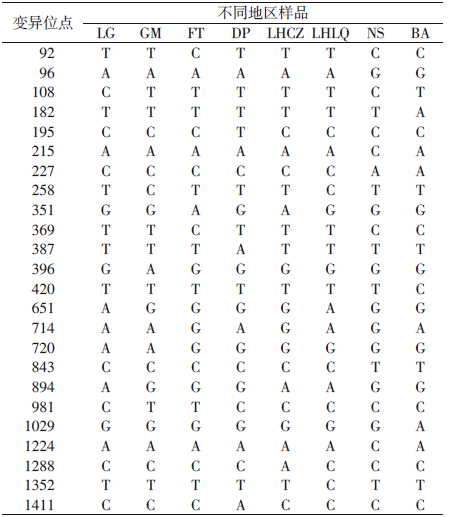
来自深圳市不同地理环境的白纹伊蚊个体在COⅠ区域同一性在99%以上,但也表现出个体的多态性。不同样品的COⅠ基因序列中保守位点1409个,变异位点24个(1.67%),其中17处出现转换,包括2次A-G转换,6次G-A转换,7次T-C转换,2次C-T转换,碱基转换率为1.18%;7处出现颠换,包括2次C-A颠换,3次A-C颠换,2次T-A颠换,碱基颠换率为0.48%(表 4)。遗传分析表明不同采样点白纹伊蚊样品间的差异为0~0.80%。
 |
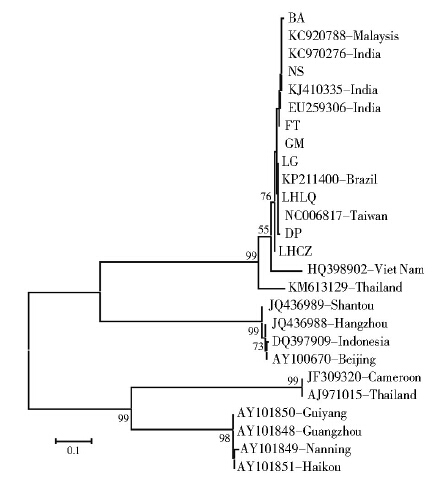
从系统发生树可以看到,深圳市不同采样点白纹伊蚊线粒体COⅠ基因存在个体差异,对8份白纹伊蚊COⅠ基因序列基于K2P计算个体间的距离,其种内距离的范围在0.000~0.008之间,符合大部分种内距离<1%的遗传差异[6],与我国台湾、印度[7]、马来西亚[8]、巴西的白纹伊蚊聚成一类(图 2)。
|
| 图 2 深圳市不同采样点白纹伊蚊的系统发生树 Figure 2 Phylogenetic analysis of Ae. albopictus from different collection sites in Shenzhen, China |
白纹伊蚊作为登革热的主要传播媒介,由于其分布范围广、活动时间长,对于我国大部分地区特别是东南沿海一带登革热的流行起着重要的作用。深圳市已调查证实广泛存在白纹伊蚊,近10多年来每年均有到东南亚、非洲等国家旅游务工人员感染登革热的输入性病例报告,疫情多呈散发。2010年,深圳市福田区报告了首起本地登革热聚集性暴发疫情,同年深圳市周边地区东莞市兴塘社区也报告了登革热社区暴发疫情。2014年深圳市登革热疫情严峻,本地病例和输入性病例同比大幅上升(另文发表)。由于目前没有登革热疫苗以及特效的临床治疗办法,控制登革热流行的有效手段仍然是控制媒介蚊虫。据文献报道,蚊虫传播病原体的有效性与其本身的媒介易感能力相关,且蚊虫对病毒的易感性是影响病毒流行与扩散的关键因素之一,其中最主要因素是蚊虫本身遗传背景之间的差异[9, 10]。利用分子生物学技术研究不同环境下白纹伊蚊种群遗传结构的差异或者改变,对制定白纹伊蚊防控措施有着重要参考价值,也是评估登革热传播风险的分子基础。本研究采集深圳市8个地区白纹伊蚊标本,结果表明测序的白纹伊蚊COⅠ基因序列同一性在99%以上,白纹伊蚊遗传距离极小,在种内变异的范围内。同时也发现不同个体表现出单核苷酸的多态性,其变异率为1.67%,低于广州市的1.69%[11]。共出现17处转换(70.83%)和7处颠换(29.16%),转换频率比颠换高,表明深圳地区白纹伊蚊种群尚未出现分化。此外,与广州市白纹伊蚊株比较,变异位点也不完全相同,仅96(A→G)、182(T→A)、215(A→C)、227(A→C)、420(T→C)5处核苷酸变异一致,这些变异位点与白纹伊蚊对不同型别登革热病毒易感性之间的关系还有待进一步探讨。
研究表明蚊虫群体遗传多态性的形成离不开蚊虫所在分布地区的地理差异(如海拔高度)、气候特征(如气温、降雨量、湿度),蚊虫的生态习性和人类的活动(如灭蚊措施、城市化发展)等因素[12]。本研究中深圳市白纹伊蚊不同采样点纬度均相同,分析其COⅠ基因序列出现多态性,推测与采样点的分布有关,而且可能与人群活动关系密切。从系统发生树可以看到大鹏、光明新区采样点分布在深圳市非城市中心地带,其人口密度和人口流动性相对于罗湖、福田、南山等中心城区较低,但它们也与中心城区采样点的白纹伊蚊聚成一类;另一方面,罗湖、福田、南山关内区域以及龙华区、宝安区和龙岗区关外区域采样点的白纹伊蚊均未出现明显的独立聚类。城市化程度高和灭蚊措施的实施使得深圳市白纹伊蚊孳生环境发生变化可能是导致不同采样点白纹伊蚊基因出现差异的原因,但这种改变是否能经过不同环境的选择作用并在较长时间的淘汰作用下保留下来并引起显著的遗传变异,可考虑下一步扩大样本量进行证实。
深圳市是经济特区,口岸众多,城市化发展快,人口密度高,流动性大,与东南亚国家及我国台湾地区等登革热高发地域交流密切。从白纹伊蚊COⅠ基因系统进化树发现,深圳市白纹伊蚊地理株与我国台湾株、印度株、马来西亚株以及巴西株同源性较高,在进化树的同一分支上,而与我国其他地区包括汕头、杭州、广州、北京、贵阳、南宁、海口市同源性相对较低。是否会导致深圳市白纹伊蚊地理种群对登革热1~4型病毒存在易感性差异,影响不同型别的登革热病毒在深圳市的流行与扩散还需深入研究。
| [1] | Guzman MG,Kouri G. Dengue: an update[J]. Lancet Infect Dis, 2002,2(1):33-42. |
| [2] | 杨佩英,秦鄂德. 登革热和登革出血热[M]. 北京:人民军医出版社,1999:3-43. |
| [3] | Wu JY,Lun ZR,James AA,et al. Dengue fever in mainland China[J]. Am J Trop Med Hyg,2010,83(3):664-671. |
| [4] | Beard CB,Hamm DM,Collins FH. The mitochondrial genome of the mosquito Anopheles gambiae:DNA sequence,genome organization,and comparisons with mitochondrial sequences of other insects[J]. Insect Mol Biol,1993,2(2):103-124. |
| [5] | Zhong D,Lo E,Hu R,et al. Genetic analysis of invasive Aedes albopictus populations in Los Angeles county,Californiaand its potential public health impact[J]. PLoS One,2013,8(7):e68586. |
| [6] | Hebert PD,Ratnasingham S,deWaard JR. Barcoding animal life:cytochrome c oxidase subunit 1 divergences among closely related species[J]. Proc Biol Sci,2003,270 Suppl 1:S96-99. |
| [7] | Kumar NP,Rajavel AR,Natarajan R,et al. DNA barcodes can distinguish species of Indian mosquitoes(Diptera:Culicidae)[J]. J Med Entomol,2007,44(1):1-7. |
| [8] | Zawani MK,Abu HA,Sazaly AB,et al. Population genetic structure of Aedes albopictus in Penang,Malaysia[J]. Genet Mol Res,2014,13(4):8184-8196. |
| [9] | Gratz NG. Critical review of the vector status of Aedes albopictus[J]. Med Vet Entomol,2004,18(3):215-227. |
| [10] | Kamgang B,Brengues C,Fontenille D,et al. Genetic structure of the tiger mosquito,Aedes albopictus,in Cameroon(Central Africa)[J]. PLoS One,2011,6(5):e20257. |
| [11] | 蔡燕丽,罗雷,郑学礼. 广州市白纹伊蚊细胞色素C氧化酶亚基Ⅰ基因遗传多态性分析[J]. 中国人兽共患病学报,2012, 28(8):781-785. |
| [12] | Braks MA, Honório NA,Lourençqo-De-Oliveira R, et al. Convergent habitat segregation of Aedes aegypti and Aedes albopictus (Diptera: Culicidae) in southeastern Brazil and Florida[J]. J Med Entomol,2003,40(6):785-794. |
 2015, Vol. 26
2015, Vol. 26

