扩展功能
文章信息
- 邹依霖, 丁奕然, 罗钱春, 陈斌
- ZOU Yi-lin, DING Yi-ran, LUO Qian-chun, CHEN Bin
- 蚊虫线粒体基因组DNA提取方法
- The extraction method of mosquito mitochondrial genome DNA
- 中国媒介生物学及控制杂志, 2015, 26(4): 333-336
- Chin J Vector Biol & Control, 2015, 26(4): 333-336
- 10.11853/j.issn.1003.4692.2015.04.001
-
文章历史
- 收稿日期:2015-03-24
线粒体是广泛存在于生物体内的一个细胞器,其基因组(mitochondrial genome)在不同动物种内的大小不一致,但在基因组组成上却很保守,大部分动物线粒体基因组包含37个基因[1, 2]。线粒体DNA具有母系遗传、进化速度快等特点,多年来其基因作为常见的分子标记,在进化生物学、分子分类、种群遗传学、系统发育与进化等多个方面广泛应用[3, 4, 5, 6, 7]。尤其在节肢动物线粒体基因组的研究上,线粒体基因组通常被认为是解决节肢动物系统发生关系的一个有力工具。
昆虫是地球上种类最多的生物类群,也是线粒体基因组研究较多的类群,目前测得昆虫线粒体基因组696种,其中双翅目昆虫90种(http://www.ncbi.nlm.nih.gov/genomes/organelle)。蚊科昆虫是最重要的医学昆虫类群,传播疟疾、登革热、流行性乙型脑炎(乙脑)等81种传染病,其中疟疾、登革热和乙脑仍是我国重要的传染病,近年疟疾在不少地方又有暴发的趋势,我国每年约有90万疟疾病例[8]。蚊媒传染病的控制主要依赖于媒介蚊虫的控制,以线粒体基因作为分子标记澄清媒介蚊虫的隐存种,研究其系统发育关系及种群的遗传特征对于蚊虫控制具有指导意义。自1990年四斑按蚊(Anophelesquadrimaculatus)线粒体基因组测序以来[9],蚊科已有23种线粒体基因组被测序(http://www.ncbi.nlm.nih.gov/genomes/organelle)。
目前主要通过提取全基因组DNA进行PCR扩增得到线粒体基因组,然而核基因组内线粒体插入序列(nuclear mitochondrial DNA,Numts)的存在,干扰了mtDNA的PCR扩增,使用蚊虫全基因组进行扩增时,往往会扩增出很多非特异性条带,从而干扰实验进行[10]。在高通量测序技术已经普及的今天,如何获取高纯度的mtDNA来推动蚊科昆虫线粒体基因组的研究非常重要。本研究报道改进的蚊虫线粒体基因组DNA提取方法和操作流程,为相关工作者提供技术支持。 1 材料与方法 1.1 实验蚊虫
中华按蚊(An. sinensis)为重庆师范大学实验室种群;斯氏按蚊(An. stephensi)和大劣按蚊(An. dirus)为中国人民解放军第三军医大学实验室种群;三带喙库蚊(Culex tritaeniorhynchus)和淡色库蚊(Cx. pipiens pallens)为中国疾病预防控制中心传染病预防控制所实验室种群。 1.2 试剂
BufferⅠ:5 mmol/L Tris,7 mmol/L蔗糖,220 mmol/L己六醇,2 mmol/L EDTA,pH 7.4;BufferⅡ:100 mmol/L Tris,40 mmol/L NaCl,2 mmol/L EDTA;20% SDS;20 mg/ml 的蛋白酶K;5.3 mol/L NaCl 溶液;异丙醇;75%乙醇;TE buffer:10 mmol/L Tris⁃HCl和1 mmol/L EDTA,pH 8.0。使用前,Buffer Ⅰ、异丙醇冷储在4 ℃备用。 1.3 线粒体DNA的提取提取
线粒体DNA的一般方法是将线粒体从细胞中首先分离出来,之后再裂解线粒体,利用DNA在盐溶液中溶解度的变化提取DNA,并用相应的有机溶剂进行抽提。本文参照Tamura和Aotsuka[11]的方法加以改进。具体操作步骤如下。
(1)取蚊虫置于干净的1.5 ml 离心管中,加入Buffer Ⅰ 300 μl,研碎匀浆后再加入1200 μl 的Buffer Ⅰ。
(2)在4 ℃条件下,将匀浆以500 r/min(离心半径10 cm)离心10 min,取上清液置于另一干净的1.5ml离心管,再次以800 r/min(离心半径10 cm)离心10 min。
(3)取上清液置于另一干净的1.5 ml 离心管,4℃条件下12 000 r/min(离心半径10 cm)离心10 min,所得沉淀即为线粒体。
(4)弃上清液,沉淀物中加入330 μl BufferⅡ,13 μl SDS和6 μl 蛋白酶K,60 ℃过夜。
(5)加入250 μl NaCl 溶液,在4 ℃ 条件下,5000 r/min(离心半径10 cm)离心10 min,再取上清液置于另一干净的1.5 ml离心管,加入480 μl 异丙醇,在4 ℃和12 000×g条件下离心15 min。
(6)去掉上清,用75%的乙醇洗涤,风干。
(7)加入10~30 μl TE Buffer 溶解,低温保存备用。 1.4 mtDNA样品鉴定
A 值测定:将提取出的DNA 取2 μl,用NanoDrop 2000全波长紫外分光光度计进行DNA的纯度与浓度检测。
琼脂糖凝胶电泳分析:采用无桥水平电泳装置。TAE为缓冲液,凝胶浓度为0.7%,在室温下以90 V恒压电泳30 min,溴化乙锭染色3 min,放置紫外成像系统中进行观察,检测其是否降解。
线粒体DNA的PCR扩增:以提取的蚊虫mtDNA样品作为模板,测定线粒体DNA的COⅠ基因片段。引物由上海生物工程有限公司合成,F:5′-GTTAAA TAA ACT ATT AAC CTT CAA A-3′;R:5′-GCT CGT GTA TCA ACG TCT ATT CC-3′。扩增长度为1050 bp,扩增PCR反应总体积为25 μl,PCR扩增的反应体系:模板DNA 2 μl,正反引物(10 μmol/L)各1 μl,再加入TaqMastermix到25 μl。PCR扩增条件:94 ℃预变性5 min,94 ℃变性1 min,52 ℃退火45 s,72 ℃延伸1 min;35个循环后,72 ℃延伸10 min。PCR产物用1%的琼脂糖凝胶电泳进行检测,并送往上海生物工程有限公司测序。 2 结果 2.1 A值测定
利用上述方法成功地提取到5种蚊虫的线粒体基因组DNA,每个种分别提取3只蚊虫,但中华按蚊提取了3种不同保存方式的蚊虫。对提取的mtDNA检测A260/A280值以及浓度(表 1),5种蚊虫中新鲜材料和-80 ℃保存的蚊虫A260/A280值在1.76~1.97,表明得到的mtDNA纯度较高,干燥标本和-20 ℃无水乙醇浸泡1年的A260/A280值均>2,说明有RNA残留。经测定新鲜和-80 ℃保存的蚊虫产率可提取0.42~0.49 μg/mg线粒体DNA,而干燥标本和-20 ℃无水乙醇浸泡的蚊虫产率仅有0.22~0.28 μg/mg。
 |
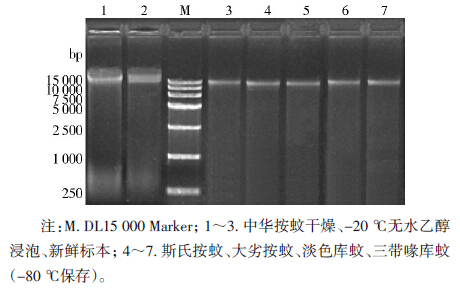
蚊虫的线粒体基因组大小为15 000~16 000 bp,在紫外成像系统中观察,与Marker对比后发现,所有蚊虫的条带均在15 000 bp左右,新鲜和-80 ℃保存的蚊虫电泳条带为清晰、整齐、均匀的一条带,背景清晰(图 1),而干燥标本和-20 ℃无水乙醇浸泡的蚊虫有严重的拖带现象。
|
| 图 1 提取的mtDNA电泳检测结果 Figure 1 The agarose gel electrophoresis of mtDNA extracted |
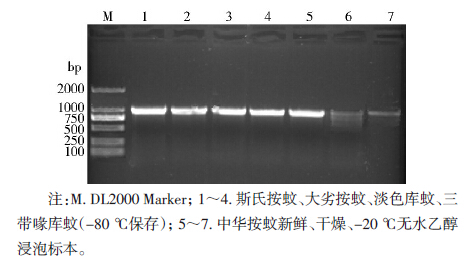
产物为1050 bp左右(图 2),所有蚊虫均能扩增出条带,新鲜和-80 ℃保存的蚊虫均能得到良好的扩增结果,而干燥标本和-20 ℃无水乙醇浸泡的蚊虫条带模糊拖带。扩增产物送生工生物工程(上海)股份有限公司测序,干燥标本和-20 ℃无水乙醇浸泡的蚊虫测序失败,其余蚊虫的测序结果经NCBI数据库比对查询,发现分别与各自的COⅠ基因同源性在99%,确定为线粒体基因。
以新鲜材料和-80 ℃保存的蚊虫提取得到的线粒体DNA为模板,用扩增线粒体基因组的引物进行PCR和克隆得到的片段,经过测序和拼接后,目前已经成功得到了中华按蚊、斯氏按蚊、大劣按蚊和淡色库蚊完整的线粒体基因组(结果另文发表)。
|
| 图 2 COⅠ基因片段扩增产物琼脂糖凝胶电泳 Figure 2 The agarose gel electrophoresis of amplification products of COⅠ fragments |
提取线粒体DNA,首先要将线粒体从细胞中分离出来,然后从纯净的线粒体中得到线粒体DNA。分离线粒体最常用的方法是将组织制成匀浆,在均匀的悬浮介质中用差速离心法进行分离[12]。获取线粒体一般先用500~1000 g,5~15 min离心去除细胞碎片,然后在11 000~20 000 g沉降线粒体[13]。但应根据各种材料的线粒体自身大小来确定,经过优化探究,最终发现提取蚊虫线粒体的最佳条件:去除细胞碎片及各种杂质的技术为500 r/min(离心半径10 cm)离心10 min,然后800 r/min 离心10 min;沉淀线粒体的技术为12 000 r/min离心10 min。得到纯净的线粒体后加入Buffer Ⅱ、SDS和蛋白酶K,EDTA抑制核酸酶对核酸的破坏,Tris和NaCl提供稳定的裂解环境,SDS破坏细胞膜并使蛋白质变性,蛋白酶K使变性的蛋白质降解,在NaCl作用下大分子的核DNA和蛋白质形成沉淀,而小分子线粒体DNA在上清液中,通过离心可以得到线粒体DNA。 3.2 mtDNA的纯化
本文提取的线粒体DNA没有进行纯化,但对于PCR和克隆仍然能顺利进行。若对mtDNA的纯度要求较高,就要进行纯化以去除RNA、蛋白质、脂类和离子等物质,先用Rnase(终浓度为50 μg/ml)37 ℃,水浴1 h,在酚∶氯仿∶异丙醇(25∶24∶1)抽提去除蛋白质得到纯净的线粒体DNA[14]。 3.3 核DNA污染的去除
材料不新鲜或者反复冻融,细胞和细胞核破裂,释放的核DNA断裂成小片段后无法在SDS 作用下与NaCl 形成沉淀,所以得到的线粒体DNA 有核DNA 污染。可以加入适量的DNaseⅠ ,通过利用一定浓度的DNaseⅠ 的消化,可以完全消除线粒体表面上有可能存在的核DNA 干扰。但是DNaseⅠ 会较大地减少线粒体DNA提取量[15]。 3.4 样品的选择
蚊虫吸血后,由于血液中含DNA故会导致污染,所以尽量采用未吸血的蚊虫。若采用吸血后的蚊虫进行实验,应该剪去腹部后进行研磨提取。此外,一般正常动物线粒体寿命仅为1周,离体的线粒体在低温下(0~8 ℃)能保存3~7 d的活性,而常温下只有1~2 h[16],为保证提取效果以及后续实验效果,应选取新鲜的样品或者-80 ℃的冷冻样品。对于蚊虫体积较小的样品来说,一般采用整只或者使用单雌饲养的多只蚊虫;对于其他体积较大的昆虫来说则可以选取含线粒体较多的肌肉组织。 3.5 影响mtDNA质量的操作
研磨过程中不可研磨过度,否则导致细胞核破裂,核DNA可能会断裂成小片段,最终导致得到的mtDNA核污染加重。但是也不能研磨不足,研磨不足会导致线粒体不能完全释放,得到的线粒体少,最终得到的mtDNA量少。对于蚊虫,采用手动研磨,研磨至无明显碎屑的匀浆即可。此外,除了裂解和风干外其余操作均在低温下进行,操作轻柔,以防止核DNA 和mtDNA断裂。
| [1] | 尹文英,宋大祥,杨星科,等. 六足动物(昆虫)系统发生的研究[M]. 北京:科学出版社,2008:28-33. |
| [2] | 胡婧,刘念,黄原. 节肢动物线粒体基因组研究进展与基因顺序分析[J]. 昆虫分类学报,2006,28(2):153-160. |
| [3] | Hedges SB,Kumar S,Tamura K,et al. Human origins and analysis of mitochondrial DNA sequences[J]. Science,1992, 255 (5045):737-739. |
| [4] | Ferris SD, Brown WM, Davidson WS, et al. Extensive polymorphism in the mitochondrial DNA of apes[J]. Proc Natl Acad Sci USA, 1981,78(10):6319-6323. |
| [5] | Liu GH,Chen F,Chen YZ,et al. Complete mitochondrial genome sequence data provides genetic evidence that the brown dog tick Rhipicephalus sanguineus(Acari:Ixodidae)represents a species complex[J]. Int J Biol Sci,2013,9(4):361-369. |
| [6] | Li H,Liu HY,Song F,et al. Comparative mitogenomic analysis of damsel bugs representing three tribes in the family nabidae (Insecta:Hemiptera)[J]. PLoS One,2012,7(9):e45925. |
| [7] | Zhong DB,Lo E,Hu RJ,et al. Genetic analysis of invasive Aedes albopictus populations in los Angeles county, california and its potential public health impact[J]. PLoS One,2013,8 (7):e68586. |
| [8] | World Health Organization. World malaria report 2013[R]. Geneva:WHO,2013. |
| [9] | Mitchell SE,Cockburn AF,Seawright JA. The mitochondrial genome of Anopheles quadrimaculatus species A:complete nucleotide sequence and gene organization[J]. Genome,1993, 36(6):1058-1073. |
| [10] | Richly E, Leister D. NUMTs in sequenced eukaryotic genomes[J]. Mol Biol Evol,2004,21(6):1081-1084. |
| [11] | Tamura K, Aotsuka T. Rapid isolation method of animal mitochondrial DNA by the alkaline lysis procedure[J]. Biochem Genet,1988,26(11/12):815-819. |
| [12] | 杨汉民. 细胞生物学实验[M]. 北京:高等教育出版社,1997: 63-65. |
| [13] | 陈毓荃. 生物化学研究技术[M]. 北京:中国农业出版社, 1995:9-24. |
| [14] | 陈品健. 动物生物学[M]. 北京:科学出版社,2001:30-32. |
| [15] | 萧浪涛,王三根. 植物生理学实验技术[M]. 北京:中国农业出版社,2005:31-33. |
| [16] | 郭荣昌. 动物遗传学[M]. 北京:经济科学出版社,1997: 380-382. |
 2015, Vol. 26
2015, Vol. 26


