扩展功能
文章信息
- 杜景云, 牟路萌, 张璘, 王丽娜, 王安东, 张科, 陈创夫, 王远志
- DU Jing-yun, MU Lu-meng, ZHANG Lin, WANG Li-na, WANG An-dong, ZHANG Ke, CHEN Chuang-fu, WANG Yuan-zhi
- 新疆边境地区伊宁县图兰扇头蜱形态学及分子生物学鉴定
- Morphological classification and molecular identification of Rhipicephalus turanicus in Yining county, Xinjiang Autonomous Region, China
- 中国媒介生物学及控制杂志, 2015, 26(3): 271-274
- Chin J Vector Biol & Control, 2015, 26(3): 271-274
- 10.11853/j.issn.1003.4692.2015.03.013
-
文章历史
- 收稿日期:2014-12-15
2. 山东省济南市中心医院;
3. 新疆石河子大学动物科技学院;
4. 河南省平顶山学院新农村发展研究院
2 Blood Transfusion Dept of Jinan Central Hospital;
3 College of Animal Science, Shihezi University;
4 Research Institute of New Rural Development, Pingdingshan University
图兰扇头蜱(Rhipicephalus turanicus)为硬蜱科(Ixodidae)、扇头蜱亚科(Rhipicephalinae)、扇头蜱属(Rhipicephalus)[1]。目前,国内分布仅见于新疆、陕西、江苏、云南、广西等地[2, 3];国外广泛分布于前苏联、伊朗、尼泊尔、印度以及其他一些中亚、欧洲和北非等国家[1];图兰扇头蜱是新疆的优势蜱种[4],主要寄生于骆驼、牛、马、绵羊、山羊等家畜及野生动物身上[1],对立克次体、无形体、犬埃立克体、贝氏柯克斯体[5]、Babesia occultans[6]、马巴贝虫、泰勒焦虫[7]的传播能力较强。2014年,Aktas等[6]首次在图兰扇头蜱中检测到Babesia occultans;本课题组前期也从图兰扇头蜱中分离获得莱姆病螺旋体B. burgdorferisensu stricto基因型[8],提示图兰扇头蜱不但是一些已知蜱媒病的传播媒介,也可能是其他蜱媒病的潜在传播媒介。新疆是蜱类的高密度区,其种类多样的生境,为蜱的孳生及蜱媒病的形成和发展提供了有利条件,因此对图兰扇头蜱的研究具有非常重要的公共卫生安全及经济学意义。
蜱的分类主要依据于传统的形态学,观察蜱的假头基、基突、须肢、盾板、侧沟、生殖孔、足基节、足转节、肛沟、气门板等特征进行鉴定[9]。然而很多特征在特定环境中变异较大且易受主观因素的影响,同属间蜱种形态相似,仅依靠形态学鉴定比较困难。通过DNA序列分析研究蜱类的系统发育关系,不仅能推断蜱类不同类群间的演化关系、探索蜱类的起源和进化,而且有助于蜱类分类学和分子系统学的研究。线粒体基因因其严格的母系遗传特性使其尤其适用于种内的系统发育研究,已成为群体遗传学和进化生物学研究中的重要分子标记,目前蜱类研究中运用最多的线粒体基因为12S rRNA、16S rRNA、线粒体细胞色素C氧化酶亚基Ⅰ(COⅠ)和COⅡ等基因[10]。本研究结合形态学与分子生物学方法对所采集的图兰扇头蜱进行分析鉴定。
1 材料与方法 1.1 采集地点的选择伊宁县位于东经80°13′~82°42′,北纬43°35′~44°29′之间,东邻尼勒克县,西与伊宁市和霍城县接壤,南邻伊犁河,与察布查尔、巩留两县隔河相望。同时,位于伊犁河谷中部,水草丰富,境内的伊宁口岸是伊犁地区重要的贸易口岸。
1.2 实验材料 1.2.1 蜱的来源2013年4-5月,从伊宁县的2个采集点、2个绵羊群,每群>30只,均未药浴,采集其体表寄生蜱,共获得硬蜱324只,放置于潮湿阴暗处,以保持其存活。
1.2.2 主要试剂PCR所用试剂均购自上海生工生物工程技术服务有限公司;DNA提取试剂盒(DNeasy Blood Tissue Kit)购自德国Qiagen公司;其他试剂均为分析纯。
1.3 实验方法 1.3.1 蜱种鉴定参照《中国经济昆虫志》[9],用普通解剖显微镜将324只蜱进行形态学鉴定,初步分类后,从中选取50只用配备数码照相功能的解剖显微镜(LEICA M165 C)拍摄图片,对蜱的盾板、假头、假头基、肛侧板、气门板、第一缘垛、孔区(雌蜱)等形态进行对比观察并测量[11]。
1.3.2 蜱的处理和DNA提取将蜱标本分别依次用浓度为70%、50%、30%、10%的乙醇溶液于37 ℃摇床中振荡冲洗1 h,再用超纯水反复冲洗,干燥。最后置于消毒灭菌的1.5 ml EP管中。按照DNA提取试剂盒使用说明书提取虫体基因组DNA,置-20 ℃保存备用。
1.3.3 基因扩增用上游引物5′-CTG CTC AAT GAT TTT TTA AAT TGC TGT GG-3′,下游引物5′-CCG GTC TGA ACT CAG ATC AAG T-3′扩增线粒体16S rRNA序列[12];上游引物5′-CAA AAW CCT GGT AAA ATT AAA-3′和下游引物5′-GCA CTA TCA AGC AAC ACG ACT-3′扩增COⅠ序列[10]。25 μl PCR 反应体系:模板 1.5 μl(约50 ng),上游和下游引物各 0.75 μl(75 pmol/μl),50 mmol/L KCl,10 mmol/L Tris-HCl(pH 8.3),1.5 mmol/L MgCl2,1单位 Taq DNA聚合酶。PCR反应循环参数为:①16S rRNA为94 ℃预变性5 min,92 ℃变性30 s,54 ℃退火30 s,72 ℃延伸30 s,共38个循环,72 ℃终延伸8 min。②COⅠ为94 ℃ 预变性5 min,92 ℃变性30 s,50 ℃退火30 s,72 ℃延伸60 s,共38个循环,72 ℃ 终延伸 8 min。扩增片段后送上海生工生物工程技术服务有限公司测序。
1.3.4 序列分析及系统进化树构建结合GenBank登录的图兰扇头蜱的16S rRNA和COⅠ参考序列,将本实验PCR扩增的6条16S rRNA及6条COⅠ序列测序结果与参考序列比对,运用Mega 5.0软件的ClustalX程序分析,计算遗传距离并构建遗传进化树。
2 结 果 2.1 蜱种鉴定所鉴定蜱共324只(168♂、156♀),虫体体型较小,雌虫体长3.2~5.5 mm,雄虫体长2.9~3.6 mm,呈褐色,背腹扁平似卵圆形,芝麻至米粒大,雌蜱饱血后可膨胀达蓖麻籽大。体分为假头和躯体两个主要部分(图 1A)。假头基呈六角形,侧角明显,后缘微凹(图 1B)。雄蜱盾板覆盖整个背部,雌蜱盾板覆盖背前部,前部较窄,后部圆钝,盾板遍布刻点,以细刻点居多,粗刻点少而零散(图 1C)。眼卵圆,靠近盾板前部边缘。须肢粗短,中部最宽,前端稍窄。雄蜱气门板长卵形(图 1D)。体端有缘垛,中垛大于边垛,常有尾突 (图 1E)。有肛沟,雄性肛侧板后缘内斜明显,内缘具角突,长约为宽的2.5~3.0倍,内缘中部稍凹,后缘向内显著倾斜,其后方凸角明显(图 1F)。结合有关文献[9, 13]认为伊宁县的蜱具有硬蜱科扇头蜱属图兰扇头蜱的特征。但由于吸血、饱血雌蜱及部分未成熟或形态变异的雄蜱,仅用传统形态学分类方法不能准确区分。因此,从324只中选出6只雌雄分别具有形态差异的蜱(4♂、2♀),根据采集地点分别将其命名为YN-1、YN-2、YN-3、YN-4、YN-5和YN-6。YN-1为当地典型雄性图兰扇头蜱;YN-2和YN-3为半饱血雌蜱,因其腹部吸血膨胀已无法观察缘垛,肛侧板和副肛侧板难以区分形态且边界不清;YN-4、YN-5和YN-6为部分形态特征改变雄蜱,YN4和YN5体端较宽似倒置三角形与典型的图兰扇头蜱卵圆形体端不同,且YN5气门板呈长逗点形与血红扇头蜱气门板相似;YN6肛侧板后缘圆钝,凸角不明显。因此对这6只蜱采用分子生物学方法进一步分析,对上述形态学鉴定结果进一步验证。

|
| 图 1 图兰扇头蜱局部结构图 Figure 1 Partial structure of Rh. turanicus |
通过PCR扩增上述形态学差异较大的6只图兰扇头蜱线粒体DNA,产物经1%琼脂糖凝胶电泳分析,均获得特异性很好的PCR产物,与预期目的片段一致(16S rRNA约为460 bp,COⅠ约为760 bp)。
2.2.2 图兰扇头蜱16S rRNA 和COⅠ基因片段组成利用Mega 5.0软件计算6只图兰扇头蜱的16S rRNA 和COⅠ基因片段碱基组成。16S rRNA基因片段A、T、C、G 的平均碱基含量分别为36.68%、37.12%、10.7%和15.5%,碱基 A+T 平均含量是73.78%。COⅠ基因片段A、T、C、G 的平均碱基含量分别为38.56%、31.78%、14.12%和15.54%,碱基 A+T 平均含量是70.34%。
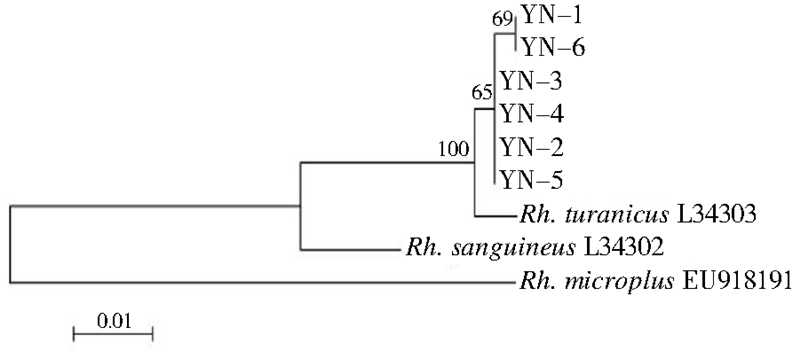
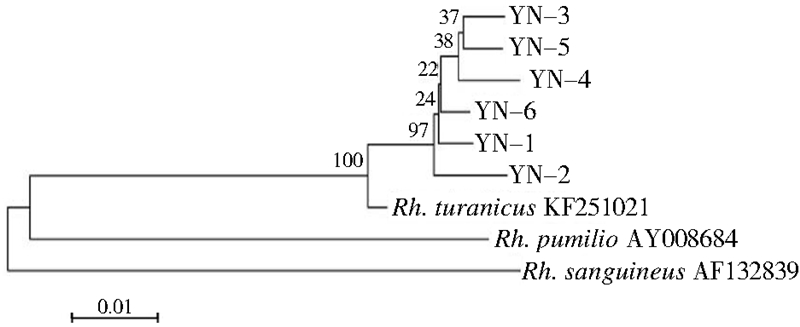
2.2.3 图兰扇头蜱基因序列比对及系统进化树运用Mega 5.0软件的ClustalX程序进行多重序列比对后,16S rRNA获得2种不同序列,并登录GenBank,登录号分别为KF547987和KF547989;COⅠ获得3种不同序列,登录号分别为KF688136、 KF688137和KF688138。各结合GenBank登录的3种扇头蜱的参考序列构建系统进化树(图 2、3)。
|
| 图 2 基于16S rRNA 基因的系统进化关系树 Figure 2 A homology-tree inferred from 16S rRAN gene |
|
| 图 3 基于COⅠ基因的系统进化关系树 Figure 3 A homology-tree inferred from COⅠgene |
6只图兰扇头蜱16S rRNA基因片段的遗传变异很小,共检测出2个单倍型,1个变异位点。其中YN-2、YN-3、YN-4和YN-5序列相同,为一种单倍型;YN-1、YN-6在216位点处为转换位点(T-C),为一种单倍型。基因序列比较结果显示同源性均在99.5%以上,遗传距离为0.3%~0.5%。而上述6只图兰扇头蜱的COⅠ基因片段序列变异较大,共检测出3个单倍型,4个变异位点。YN-1、YN-2和YN-6序列相同,为一种单倍型;YN-3和YN-5检测到3个变异位点,均为转换位点(A-G),无插入/缺失和颠换现象;YN-4在上述变异基础上,于574位点处发生转换(A-G)。基因序列比较结果显示同源性均在98.6%以上,遗传距离为0.3%~1.9%。
3 讨 论调查结果表明新疆伊宁县绵羊体表普遍寄生了图兰扇头蜱,据以往报道图兰扇头蜱主要分布于新疆的巴楚、喀什、霍城、和田、哈密、呼图壁、库尔勒、轮台、阿瓦提、沙雅、于田等荒漠草原和荒漠地区[14]。而伊宁县地处亚欧大陆腹地,伊犁河谷中部,属中温带干旱型内陆山地气候,该地区气候温和,水源充沛,水草丰茂,以往并不适合图兰扇头蜱的生存繁殖,而此次在伊宁县发现图兰扇头蜱分布普遍,可能与新疆北疆近30年雨水过少、特殊的植被分布及气候改变有关。
线粒体基因已成为群体遗传学和进化生物学研究中的重要分子标记。Murrell等[15]认为线粒体基因对于分子进化的研究具有很大价值,且更适于种内遗传差异的分析。目前蜱类研究中用的最多的线粒体基因为12S rRNA、16S rRNA、COⅠ和COⅡ等基因[10]。线粒体上的不同基因具有不同的解析功能,同一基因在不同的物种间也具有不同的解析能力。并且,在系统发育研究中多个数据比单个数据的效果要好,16S rRNA基因序列由于其保守性和存在的普遍性,被大量用于蜱类的物种鉴定和系统研究[12, 16, 17]。COⅠ基因是线粒体呼吸链末端的一个催化酶,比其他基因在生化功能的研究上更完备,普遍存在于真核生物和原核生物细胞的线粒体中;此外,COⅠ基因是核基因组以外独立的线粒体环状DNA,所以能够用来比较其在生物进化上的相互关系[18]。吕继洲等[19]通过16S rRNA和COⅠ基因鉴定小亚璃眼蜱(H. anatolicum)、亚洲璃眼蜱(H. asiaticum)和残缘璃眼蜱(H. detritum)3种形态上极其相近的蜱种。一般来说,在变异程度上16S rRNA基因较COⅠ基因明显保守[20],本实验研究结果也证实了这一观点。并且,通过对2个基因的研究发现,该地区图兰扇头蜱种内遗传差异显著,证实图兰扇头蜱具有生物多样性。由于蜱传播病原体一般与蜱种之间存在着一定的对应关系,亲缘关系越近的蜱种,其传播相同病原体的机会越大[21]。因此,不同蜱种的种内遗传差异与蜱传疾病的变化仍需进一步研究,为蜱媒病的预防控制提供依据。
| [1] | 杨晓军,陈泽,刘敬泽. 中国蜱类的有效属和有效种[J]. 河北师范大学学报:自然科学版,2008,32(4):529-533. |
| [2] | 陈泽.中国蜱类名录订正、区系分析及扇头蜱亚科Rhipicephalinae 部分种类的生物学特性研究[D]. 石家庄:河北师范大学, 2007. |
| [3] | 刘明社,黄克峻,赵中夫,等. 9省区蜱类区系初步调查[J]. 长治医学院学报,2005,19(4):249-250. |
| [4] | 吕新军,唐青,冯育明,等. 新疆南部地区蜱传虫媒病毒分子生物学调查[J]. 中华实验和临床病毒学杂志,2005,19(4): 325-330. |
| [5] | Satta G,Chisu V,Cabras P,et al. Pathogens and symbionts in ticks:a survey on tick species distribution and presence of tick- transmitted micro - organisms in Sardinia,Italy[J]. J Med Microbiol,2011,60(1):63-68. |
| [6] | Aktas M,Vatansever Z,Ozubek S,et al. Molecular evidence for trans - stadial and transovarial transmission of Babesia occultans in Hyalomma marginatum and Rhipicephalus turanicus in Turkey[J]. Vet Parasito,2014,204(3/4):369-371. |
| [7] | Razmi G,Yaghfoori S. Molecular surveillance of Theileria ovis, Theileria lestoquardi and Theileria annulata infection in sheep and ixodid ticks in Iran[J]. Onderstepoort J Vet Res,2013,80 (1):635. |
| [8] | 张璘,王远志,陈创夫,等. 新疆北疆部分地区硬蜱伯氏疏螺旋体基因型研究[J]. 中华流行病学杂志,2014,35(3):39-42. |
| [9] | 邓国藩,姜在阶. 中国经济昆虫志. 第39册. 蜱螨亚纲. 硬蜱科[M]. 北京:科学出版社,1991:62-326. |
| [10] | 王启果,张渝疆,孙素荣. DNA序列应用于蜱类分子系统发育学的研究进展[J]. 疾病预防控制通报,2012,27(2):83-86. |
| [11] | Dantas-Torres F,Latrofa MS,Annoscia G,et al. Morphological and genetic diversity of Rhipicephalus sanguineus sensu lato from the New and Old Worlds[J]. Parasit Vectors,2013,6:213-229. |
| [12] | Black WC,Piesman J. Phylogeny of hard and soft-tick taxa (Acari: Ixodidae) based on mitochondrial 16S DNA sequences[J]. Proc Natl Acad Sci USA,1994,91(21):10034-10038. |
| [13] | 热孜万·阿不力孜,于心, 阿布力克木·阿不都热西提. 塔里木盆地三种扇头蜱的鉴别要点[J]. 地方病通报,2007,22(2):4-5. |
| [14] | 叶瑞玉,于心,陈饮如,等. 新疆南部地区蜱螨区系及医学意义[J]. 地方病通报,1995,10(4):30-34. |
| [15] | Murrell A,CamPbell NJ,Barker SC. Phylogenetic analyses of the rhipicephaline ticks indicate that the genus Rhipicephalus is paraphyletic[J]. Mol Phylogenet Evol,2000,16(1):1-7. |
| [16] | Gylfe A,Yabuki M,Drotz M,et al. Phylogeographic relationships of Ixodes uriae (Acari:Ixodidae) and their significance to transequatorial dispersal of Borrelia garinii[J]. Hereditas,2001, 134(3):195-199. |
| [17] | Caporale DA,Rich SM,Spielman A,et al. Discriminating between Ixodes ticks by means of mitochondrial DNA sequences[J]. Mol Phylogenet Evol,1995,4(4):361-365. |
| [18] | McManus DP, Bowles J. Molecular genetic approaches to parasite identification:their value in diagnostic parasitology and systematics[J]. Int J Parasitol,1996,26(7):687-704. |
| [19] | 吕继洲,吴绍强,张永宁,等. 小亚璃眼蜱、亚洲璃眼蜱和残缘璃眼蜱的分子生物学鉴定[J]. 中国畜牧兽医,2013,40(6): 7-13. |
| [20] | 戴艳菊,刘萍,高保全,等. 三疣梭子蟹4个野生群体线粒体 16S rRNA和COⅠ基因片段的比较分析[J]. 中国海洋大学学报,2010,40(3):54-60. |
| [21] | Switzer WM,Salemi M,Shanmugam V,et al. Ancient co- speciation of simian foamy viruses and primates[J]. Nature, 2005,434(7031):376-380. |
 2015, Vol. 26
2015, Vol. 26


