扩展功能
文章信息
- 王鸣柳, 林玫, 周凌云, 廖和壮, 权怡, 黄君, 曾竣, 李永红, 赵鹏, 张洁宏
- WANG Ming-liu, LIN Mei, ZHOU Ling-yun, LIAO He-zhuang, QUAN Yi, HUANG Jun, ZENG Jun, LI Yong-hong, ZHAO Peng, ZHANG Jie-hong
- 主要爬行动物来源沙门菌血清型分布及耐药特征分析
- Serotype distribution and resistance characterization of Salmonella isolated from reptiles
- 中国媒介生物学及控制杂志, 2015, 26(3): 266-270
- Chin J Vector Biol & Control, 2015, 26(3): 266-270
- 10.11853/j.issn.1003.4692.2015.03.012
-
文章历史
- 收稿日期:2014-12-25
沙门菌包括2500多种血清型,广泛存在于外环境及动物中。除伤寒、副伤寒沙门菌仅感染人类外,其他沙门菌(统称非伤寒沙门菌)宿主范围较广,既可感染动物也可感染人类。肠道沙门菌中的亚种Ⅰ和亚种Ⅱ中某些血清型与野生动物,尤其是冷血爬行类动物密切相关,人类通过与带菌动物接触增加了感染这些沙门菌的风险。美国每年因接触爬行动物和两栖动物而感染沙门菌的病例约7.4万例,占总沙门菌病例数的6%[1] 。在瑞典,与爬行动物有关的沙门菌,包括斯坦利、波摩那、浦那和爪哇变种也从与爬行动物有关的沙门菌感染病例中分离到。另外,在自然栖息的动物粪便中分离到多个与人类沙门菌病有关的沙门菌亚种和血清型,且分离率高达98.4%(62/63)[2]。因此,爬行动物被认为是传统的人感染沙门菌的来源。随着人类生活水平的提高及动物保护意识的加强,与爬行类宠物密切接触,甚至在家中喂养,均会增加沙门菌从动物传播给人的风险。我国缺乏因接触爬行动物和两栖动物而感染沙门菌病例的报道,但不代表我国没有该类感染病例的存在。我国人类可接触的爬行动物携带哪些沙门菌血清型尚不清楚,因此,本研究对我国南方主要爬行动物中存在的沙门菌血清型进行了探索,旨在了解其引起人类感染的潜在危险性。
1 材料与方法1.1 样本采集 主要采集与人类有机会接触或密切接触的爬行动物,包括龟、蛇、蛤蚧、蜥蜴等。其来源主要为广西壮族自治区(广西)花鸟市场、动物园和动物繁殖基地。花鸟市场主要采集用作宠物饲养龟的新鲜粪便或肛拭子,共采集8个距离较远的摊位以避免摊位之间的交叉污染,每个摊位每个品种的龟均进行采集,共采集巴西龟23只和中华龟7只。动物园主要采集供观赏动物的粪便,包括蛇55条,龟32只(巴西龟为主,19只); 动物繁殖基地动物标本主要来源于蛇(27条)、蛤蚧(25只)和巨蜥(4只)。为保证采样质量,同种同笼动物均随机采集3只,单笼同种或非同种动物全部采集。本研究共采集爬行动物粪便标本132份,肛拭子70份,采集的粪便标本均置于Cary-Blair培养基中,4 ℃条件下送至实验室进行增菌检测。
1.2 菌株分离及鉴定取适量粪便置于SBG增菌液中过夜培养后,取一接种环菌液接种于麦康凯(Maconkey)及木糖-赖氨酸-脱氧胆酸(XLD)选择性琼脂平板上,然后自平板上挑取5~10个可疑菌落,用API20E鉴定条进行菌株生化鉴定,对生化符合沙门菌属的菌株,利用沙门菌抗血清(购自丹麦食品安全研究所)进行血清玻片凝集反应确定血清型,同时设盐水对照。
1.3 菌株药物敏感性测试及判定采用纸片扩散法(K-B法)测试菌株对14种抗生素的敏感性,抗生素纸片购自英国Oxoid公司。实验操作严格按CLSI标准执行[3],同时以 ATCC 25922(购自美国典型培养物保藏中心)作为质控对照,只有ATCC 25922的抑菌圈直径在质控范围内才确认本次实验有效。抗生素阈值的判定标准采用CLSI2013版新标准。
1.4 产超广谱β内酰胺酶(ESBLs)的检测采用WHO推荐的纸片法检测耐三代头孢类抗生素的菌株是否产ESBLs。根据ESBLs具有被克拉维酸抑制的特点,在三代头孢类抗生素和克拉维酸的混合纸片周围,产ESBLs的菌株可以出现抑菌圈扩大,因此通过比较单独的头孢类抗生素纸片和加入克拉维酸的头孢类抗生素纸片的抑菌环大小,即可判断菌株是否产ESBLs。本实验所有操作过程均严格按照CLSI2012版标准执行。6种抗生素纸片浓度为头孢他啶(CAZ,30 μg)、头孢噻肟(CTX,30 μg)、头孢他啶/克拉维酸(30 μg/10 μg)、头孢噻肟/克拉维酸(30 μg/10 μg)。
1.5 沙门菌脉冲场凝胶电泳(PFGE)参照国际实验室分子分型监测网络PulseNet中沙门菌PFGE分型标准化方案进行操作。使用限制性内切酶XbaⅠ进行酶切,获得的菌株PFGE图像录入BioNumerics(Version 5.1,Applied maths,Inc.)软件包进行处理,经校准后,使用非加权配对算术平均法(unweighted pair group average method,UPGMA)进行聚类,构建聚类树,分析菌株间的相似性。
1.6 统计学处理按计数资料的χ2检验进行统计学分析。P<0.05为差异有统计学意义。
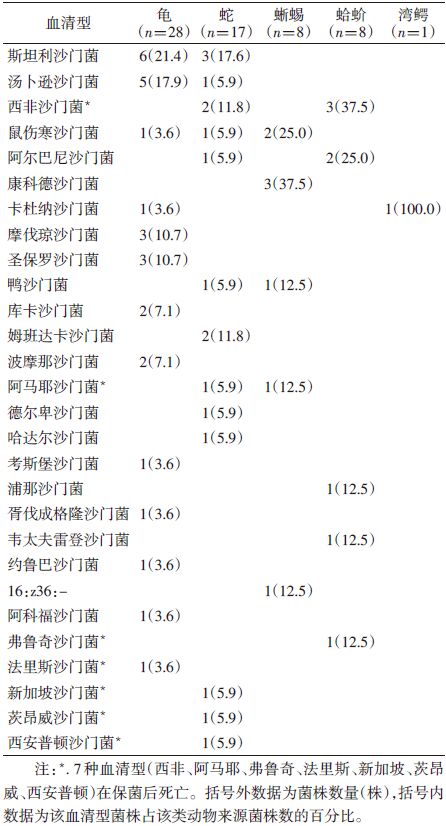
2 结 果 2.1 血清型分布2008-2012年自广西主要花鸟市场、繁殖基地及动物园的宠物、观赏动物共采集标本202份,分离获得62株沙门菌株,检出率为30.7%。其中,花鸟市场检出率为42.9%(18/42),动物园为22.3%(23/103),动物繁殖基地为35.1%(20/57),3组动物来源菌株阳性检出率差异无统计学意义(排除花鸟市场同一摊位来源菌株)。但花鸟市场不同摊位间沙门菌检出率在0~83.3%之间,差异有统计学意义(均P<0.05),且不同摊位间检出沙门菌血清型也存在差异,血清型为2~4种/摊位,交叉血清型较少,只有1~2种。同时发现不同动物在同一摊位可以携带相同的血清型。
62株沙门菌分离自5种动物,经血清分型共鉴定出28种血清型(表 1),其中13种与人源血清型一致。前4位沙门菌血清型依次为斯坦利沙门菌、汤卜逊沙门菌、西非沙门菌和鼠伤寒沙门菌,其中斯坦利沙门菌、汤卜逊沙门菌、鼠伤寒沙门菌在人源沙门菌感染中属于较常见沙门菌血清型。
不同动物来源菌株血清型分布不同(表 1),如自龟类分离获得15种血清型,斯坦利沙门菌占优势;蛇类共分离获得13种血清型,斯坦利沙门菌相对较多。另外,在花鸟市场的2只宠物龟(珍珠龟和灵龟)中分离获得2株波摩那沙门菌,1株浦那沙门菌分离自动物救护站(繁殖基地)的蛤蚧。花鸟市场分离菌株分为6种血清型,汤卜逊沙门菌占优势(7/18);动物园观赏动物分离菌株共分为12种血清型,斯坦利沙门菌占优势(6/23);繁殖基地动物分离菌株共分为11种血清型,西非沙门菌占优势(5/20),三者之间血清型交叉不超过2种。花鸟市场巴西龟分离株7株(7/23),分为5种血清型,动物园巴西龟分离株5株(5/19),分为3种血清型,血清型不同于花鸟市场的巴西龟。动物园的蛇分离株9株(9/55),分为7种血清型,繁殖基地蛇分离株8株(9/27),分为6种血清型,血清型与动物园的蛇无交叉。上述结果说明不同环境来源沙门菌血清型存在差别,即使同种动物,若在不同环境中生活,其携带的沙门菌血清型也会存在差异。
2.2 药敏概况对50株沙门菌(12株沙门菌由于保菌后死亡未进行药敏实验)进行14种抗生素敏感性测试,结果所有菌株对氟喹诺酮类药物均敏感(表 2);对三代头孢菌素(头孢他啶、头孢噻肟)、四代头孢菌素(头孢吡肟)及头霉素类抗生素(头孢西丁)的敏感性次之,达90%以上;对四环素、链霉素的敏感性最低,仅为35%左右;对氨苄西林、复方新诺明的敏感性为73%左右。
不同沙门菌血清型对14种抗生素的敏感性存在差异。11株斯坦利沙门菌对氯霉素、复方新诺明、四环素、甲氧苄啶全部耐药,其中8株同时耐链霉素,而对其他抗生素均敏感。10株汤卜逊沙门菌对四环素及萘啶酸全部耐药,其中4株同时耐链霉素,对其他抗生素全部敏感。4株鼠伤寒沙门菌除3株耐链霉素外,对其他药物均敏感。
不同动物来源沙门菌耐药谱不同且存在多重耐药现象,龟类来源的菌株中仅2株对14种抗生素均敏感,其余至少对1种抗生素耐药。12株来自巴西龟的菌株(7株来自花鸟市场,5株来自动物园)中2株来自动物园的菌株对14种抗生素均敏感,发现1株多重耐药菌株(表 3),该菌株来自花鸟市场的宠物巴西龟,其余菌株则表现耐1种(链霉素或甲氧苄啶)或2种抗生素(如四环素-萘啶酸、四环素-甲氧苄啶、萘啶酸-甲氧苄啶)。蛇类来源的11株沙门菌中无敏感菌株,多重耐药菌株6株(表 3),其中产ESBLs菌株(CHL-TET-STR-AMP-CTX-CAZ-FOX-NAL-TMP-SXT)1株,为分离自繁殖研究用蟒蛇的姆班达卡沙门菌。鱼类来源的11株沙门菌中也无敏感菌株,多重耐药菌株6株,但与蛇类多重耐药谱存在差异(表 3)。巨蜥来源的3株康科德沙门菌对三代及四代头孢菌素耐药(表 3),为产ESBLs菌株。蛤蚧来源菌株主要为ACSSxT耐药菌株。
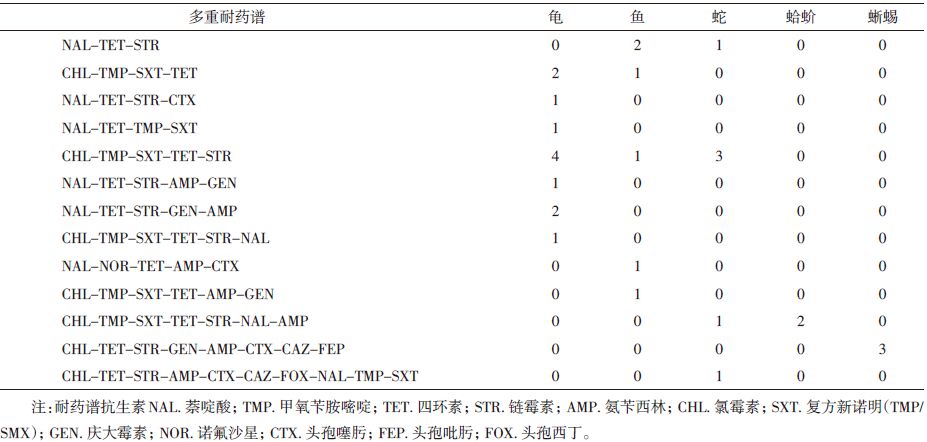 |
不同环境来源菌株耐药谱不同,花鸟市场来源菌株中无敏感菌株,3株耐1种药物,15株为多重耐药株。繁殖基地来源菌株除2株敏感,4株耐1种药物外,其余8株均为多重耐药菌株;动物园来源菌株中6株耐1种STR,4株2种耐药,6株为多重耐药株,仅2株敏感菌株。
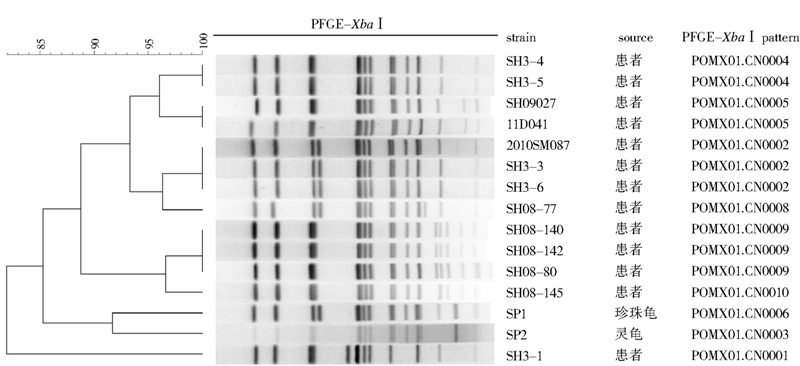
2.3 波摩那沙门菌PFGE分析由于宠物龟携带的波摩那沙门菌在国外曾引起人类大范围的暴发,其他沙门菌血清型虽也有小型食物中毒的报道,但未发现与动物带菌的关联性,故本研究对分离自宠物龟的2株波摩那沙门菌(SP1、SP2)进行PFGE分型分析,判断动物源波摩那沙门菌与人源波摩那沙门菌的关系,结果发现这2株沙门菌PFGE带型相近,但与我国沙门菌PFGE数据库中人源分离株PFGE图谱不同(图 1),说明人源波摩那沙门菌与宠物龟中的波摩那沙门菌来自不同的克隆群。
|
| 图 1 波摩那沙门菌XbaⅠ酶切PFGE分型结果 Figure 1 The PFGE pattern with XbaⅠdigestion of Salmonella Pomona strains |
人类沙门菌感染大多数是摄入受该菌污染的食品,特别是动物性食品所致,其他感染方式如经水传播、接触动物及人-人传播相对少见,但近年来,随着环境及动物保护的加强,人们饲养、领养宠物、接触动物特别是宠物类爬行动物的机会逐渐增多。美国每年因暴露于爬行及两栖类动物感染沙门菌的病例约7.4万例[1]。我国目前尚缺乏此类数据报道。本研究对人类可接触的爬行动物进行了沙门菌分离及血清型确定,为人类感染动物源性沙门菌状况提供参考数据。同时,调查可获得爬行动物中沙门菌的携带情况,对指导人类有效预防动物源性沙门菌感染意义重大。
3.1 爬行动物携带沙门菌与人感染沙门菌血清型的一致性1995-2006年丹麦自动物园的爬行动物中分离到60株沙门菌,属于43种血清型,大部分为外来性血清型,只有少数几种,如肠炎沙门菌、鼠伤寒沙门菌及病牛沙门菌是人群感染中常见的血清型[4]。在法属圭亚那地区,爬行动物沙门菌携带率为23.2%,覆盖23种血清型,2/3血清型为人源感染血清型[5]。我们自广西地区爬行动物中分离的沙门菌血清型接近一半为人源感染血清型,这些均说明爬行动物沙门菌携带率较高,具有传播至人类的潜在风险,尤其当人们近距离接触如作为宠物饲养或教学科研目的需要时,感染的概率会大幅增高。另一方面也表明爬行动物体内环境适合沙门菌生存,可以携带和传播许多不同血清型的沙门菌。由于接触宠物龟,波摩那沙门菌曾在美国引起多个州的暴发[6, 7],我们在广西当地花鸟市场的宠物龟中也分离到波摩那沙门菌,但PFGE带型不同于我国人群感染型别,提示宠物龟本身携带的波摩那沙门菌可能尚未引起人群感染,但也不排除由于我国腹泻症状监测不完善而造成的漏报,应该告知宠物龟售卖者及家庭饲养者注意防范波摩那沙门菌潜在的感染风险,并密切关注波摩那沙门菌在我国人群中的感染情况。另外,应当加强宠物市场动物特别是宠物龟携带沙门菌的监测,加强宠物管理,避免在人群中引起暴发流行。
3.2 抗生素敏感性差异此次调查发现不同环境、不同爬行动物来源沙门菌对14种抗生素的耐药谱差异较大,且存在一定程度的多重耐药现象,但总体上对大多数药物敏感,特别对人类临床一线常用药物(头孢菌素类、氟喹诺酮类药物)敏感性较高,耐药现象尚不严重。若临床发生动物接触性创伤感染,可以使用常用药物进行经验性治疗。本研究中动物源与人源沙门菌相同血清型上耐药性差别不大(资料来自国家参比实验室,尚未发表),如汤卜逊沙门菌[8]、人源汤卜逊沙门菌对四环素的耐药率达78%,与本研究分离的汤卜逊沙门菌耐药率(68%)差异无统计学意义。但其他人类不常见血清型则表现一定程度的高耐药性,如巨蜥来源的康科德沙门菌对三代及四代头孢菌素均耐药,是否与繁殖用抗生素使用或菌株本身携带耐药质粒有关,尚需进一步验证,同时提醒繁殖研究基地人员在操作或处理巨蜥时,应采取适当措施避免感染或环境污染。
总之,目前主要爬行动物沙门菌携带率较高,且近半数血清型为人类感染血清型,但菌株对临床一线常用药物敏感性较高。同时发现宠物携带暴发相关菌株,提示应加强宠物监管,避免在人群中引起暴发流行。
| [1] | Mermin J,Hutwagner L,Vugia D. Reptiles,amphibians,and human Salmonella infection:a population-based,case-control study[J]. Clin Infect Dis,2004,38 Suppl 3:S253-261. |
| [2] | Franco A,Hendriksen RS,Lorenzetti S,et al. Characterization of Salmonella occurring at high prevalence in a population of the land iguana Conolophus subcristatus in Galápagos Islands, Ecuador[J]. PLoS One,2011,6(8):e23147. |
| [3] | Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing[M]. Wayne PA:Clinical and Laboratory Standards Institute,2012. |
| [4] | Pedersen K,Lassen-Nielsen AM,Nordentoft S,et al. Serovars of Salmonella from captive reptiles[J]. Zoonoses Public Health, 2009,56(5):238-242. |
| [5] | Gay N,Le Hello S,Weill FX. Salmonella serotypes in reptiles and humans,French Guiana[J]. Vet Microbiol,2014,170(1/2): 167-171. |
| [6] | Harris JR,Bergmire-Sweat D,Schlegel JH. Multistate outbreak of Salmonella infections associated with small turtle exposure, 2007-2008[J]. Pediatrics,2009,124(5):1388-1394. |
| [7] | CDC. Turtle-associated salmonellosis in humans-United States, 2006-2007[J]. Morb Mortal Wkly Rep,2007,56(26):649-652. |
| [8] | 梁未丽,王洪霞,周海健,等. 沙门菌监测点汤卜逊沙门菌分离株的分子分型和耐药性分析[J]. 疾病监测,2009,24(6): 422-425. |
 2015, Vol. 26
2015, Vol. 26