扩展功能
文章信息
- 陈劲华, 翁正军, 朱志宏, 陈波, 楼挺, 石国祥
- CHEN Jin-hua, WENG Zheng-jun, ZHU Zhi-hong, CHEN Bo, LOU Ting, SHI Guo-xiang
- 浙江省义乌市鼠类中耶尔森菌调查与分析
- Investigation and analysis on Yersinia in rodent populations in Yiwu, Zhejiang province
- 中国媒介生物学及控制杂志, 2015, 26(3): 262-265
- Chin J Vector Biol & Control, 2015, 26(3): 262-265
- 10.11853/j.issn.1003.4692.2015.03.011
-
文章历史
- 收稿日期:2014-12-25
2. 浙江省疾病预防控制中心, 杭州310051
2 Zhejiang Center for Disease Control and Prevention, Hangzhou 310051, Zhejiang Province, China
义乌市位于浙江省中部,东、南、北三面群山环抱,境内有中低山、丘陵、岗地、平原,土壤类型多样,光热资源丰富,属亚热带季风气候,温和湿润,四季分明,适宜啮齿类动物和蚤类媒介的生长繁殖。义乌市的鼠疫流行是由于1940年10月侵华日军在衢县空投大量染有鼠疫菌的跳蚤,造成衢县鼠疫流行后通过浙赣铁路传入的,使历史上从来没有鼠疫流行的义乌市变成了人为的“植入型”鼠疫疫源地。1945年以后,再未发生人间和动物间的鼠疫流行。但自20世纪80年代末开始不断检出放射免疫沉淀试验(RIP)阳性鼠血清标本。2005年7月,又首次用间接红细胞凝集试验(indirect haemagglutination test,IHA)法证实2份鼠血清〔均为黑线姬鼠(Apodemus agrarius)〕鼠疫F1抗体阳性,抗体滴度分别为1∶80和1∶160[1],提示当地可能存在动物间鼠疫流行。但用常规的鼠疫菌分离培养方法一直未在该地区检出过鼠疫菌,对该地区的鼠脏器进行鼠疫菌基因PCR检测,也未获得过任何阳性材料[1, 2]。
为进一步探究义乌市鼠疫疫源地的性质、了解啮齿动物中小肠结肠炎耶尔森菌(Yersinia enterocolitia,小肠结肠炎菌)和假结核耶尔森菌(Y. pseudotuberculosis,假结核菌)的感染情况,2005-2013年在开展鼠疫常规监测工作的同时,也对鼠疫监测中捕获的鼠类进行了两种耶尔森菌调查。
1 材料与方法 1.1 试剂改良PBS缓冲液、三糖铁(TSI)琼脂、营养琼脂等由北京陆桥技术有限责任公司生产;耶尔森菌选择性琼脂和添加剂由英国Oxoid公司生产;API20E生化鉴定条由法国生物梅里埃公司生产;PCR检测所用引物由上海生工生物工程有限公司合成,PCR反应体系由宝生物工程(大连)有限公司提供;检测鼠疫F1抗原的反向血凝试剂由吉林博得医学免疫制品有限公司生产。
1.2 标本采集监测点设置:按照浙江省鼠疫监测方案要求,设立固定监测点(大陈镇楂林村)和流动监测点(稠江街道崇山村、城西街道东河村),于每年的3-11月开展监测,对监测捕获的鼠类进行常规血液和脏器标本采集后,再采集鼠盲肠末端肠道内容物标本,置于4 ml改良PBS缓冲液中于4 ℃冰箱中保存。
1.3 鼠疫菌分离、鼠疫F1抗原和fra基因检测参照《鼠疫诊断标准》(WS 279-2008)进行操作,可疑菌用鼠疫噬菌体裂解试验证实。
1.4 耶尔森菌分离方法参照《感染性腹泻诊断标准》(WS 271-2007)小肠结肠炎菌检验,标本在改良PBS缓冲液中4 ℃冷增菌14~21 d,划线接种到耶尔森菌选择性培养基上,28 ℃培养24~48 h,挑出可疑菌落,接种三糖铁琼脂,培养18~24 h,挑取A/A或K/A、硫化氢阴性、不产气的进一步用API20E生化鉴定条进行鉴定,生化鉴定为小肠结肠炎菌和假结核菌,制备DNA模板,抗原检测用细菌悬液(37 ℃培养物)供试。
1.5 小肠结肠炎菌血清分型采用玻片凝集法对鉴定为小肠结肠炎菌的菌株进行血清分型,分型所使用的诊断血清包含O∶1,2、O∶3、O∶5、O∶8和O∶9 五种诊断血清型,和上述5种血清不凝集者暂定为血清未定菌,同时用生理盐水作为对照。
1.6 小肠结肠炎菌生物分型和毒力基因检测生物分型按照文献报道的指标进行[3];毒力基因检测依据文献[4]的ail、ystA、ystB、yadA、virF 5个毒力基因和O∶3血清型特有的rfbC基因片段合成引物,并进行PCR检测。
1.7 统计学处理数据资料分析采用率之间的χ2检验,运用SPSS Statistics 20软件进行统计处理。P<0.05为差异有统计学意义。
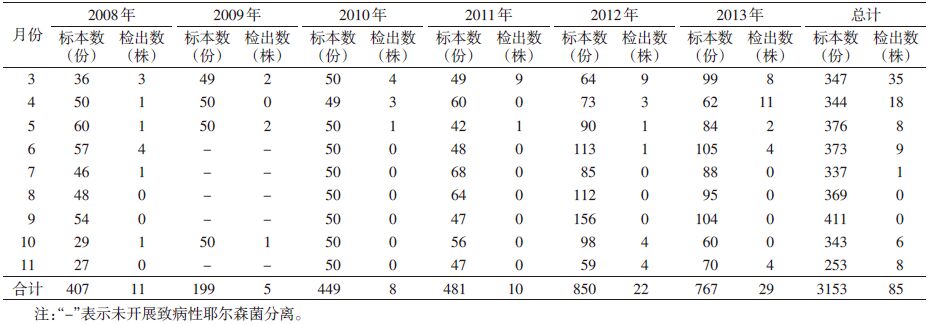
2 结 果 2.1 致病性耶尔森菌的分离情况2005-2007年采集春秋季标本共470份(2005-2007年分别为150、69和251份)进行细菌学分离培养,均未检出耶尔森菌。2008-2013年共采集监测期内标本3153份,检出致病性耶尔森菌85株,总检出率为2.70%。其中小肠结肠炎菌74株,检出率为2.35%;假结核菌11株,检出率为0.35%,两种菌的检出率差异有统计学意义(χ2=47.332,P<0.05)。
按季节统计分析,春季(3-5月)致病性耶尔森菌检出率(5.72%)比夏季(6-8月,0.93%)和秋季(9-11月,1.39%)均高,且差异有统计学意义(χ2=56.542,P<0.05)。按月统计,3月的检出率最高,为10.09%,其次是4月和11月,检出率分别为5.23%和3.16%。假结核菌只在春季3、4月检出,检出率分别为2.88%和0.29%。各年间致病性耶尔森菌检出率差异无统计学意义(χ2=5.634,P=0.343)(表 1)。
 |
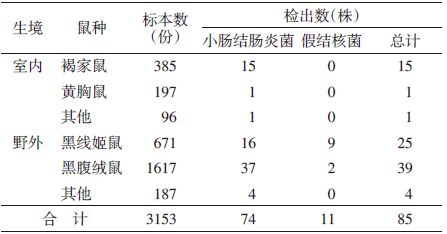
按不同生境统计,致病性耶尔森菌检出率室内为2.57%,野外为2.73%,差异无统计学意义(χ2=0.049,P=0.825)。其中室内分离获得小肠结肠炎菌17株,未检出假结核菌和鼠疫菌,野外分离获得小肠结肠炎菌57株,假结核菌11株。室内主要鼠种褐家鼠(Rattus norvegicus)和黄胸鼠(R. tanezumi)检出率差异有统计学意义(χ2=5.597,P<0.05)。野外小肠结肠炎菌主要鼠种黑线姬鼠和黑腹绒鼠(Eothenomys melanogaster)检出率差异无统计学意义(χ2=0.019,P=0.889),但假结核菌在黑线姬鼠和黑腹绒鼠中检出率差异有统计学意义(χ2=12.259,P<0.05)(表 2)。
 |
按不同监测点统计,楂林监测点检测标本2605份,分离获得小肠结肠炎菌66株、假结核菌11株;崇山、东河监测点各检测标本389和159份,分别检出小肠结肠炎菌7株和1株,未分离到假结核菌。各监测点间鼠形动物中致病性耶尔森菌检出率差异无统计学意义(楂林监测点与另外2个监测点小肠结肠炎菌:χ2=3.186,P=0.148;假结核菌:χ2=1.266,P=0.260)。
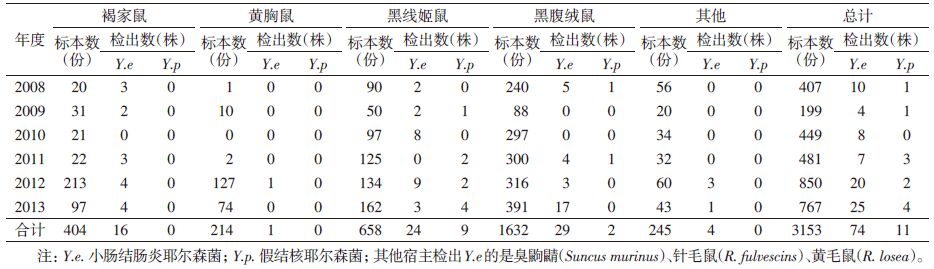
按不同鼠种分析,在黑线姬鼠、黑腹绒鼠、褐家鼠和黄胸鼠中分离到致病性耶尔森菌81株,占全部分离菌株的95.29%,检出率依次为黑线姬鼠(5.02%)、褐家鼠(3.96%)、黑腹绒鼠(1.90%)和黄胸鼠(0.47%)。
74株小肠结肠炎菌主要分布在黑腹绒鼠(29株,占39.19%)、黑线姬鼠(24株,占32.43%)和褐家鼠(16株,占21.62%);11株假结核菌分布在黑线姬鼠(9株,占81.82%)和黑腹绒鼠(2株,占18.18%)(表 3)。检出小肠结肠炎菌和假结核菌的鼠为该地区室内外主要宿主动物[5]。
 |
对分离获得的85株致病性耶尔森菌,参照WS 279-2008《鼠疫诊断标准》附录C、D中的方法进行鼠疫菌的fra基因检测和鼠疫F1抗原检测,结果均为阴性。
2.3 小肠结肠炎菌生物分型和血清分型68株小肠结肠炎菌经生物分型有2个生物型,其中生物1A型55株(包含O∶5型8株,O∶8型2株),生物3型1株(黑腹绒鼠),生物未定型12株。55株生物1A型菌中,分离自黑腹绒鼠29株,黑线姬鼠11株,褐家鼠10株,黄胸鼠和臭鼩鼱各1株,另3株分离自鼠疫监测区域内的鼠洞泥土样品。经用5种诊断血清进行凝集,确定为O∶5型8株(黑腹绒鼠4株、褐家鼠3株、黑线姬鼠1株),O∶8型2株(臭鼩鼱和黑线姬鼠各1株),血清未定菌58株。
2.4 小肠结肠炎菌毒力基因通过对68株菌株进行5种毒力基因检测,结果显示2个型别:ail-、ystA-、ystB+、yadA-、virF-型别模式检出29株(生物1A型28株,包含O∶5型3株,O∶8型2株);29株ystB+菌分离自黑腹绒鼠13株,黑线姬鼠10株,褐家鼠4株,黄胸鼠和臭鼩鼱各1株;ail-、ystA-、ystB-、yadA-、virF-型别模式检出39株。用O∶3血清型的rfbC基因也均未检出致病性的O∶3血清型小肠结肠炎菌,与诊断血清玻片凝集的血清分型结果一致。
3 讨 论耶尔森菌属有11个种[6],也有报道为17个种[7],但目前已经确定的具有致病性的仅3个种,即鼠疫菌、假结核菌和小肠结肠炎菌,其余的为条件致病性或非致病性菌。鼠疫菌和其他2种致病性耶尔森菌在自然界中是否存在拮抗关系,一直是广受关注的问题,有报道在假结核菌和小肠结肠炎菌分布的地域中动物可以缓慢阻止鼠疫菌侵入[8]。
小肠结肠炎菌根据生化反应可分为1A、1B、2~5型共6个生物型,其中生物1A型为非致病性菌株,携带高致病性毒力岛(HPI)的菌株属于生物1B型,主要为O∶8血清型致病性菌株,生物2~5型中致病性菌株与非致病性菌株均有分布。不同地区流行的致病性菌株各有不同,从国外调查结果看,欧洲和日本以4/O∶3型为主,美国以1B/O∶8型为主,而我国调查致病性菌株主要为3/O∶3型和2/O∶9型[9]。在义乌市的调查中未分离到O∶3和O∶9血清菌株,虽然分离到2株O∶8血清型菌株,但也属于非致病性的生物1A型。义乌市的小肠结肠炎菌经毒力基因检测,有29株携带ystB基因,而未携带其他任何毒力基因。一般认为生物1A型菌株属于非致病的,但近年来诸多研究证实,携带ystB的生物1A型菌株与人类腹泻之间有较明显的流行病学关联[10, 11, 12],生物1A型菌株可能对人类的健康构成危害。由此提示虽然在义乌市未分离到致病性的小肠结肠炎菌,但仍需提高警惕,防范这类非致病性小肠结肠炎菌可能对人类健康造成的危害。
Fukushima等[13]报道在中国宁夏鼠疫自然疫源地,有小肠结肠炎O∶9血清型菌株的地区,作为一种可能的屏障阻挡了鼠疫流行。有报道小鼠口服假结核菌和血清型O∶3、O∶5,27和O∶9的小肠结肠炎菌后对鼠疫菌有交叉免疫,但O∶8血清型菌株不能起到保护作用[14]。感染假结核菌和小肠结肠炎菌血清型O∶3、O∶5,27及O∶9后的动物对鼠疫菌有交叉免疫,这是由于假结核菌和小肠结肠炎菌O∶3、O∶5,27和O∶9血清型菌株的pYV质粒上,有相同类型的LcrV-Yps抗原,具有交叉免疫原性[15]。本次调查虽然未分离到小肠结肠炎菌O∶3、O∶5,27和O∶9血清型的菌株,但证实浙江省义乌市鼠疫历史疫源地存在假结核菌,而且这些假结核菌株均具有表达LcrV抗原的pYV毒力质粒(另文报道)。
义乌市在20世纪40年代曾经受到鼠疫细菌战的波及并造成鼠疫流行,又在2005年7月首次用IHA法证实2份鼠血清(均为黑线姬鼠)鼠疫F1抗体阳性,2006年至今再未检出鼠疫F1抗体阳性。而在其他2种致病性耶尔森菌的调查工作中,2005-2007年未分离到假结核菌和小肠结肠炎菌,2008年后这2种菌就连续地在监测区域内被分离到。这一结果是否可以认为义乌市鼠疫疫源地在2008年以前曾经有过鼠疫菌的存在? 鼠疫菌与这2种耶尔森菌的存在是否有关系?需要开展进一步调查研究。
本研究通过对义乌市鼠疫疫源地内2005-2013年连续9年的调查,发现从2008年以后,当地啮齿动物中的小肠结肠炎菌和假结核菌感染较为普遍,尤其是在春季的3-4月。小肠结肠炎菌在室内和野外的动物均有分布,假结核菌主要来源于野外动物。虽然义乌市分离到的小肠结肠炎菌为非致病性的生物1A型菌株,但也要注意预防非致病性耶尔森菌可能对人所造成的危害。分离到的小肠结肠炎菌未携带pYV毒力质粒的O∶3、O∶5,27和O∶9血清型菌株,但在假结核菌上均有存在。小肠结肠炎菌O∶3、O∶5,27和O∶9血清型菌株和假结核菌的存在,是否可以阻止鼠疫菌的入侵,是值得长期观察和研究的问题。在鼠疫监测的同时,对这2种致病性耶尔森菌开展长期的监测和相关研究,将对鼠疫监测工作起到一定的指导意义。
| [1] | 杨晓军,陈泽,刘敬泽. 中国蜱类的有效属和有效种[J]. 河北师范大学学报:自然科学版,2008,32(4):529-533. |
| [2] | 陈泽.中国蜱类名录订正、区系分析及扇头蜱亚科Rhipicephalinae 部分种类的生物学特性研究[D]. 石家庄:河北师范大学, 2007. |
| [3] | 刘明社,黄克峻,赵中夫,等. 9省区蜱类区系初步调查[J]. 长治医学院学报,2005,19(4):249-250. |
| [4] | 吕新军,唐青,冯育明,等. 新疆南部地区蜱传虫媒病毒分子生物学调查[J]. 中华实验和临床病毒学杂志,2005,19(4): 325-330. |
| [5] | Satta G,Chisu V,Cabras P,et al. Pathogens and symbionts in ticks:a survey on tick species distribution and presence of tick- transmitted micro - organisms in Sardinia,Italy[J]. J Med Microbiol,2011,60(1):63-68. |
| [6] | Aktas M,Vatansever Z,Ozubek S,et al. Molecular evidence for trans - stadial and transovarial transmission of Babesia occultans in Hyalomma marginatum and Rhipicephalus turanicus in Turkey[J]. Vet Parasito,2014,204(3/4):369-371. |
| [7] | Razmi G,Yaghfoori S. Molecular surveillance of Theileria ovis, Theileria lestoquardi and Theileria annulata infection in sheep and ixodid ticks in Iran[J]. Onderstepoort J Vet Res,2013,80 (1):635. |
| [8] | 张璘,王远志,陈创夫,等. 新疆北疆部分地区硬蜱伯氏疏螺旋体基因型研究[J]. 中华流行病学杂志,2014,35(3):39-42. |
| [9] | 邓国藩,姜在阶. 中国经济昆虫志. 第39册. 蜱螨亚纲. 硬蜱科[M]. 北京:科学出版社,1991:62-326. |
| [10] | 王启果,张渝疆,孙素荣. DNA序列应用于蜱类分子系统发育学的研究进展[J]. 疾病预防控制通报,2012,27(2):83-86. |
| [11] | Dantas-Torres F,Latrofa MS,Annoscia G,et al. Morphological and genetic diversity of Rhipicephalus sanguineus sensu lato from the New and Old Worlds[J]. Parasit Vectors,2013,6:213-229. |
| [12] | Black WC,Piesman J. Phylogeny of hard and soft-tick taxa (Acari: Ixodidae) based on mitochondrial 16S DNA sequences[J]. Proc Natl Acad Sci USA,1994,91(21):10034-10038. |
| [13] | 热孜万·阿不力孜,于心, 阿布力克木·阿不都热西提. 塔里木盆地三种扇头蜱的鉴别要点[J]. 地方病通报,2007,22(2):4-5. |
| [14] | 叶瑞玉,于心,陈饮如,等. 新疆南部地区蜱螨区系及医学意义[J]. 地方病通报,1995,10(4):30-34. |
| [15] | Murrell A,CamPbell NJ,Barker SC. Phylogenetic analyses of the rhipicephaline ticks indicate that the genus Rhipicephalus is paraphyletic[J]. Mol Phylogenet Evol,2000,16(1):1-7. |
| [16] | Gylfe A,Yabuki M,Drotz M,et al. Phylogeographic relationships of Ixodes uriae (Acari:Ixodidae) and their significance to transequatorial dispersal of Borrelia garinii[J]. Hereditas,2001, 134(3):195-199. |
| [17] | Caporale DA,Rich SM,Spielman A,et al. Discriminating between Ixodes ticks by means of mitochondrial DNA sequences[J]. Mol Phylogenet Evol,1995,4(4):361-365. |
| [18] | McManus DP, Bowles J. Molecular genetic approaches to parasite identification:their value in diagnostic parasitology and systematics[J]. Int J Parasitol,1996,26(7):687-704. |
| [19] | 吕继洲,吴绍强,张永宁,等. 小亚璃眼蜱、亚洲璃眼蜱和残缘璃眼蜱的分子生物学鉴定[J]. 中国畜牧兽医,2013,40(6): 7-13. |
| [20] | 戴艳菊,刘萍,高保全,等. 三疣梭子蟹4个野生群体线粒体 16S rRNA和COⅠ基因片段的比较分析[J]. 中国海洋大学学报,2010,40(3):54-60. |
| [21] | Switzer WM,Salemi M,Shanmugam V,et al. Ancient co- speciation of simian foamy viruses and primates[J]. Nature, 2005,434(7031):376-380. |
 2015, Vol. 26
2015, Vol. 26


