扩展功能
文章信息
- 宋秀平, 栗冬梅, 贾丽军, 鲁亮, 王君, 刘云彦, 姜亚运, 刘起勇
- SONG Xiu-ping, LI Dong-mei, JIA Li-jun, LU Liang, WANG Jun, LIU Yun-yan, JIANG Ya-yun, LIU Qi-yong
- 内蒙古小型兽类巴尔通体感染情况调查
- Investigation of Bartonella infection in small mammals in Inner Mongolia, China
- 中国媒介生物学及控制杂志, 2015, 26(3): 233-237
- Chin J Vector Biol & Control, 2015, 26(3): 233-237
- 10.11853/j.issn.1003.4692.2015.03.004
-
文章历史
- 收稿日期:2014-11-24
2. 泰山医学院
2 Taishan Medical University
巴尔通体(Bartonella)属于α变形菌纲,与其同源性较高的细菌有布鲁氏菌(Brucella spp.)和根瘤土壤杆菌(Agrobacterium tumefaciens)等[1]。目前已经命名的巴尔通体有24种以上及3个亚种[2, 3],已发现13种巴尔通体对人致病[2, 4],包括杆菌样巴尔通体(B. bacilliformis)、汉赛巴尔通体(B. henselae)、五日热巴尔通体(B. quintana)、伊丽莎白巴尔通体(B. elizabethae)、克氏巴尔通体(B. clarridgeiae)等[5]。巴尔通体感染可导致从淋巴腺疾病到较为严重的全身性系统疾病,严重程度和疾病的表现主要与机体的免疫状态有关。可引起的疾病有猫抓病(cat?scratch disease,CSD)、杆菌性血管瘤-杆菌性紫癜(bacillary angiomatosis and bacillary peliosis,BAP)、心内膜炎[6],还可出现肝脾肿大、腹水、血沉加快和C反应蛋白增高等[7, 8]。
巴尔通体感染属于人兽共患的自然疫源性疾病,小型兽类是巴尔通体最主要的自然宿主之一,目前从啮齿动物中分离到的巴尔通体种类最多,可以说是这种细菌最大的储存宿主群。除杆菌样巴尔通体、五日热巴尔通体的宿主是人类外[9],其余均可存在自然界中的动物体内,包括猫、犬、啮齿动物等。国外啮齿动物巴尔通体感染情况的调查已有很多,而国内主要局限在云南省[10, 11]、浙江省[12]、福建省[13]、山东省部分地区、海南省部分地区[14]、黑龙江省林区[5],目前尚没有从内蒙古地区分离出巴尔通体的报道,也不清楚该地区鼠类的感染情况,因此,有必要对内蒙古啮齿动物中巴尔通体的感染情况进行调查。
本研究对内蒙古地区小型兽类中巴尔通体感染情况进行调查,获得巴尔通体分离株以及该地区的病原体基因型,为该地区巴尔通体感染的预防控制提供科学依据。 1 材料与方法 1.1 调查点
2012-2013年,分别在内蒙古东乌那达慕会场西、嘎达布其镇东、额和宝力格阿宝线西31 km、额和宝力格镇北、那仁宝拉格北、那仁宝拉格苏木、吉日嘎郎图脑木罕、赛罕高毕东北2 km、二连浩特西里车站、二连浩特盐池10个地区捕鼠。 1.2 样本采集
用夹夜法捕获小型兽类,所有的小型兽类进行分类鉴定,然后无菌操作取肝和脾,置2.0 ml冻存管中,-40 ℃保存。 1.3 啮齿类动物脏器DNA提取
将啮齿动物肝、脾剪碎后 ,采用QIAamp Tissue Kit(Qiagen,Hilden,Germany)核酸提取试剂盒,按照产品说明书逐步提取DNA。 1.4 分离培养
将样品进行分离培养,每份样品取25 mg小型兽类的肝或脾用无菌研磨器研碎,然后加入200 μl胰酶大豆肉汤研成匀浆,接种于含5%脱纤维羊血的胰酶大豆琼脂培养基上,置于含5%CO2、37 ℃培养箱中,每天观察其生长情况并记录,最长达45 d,对巴尔通体疑似菌落进行染色鉴定,1~3 次纯化后,收集纯菌培养物于含30%甘油的胰酶大豆肉汤冻存管中,冻存于-70 ℃冰箱。 1.5 染色镜检
将疑似菌落进行革兰染色、Gimanez染色,均呈红色,油镜放大1000 倍观察细菌形态。 1.6 PCR检测
挑取疑似且革兰染色镜下见阴性小杆菌的菌落,收集于含100 μl去离子水(pH值8.0)的1.5 ml离心管中,混匀,100 ℃煮10 min,1844×g离心5 min,提取上清液作为模板,-20 ℃保存备用。PCR采用具有巴尔通体属水平特异性的引物(BhCS781.p~BhCS1137.n),上游引物 BhCS781.p 碱基序列:5′-GGG GAC CAG CTC ATG GTG G-3′,下游引物 BhCS1137.n 碱 基 序 列 :5′-AAT GCA AAA AGA ACA GTA AAC A-3′,对枸橼酸合酶基因(gltA)的379 bp片段进行扩增,电泳图中出现目标带即判断为阳性菌株。PCR 反应体系总量为 25 μl:含 pfuMasterMix 12.5 μl(北京天根科技有限公司),上下游引物各1 μl,模板 1 μl。扩增程序为95 ℃ 2 min,48 ℃ 30 s,72 ℃ 30 s,再 94 ℃ 30 s,48 ℃ 30 s,72 ℃ 30 s,进行30个循环,72 ℃延伸5 min 结束。取3 μl PCR扩增产物用Goldview染色后于1.5%的琼脂糖 凝 胶 经100 V 40 min电泳,设标准分子质量(Marker,100 bp Ladder)、阴性对照(用去离子水代替模板)和阳性对照(对照菌株的DNA)。使用凝胶成像仪观察并照像。 1.7 序列比对及数据分析
gltA基因是巴尔通体的遗传学分类标志,为进一步鉴定所检测到的DNA序列,对所有阳性标本进行测序,预计测序产物长度为379 bp,将所测得的序列在NCBI利用核酸比对程序Blast进行同源性搜索,然后用Mega 6.06软件构建系统进化树,用SPSS软件对所得数据进行统计学分析。 1.8 统计学处理
采用SPSS 13.0软件进行统计学分析。用χ2检验分析不同鼠种、不同脏器样本阳性率的差异有无统计学意义,检验水准为α=0.05。 2 结 果 2.1 小型兽类捕获情况
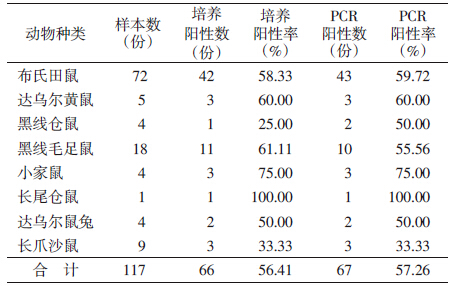
2012年在内蒙古锡林郭勒盟二连浩特市共捕获小型兽类8种117只,其中布氏田鼠(Lasiopodomys brandti)72只,达乌尔黄鼠(Spermophilus dauricus)5只,达乌尔鼠兔(Ochotona daurica)4只,黑线仓鼠(Cricetulus barabensis)4只,黑线毛足鼠(Phodopus sungorus)18只,小家鼠(Mus musculus)4只,长尾仓鼠(Cricetulus longicaudatus)1只,长爪沙鼠(Meliones unguiculatus)9只。2013年在内蒙古锡林郭勒盟二连浩特等地捕获小型兽类86只,其中三趾跳鼠(Dipus sagitta)21只,五趾跳鼠(Allactaga sibirica)14只,布氏田鼠14只,长爪沙鼠7只,蒙古短尾仓鼠(Allocricetulus eversmanni)8只,小毛足鼠(Phodopus roborovskii)5只,达乌尔黄鼠4只,小家鼠4只,赤颊黄鼠(Spermophilus pallidicauda)3只,黑线仓鼠2只,达乌尔鼠兔2只,刺猬(Hemiechinus auritus)2只。 2.2 巴尔通体感染情况
2012年从117只小型兽类血液样本中分离培养出疑似菌66株,革兰染色镜检均见阴性小杆菌,Gimanez染色均见紫红色小杆菌。肝脏DNA直接PCR测序阳性67份。经χ2检验,两种检测方法差异无统计学意义(χ2=0.005,P=0.945)。从肝脏和脾脏分离培养的结果差异亦无统计学意义(χ2=2.209,P=0.331)(表 1)。2013年从86只小型兽类血液样本中分离培养出疑似菌33株,总阳性率为38.37%(33/86)。有达乌尔黄鼠、五趾跳鼠、布氏田鼠、黑线仓鼠、短尾仓鼠、赤颊黄鼠、三趾跳鼠、长爪沙鼠8种受到感染,其中达乌尔黄鼠感染率最高(75.00%),其次为五趾跳鼠(71.43%)和布氏田鼠(64.29%)。经分析达乌尔黄鼠、五趾跳鼠与布氏田鼠的巴尔通体阳性率差异无统计学意义(χ2=0.249,P=0.883)(表 2)。
 |
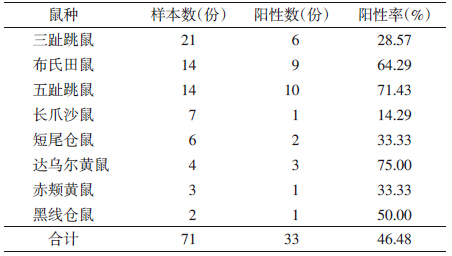 |
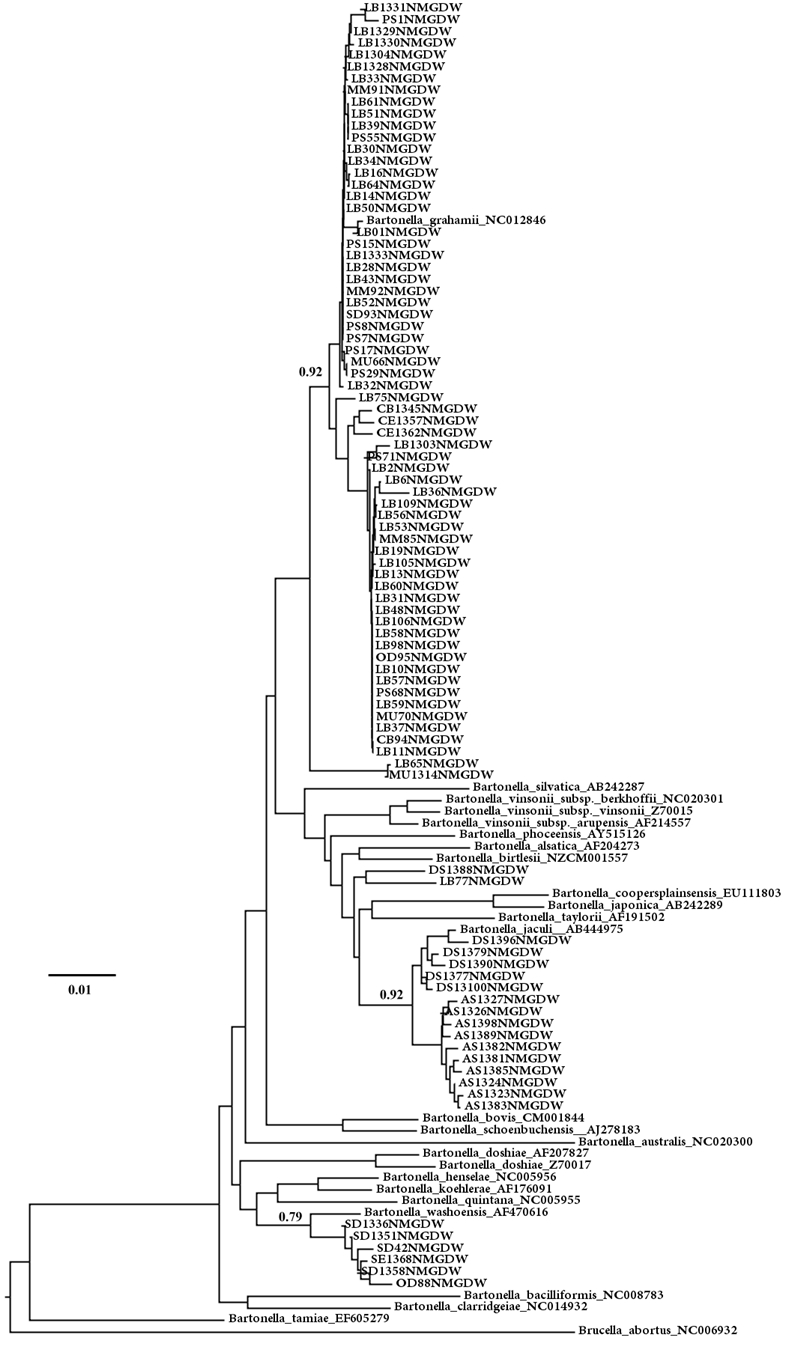
用具有巴尔通体属水平特异性的引物BhCS781.p~BhCS1137.n对99株疑似菌进行扩增,均为阳性,初步证实分离到的菌株均为巴尔通体。从测序的99株巴尔通体在不同鼠种中分型结果看(表 2),有一个明显的特点:分布具有一定的宿主特异性,B. jaculi种群主要感染五趾跳鼠(10/15),B. grahamii主要感染布氏田鼠(92/157),B. washoensis subsp. cynomysii主要感染黄鼠(3/9),之前在河北省康保牧场小型兽类调查中也是主要感染黄鼠(文章待发表)。
运用Mega 6.06软件,采用ML法构建系统进化树(图 1),将巴尔通体标准菌株和分离到的菌株gltA基因序列,运用ML法(设定自展法)分析构建系统发育树。从系统关系可以看出,分离到的巴尔通体菌株有多株与Bartonella grahamii NC012846聚为一个分支;4株与Bartonella washoensis AF470616聚为一支;多株与Bartonella jaculi AB444975聚为一支。上述3个分支均具有较高的bootstrap值。
|
| 图 1 从内蒙古宿主动物分离的99株巴尔通体与其他巴尔通体种的系统关系 Figure 1 Systematic relationship between the 99 Bartonella isolates |
巴尔通体宿主动物广泛,除了猫、犬等与人类关系密切外,野生小型兽类也是巴尔通体重要的自然宿主,是巴尔通体最大的贮存宿主[15]。国外研究证实巴尔通体的鼠类宿主动物带菌率较高,在英国及美国东南部鼠群带菌率为62.20%和42.20%[16, 17]。国内对巴尔通体的研究进展也在逐步深入,至今为止,我国已在云南、浙江、山东、上海、福建、河南、海南、黑龙江8个省(直辖市)进行相关研究,分别在鼠、猫、犬、华南虎、蜱、蚤中分离或检测出巴尔通体病原菌。
本研究成功分离出99株巴尔通体,分离鉴定为4个巴尔通体种群,包括B. jaculi、B. grahamii、B. washoensis subsp. cynomysii和B. vinsonii subsp. arupensis,巴尔通体在内蒙古部分地区小型兽类中广泛存在,2012年gltA基因检测阳性率为56.41%,2013年为38.37%,序列分析显示出巴尔通体基因型别的多样性,有明显的宿主特异性。在鼠中分离检测到的巴尔通体与人类致病性巴尔通体的遗传关系非常近。这些致病性巴尔通体可导致发热、猫抓病、视神经炎、菌血症、淋巴结炎、心内膜炎等,提示内蒙古小型兽类携带多种可能对人类致病的巴尔通体,为内蒙古及我国北方其他地区巴尔通体的研究奠定了基础,具有重要的公共卫生学意义。
| [1] | 白鹤鸣. 巴尔通体菌(Bartonella)[J]. 微生物学杂志,2005,25 (6):70-72. |
| [2] | Lin EY,Tsigrelis C,Baddour LM,et al. Candidatus Bartonella mayotimonensis and endocarditis[J]. Emerg Infect Dis,2010,16 (3):500-503. |
| [3] | del Valle LJ, Jaramillo ML, Talledo M,et al. Development of a 16S rRNA PCR - RFLP assay for Bartonella identification: applicability in the identification of species involved in human infections[J]. Universal J Microbiol Research,2014,2(1): 15-22. |
| [4] | Deng HK, Le RD, Buffet JPR,et al. Strategies of exploitation of mammalian reservoirs by Bartonella species[J]. Vet Res,2012, 43(1):15. |
| [5] | 左双燕. 我国黑龙江林区鼠形动物巴尔通体感染调查与分离鉴定[D]. 南京:中南大学,2012. |
| [6] | Raoult D,Roblot F,Rolain JM,et al. First isolation of Bartonella alsatica from a valve of a patient with endocarditis[J]. J Clin Microbiol,2006,44(1):278-279. |
| [7] | 徐建国,阚飙,张建中,等. 现场细菌学[M]. 北京:科学出版社,2011:698-706. |
| [8] | Maguiña C,Gotuzzo E. Bartonellosis:new and old[J]. Infect Dis Clin North Am,2000,14(1):1-21. |
| [9] | 栗冬梅,刘起勇,俞东征. 巴尔通体的宿主动物及传播媒介研究进展[J]. 中国媒介生物学及控制杂志,2005,16(2): 150-153. |
| [10] | 杨发莲. 巴尔通体在云南省的调查研究[J]. 地方病通报, 2005,20(1):73-74. |
| [11] | 杨发莲,白鹤鸣,杨慧.云南巴尔通体的系统发育多样性分析[J]. 中国热带医学,2008,8(12):2075-2077. |
| [12] | 凌锋,丁丰,龚震宇,等. 浙江省啮齿动物巴尔通体感染状况调查[J]. 中国媒介生物学及控制杂志,2014,25(1): 24-27. |
| [13] | 叶曦,姚美琳,李国伟. 福建省鼠形动物巴尔通体感染调查[J]. 中国人兽共患病学报,2006,22(8):779-781. |
| [14] | 宋秀平,刘起勇,鲁亮,等. 海南省小型兽类巴尔通体的分离培养和序列分析[J]. 中国媒介生物学及控制杂志,2010,21 (2):131-133. |
| [15] | 孙继民,宋秀平,傅桂明,等. 浙江省鼠形动物巴尔通体的遗传进化分析[J]. 中国人兽共患病学报,2010,26(6): 532-534,545. |
| [16] | Birtles RJ,Harrison TG,Molyneux DH. Grahamella in small woodland mammals in the UK:isolation,prevalence and host specificity[J]. Ann Trop Med Parasitol,1994,88(3):317-327. |
| [17] | Kosoy MY,Regnery RL,Tzianabos T, et al. Distribution, diversity and host specificity of Bartonella in rodents from the southeastern United States[J]. Am J Trop Med Hyg,1997,57 (5):578-588. |
 2015, Vol. 26
2015, Vol. 26


