扩展功能
文章信息
- 田汶佳, 邓良利, 李鹏, 张伟, 刘竹, 马林
- TIAN Wen-jia, DENG Liang-li, LI Peng, ZHANG Wei, LIU Zhu, MA Lin
- 实时荧光RT-PCR法快速检测三带喙库蚊中的流行性乙型脑炎病毒
- Rapid detection of Japanese encephalitis virus from Culex tritaeniorhynchus by real-time fluorescence reverse- transcriptase polymerase chain reaction
- 中国媒介生物学及控制杂志, 2015, 26(2): 137-140
- Chin J Vector Biol & Control, 2015, 26(2): 137-140
- 10.11853/j.issn.1003.4692.2015.02.007
-
文章历史
- 收稿日期:2014-10-15
流行性乙型脑炎(乙脑)是由乙脑病毒(JEV)经蚊虫媒介叮咬传播引起的。其病原体属黄病毒科黄病毒属,为单股正链RNA,全长约11 kb。临床症状以高热、意识障碍、抽搐、呼吸衰竭以及脑膜刺激征为主,主要威胁儿童身体健康,其病死率和致残率较高[1],是不可忽视的公共卫生问题。我国是乙脑疫情的高发区,目前除西藏、新疆和青海省(自治区)无乙脑病例报道外,其他地区均有疫情发生[2]。2006-2009年在四川省部分乙脑流行地区开展了蚊虫分布调查和虫媒病毒分离鉴定等相关工作,证实三带喙库蚊(Culex tritaeniorhynchus)是传播JEV最主要的媒介[3]。成都地区一直以来都是乙脑散发流行区,为了解成都市三带喙库蚊携带JEV情况,本研究采用实时荧光RTPCR方法对JEV进行快速检测,并进行了序列分析。
1 材料与方法 1.1 主要试剂和仪器DEPC溶液(97.5%)、核酸提取试剂盒(Maxwell 16 Tissue LEV Total RNA Purification Kit,PROMEGA)、JEV核酸测定试剂盒(荧光PCR法,上海之江生物科技股份有限公司)、一步法RTPCR试剂盒(QIAGEN)和DNA分子质量标准Marker Ⅱ(TIANGEN)。
1.2 标本来源2012年6-10月,选择成都市乙脑高发地区金堂县、崇州市和双流县的8个病例居住地作为调查点进行蚊虫采集。用诱蚊灯采集三带喙库蚊雌性成蚊10 656只,分为219份,每份样品50只左右。将分好的样品储存于2 ml冻存管后,部分加入1 ml RNAlater保存液,然后冻存于-85 ℃低温冰箱或将样品不做任何处理直接冻存于-85 ℃低温冰箱。
1.3 阳性对照和引物序列阳性对照为成都生物制品研究所生产的乙脑减毒活疫苗(SA14-14-2)。PrM区特异性核苷酸引物来自四川省疾病预防控制中心微生物检验室,引物序列:JEVF:CGT TCT TCA AGT TTA CAG CAT TAG C;JEVR:CCY RTG TTY CTG CCA AGC ATC-CAMCC,扩增长度为674 bp。
1.4 样品组织RNA的提取及实时荧光RTPCR检测将玻璃研磨器在0.1%的DEPC水溶液中浸泡过夜后,用高压蒸汽灭菌器120 ℃灭菌20 min以上,烘干待用。按照试剂盒说明书对每份样品进行前期处理,再用自动核酸提取仪提取组织RNA,收集100 μl的洗脱液。用JEV核酸测定试剂盒直接对当天提取的RNA样品进行检测,将阳性RNA样品保存于-85 ℃低温冰箱。
1.5 RTPCR扩增PrM基因序列使用一步法RT?PCR试剂盒进行扩增,反应体系如下: OneStep RTPCR Enzyme Mix 1 μl,OneStep RTPCR buffer(5×) 5 μl,dNTP Mix(10 mmol/L each)1 μl,JEVF和JEVR(20 pmol/μl)各0.5 μl,阳性RNA样品5 μl,RNasefree water 12 μl,总体积25 μl。反应条件:60 ℃ 1 min,42 ℃ 10 min,50 ℃ 30 min,95 ℃ 15 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 50 s,35个循环;72 ℃ 10 min末延伸。PCR产物用1.2%琼脂糖凝胶电泳检测。
1.6 核苷酸纯化测序和分析PCR产物的纯化和测序由生工生物工程(上海)股份有限公司完成。参照文献[4],从GenBank中选取国内外分离的覆盖5个基因型的24株JEV的PrM区序列,及作为外群毒株的墨累谷脑炎病毒(Murray Valley encephalitis virus)(NC-000943.1)序列,应用Clustal X1.83软件进行所测阳性序列与上述比对,Mega 5.0软件完成系统进化树的构建以及核苷酸和氨基酸同源性分析。
2 结 果 2.1 实时荧光RTPCR检测219份三带喙库蚊雌蚊样品的RNA提取液经实时荧光RTPCR检测,发现有7份样品的扩增曲线有跳跃趋势,呈弱阳性(图 1)。在阴、阳性对照品的FAM通道Ct值均达到要求的情况下,样品Ct值≤38,初步判定这7份样品为JEV核酸阳性,阳性率为3.2%。

|
| 图 1 部分蚊样品 RNA的实时荧光 RT-PCR扩增曲线 Figure 1 The amplification curves of some samples RNA by real-time fluorescence RT-PCR |
7份初步判定为JEV阳性的核酸样品经一步法RTPCR扩增后得到674 bp片段,与预期相符。序列测定表明,PrM基因区段共240个核苷酸。通过在NCBI上做Blast,结果进一步证实它们均为JEV。
2.2.2 基因分型图 2显示,JEVPrM基因核苷酸序列在系统进化中分成了明显的5支,分别为基因(G)Ⅰ~Ⅴ型,我国存在GⅠ、GⅢ和GⅤ型[5]。本研究中的7份阳性样本(JTLS-10、JTSCY-11、JTSCY-58、JTJFC-69、JTJFC-81、CZY-113和CZZ-129)的核苷酸序列均位于GⅠ型分支中,均属于JEV,并与我国四川省(2004、2007和2009年)和河南省(2004年)分离的毒株最为相邻;也与来自中国云南省、上海市,日本、韩国和柬埔寨分离的部分JEV同在一个进化支(图 2)。
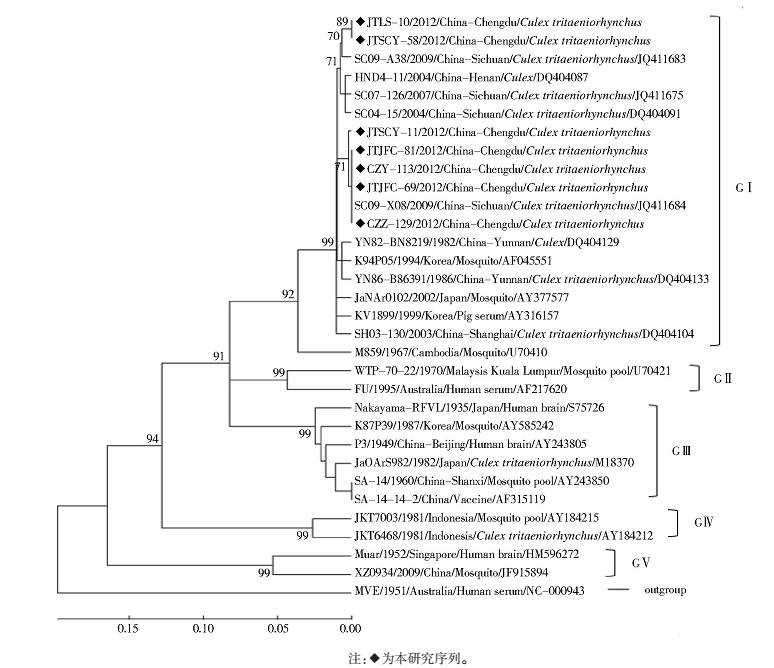
|
| 图 1 JEV PrM基因系统进化树 Figure 1 Phylogenetic tree of JEV based on PrM gene sequence |
选取本研究的7条序列和国内外部分相关序列进行PrM基因区段的核苷酸和氨基酸同源性比较(表 1),7条序列间的核苷酸同源性为97.0%~100%,氨基酸同源性均为100%;与目前使用疫苗株SA14-14-2(GenBank登录号:AF315119)比较,核苷酸差异位点达33~36个,同源性仅为82.5%~84.3%,氨基酸同源性均为96.2%,分别在PrM2、PrM64和PrM65三个氨基酸位点存在差异。与国内外部分GⅠ型的相关序列比较,核苷酸和氨基酸同源性分别为91.5%~100%和94.9%~100%。结合系统进化树分析,四川省2009年分离的SC09-X08毒株与本研究部分序列亲缘关系最近,核苷酸同源性达97.0%~100%,氨基酸同源性均为100%;而1967年分离自柬埔寨的M859株亲缘关系较远,其氨基酸位点存在4处差异。
近几年,四川省用病毒分离鉴定的方法在部分流行区分离到多株JEV,提示四川省内JEV的广泛存在与乙脑疫情相一致[3]。病毒分离方法具有耗时长,灵敏度不高,受限于活病毒,操作严格等缺点。本研究采用实时荧光RTPCR技术直接检测蚊媒携带JEV,具有操作自动化、简便省时和灵敏度高等特点,为更快更好地指导乙脑疫情防控奠定基础。选择成都市乙脑高发地区患者家中采集到的蚊虫样品,一是建立该法以提高阳性标本检出率,二是验证JEV在宿主间以及蚊-猪间的循环和传播模式。在长期保存蚊虫样品时,为了防止RNA过快降解,本研究在50%的样品中添加了RNAlater保存液。结果证明,只要将采集的样品及时冻存于-85 ℃低温冰箱,JEV不会轻易降解。
李晓宇等[1]对1949-1987年在中国乙脑主要流行地区分离的19株JEV的PrM区及E蛋白基因区序列进行了对比研究,结果均属GⅢ型。王环宇等[6]报道2001年在上海市奉贤县采集的蚊虫中分离到GⅠ型JEV,这是中国首次分离到GⅠ型JEV株。此后,我国各地均开始陆续报道发现该型JEV[7, 8, 9, 10]。2009年,Li等[11]首次从西藏林芝地区墨脱县采集的三带喙库蚊中分离到GⅤ型JEV,表明我国有多个基因型JEV流行。虽然目前我国有3种基因型,但不同年代和不同地区分离的JEV毒株数量及型别均存在明显差异,其分布呈动态变化趋势[5]。
本研究利用JEV PrM区域的240个核苷酸(456~695位)进行基因型分析[12],结果证实来自成都市三带喙库蚊的7份JEV阳性样本均为GⅠ型,在进化树上不仅与国内四川、河南、云南、上海等地的毒株为同一基因型,与四川省内不同年份不同地方分离的毒株有很近的亲缘关系,还与韩国、日本、柬埔寨等亚洲国家的部分毒株序列处在同一进化支上。综合以往四川省的调查,提示GⅠ型JEV在四川省分布较广。本研究序列与我国现用减毒活疫苗株SA14-14-2相比较,核苷酸同源性较低,而氨基酸同源性较高,说明该区段的核苷酸差异一般发生于氨基酸密码子的第3位,属于沉默突变,未引起氨基酸变化,或者差异位于第1、2位时发生同义突变,而在重要结构蛋白基因区段氨基酸位点无较大变化,由此认为我国现有的乙脑减毒活疫苗株在理论上可以覆盖包括现存病毒在内的毒株[6]。
| [1] | 李晓宇, 宋宏, 付士红, 等. 中国流行性乙型脑炎病毒分子生物学特性研究[J]. 病毒学报, 2004, 20(3):200-209. |
| [2] | 邓绪芳, 史子学, 邱亚峰, 等. 流行性乙型脑炎病原生态学的研究概况[J]. 动物医学进展, 2011, 32(2):111-114. |
| [3] | 张佳珂, 林世华, 刘学成, 等. 四川省虫媒病毒调查研究[J]. 预防医学情报杂志, 2010, 26(5):325-330. |
| [4] | 张佳珂, 林世华, 周兴余, 等. 四川省流行性乙型脑炎病毒优势基因型的研究[J]. 中华实验和临床病毒学杂志, 2012, 26 (4):241-245. |
| [5] | 孙玉杰, 张海林. 中国流行性乙型脑炎病毒基因型及分布[J]. 中国媒介生物学及控制杂志, 2012, 23(5):436-439. |
| [6] | 王环宇, 付士红, 李晓宇, 等. 我国首次分离到基因Ⅰ型乙型脑炎病毒[J]. 中华微生物学和免疫学杂志,2004, 24(11):843-849. |
| [7] | 王俊文, 付士红, 王环宇, 等. 辽宁省乙脑病毒的分离与鉴定[J]. 中华实验和临床病毒学杂志, 2006, 20(1):61-65. |
| [8] | 郑夔, 黄吉城, 李小波, 等. 实时荧光RT-PCR快速检测蚊体内乙型脑炎病毒及福建省基因Ⅰ型乙型脑炎病毒的发现[J]. 中国卫生检验杂志, 2008, 18(11):2212-2215. |
| [9] | 王环宇, 张佳珂, 付士红, 等. 四川省分离的基因Ⅰ型乙型脑炎病毒分子特征分析[J]. 中华微生物学和免疫学杂志,2009, 29(9):816-821. |
| [10] | 王韦华, 张旭, 张彦明, 等. 乙型脑炎病毒SXBJ07株的分离鉴定及序列分析[J]. 西北农林科技大学学报:自然科学版,2009, 37(4):1-6, 12. |
| [11] | LiYX,LiMH,FuSH,etal.Japaneseencephalitis,Tibet,China[J]. Emerg Infect Dis, 2011, 17(5):934-936. |
| [12] | ChenWR,TeshRB,RicoHesseR. Geneticvariationof Japanese encephalitis virus in nature[J]. J Gen Virol, 1990, 71 (12):2915-2922. |
 2015, Vol. 26
2015, Vol. 26



