扩展功能
文章信息
- 高晓艳, 付士红, 邹文菁, 彭延, 刘红, 曹玉玺, 江永忠, 梁国栋
- GAO Xiao-yan, FU Shi-hong, ZOU Wen-jing, PENG Yan, LIU Hong, CAO Yu-xi, JIANG Yong-zhong, LIANG Guo-dong
- 湖北省部分地区2010年蚊传虫媒病毒调查
- Investigation of arbovirus in some areas of Hubei province, 2010
- 中国媒介生物学及控制杂志, 2015, 26(2): 133-136
- Chin J Vector Biol & Control, 2015, 26(2): 133-136
- 10.11853/j.issn.1003.4692.2015.02.006
-
文章历史
- 收稿日期:2014-12-12
2 湖北省疾病预防控制中心
2 Hubei Center for Disease Control and Prevention
1992年在国际虫媒病毒中心登记的虫媒病毒已达535种,其中128种对人、畜致病,近年来虫媒病毒的种类仍在增加[1]。蚊虫是虫媒病毒最主要的传播媒介,在全世界发现的约3000种蚊虫中,约有300种可以传播虫媒病毒[1]。
湖北省位于我国中南部,长江中游,每年降雨充沛,具有丰富的蚊虫媒介种类[2],理论上应该存在多种蚊传虫媒病毒的流行。既往基于湖北省部分地区的调查研究显示湖北省存在流行性乙型脑炎病毒(Japanese Encephalitis virus,JEV)和版纳病毒[3, 4],湖北省是否还存在其他蚊传虫媒病毒,仍缺乏调查研究。为深入了解湖北省蚊传虫媒病毒的分布情况及其种类,为当地虫媒病毒病的预防控制提供理论依据,本研究2010年继续在湖北省开展蚊传虫媒病毒调查,选择未曾开展过调查的西部的恩施州和神农架林区,以及中部的随州市和江陵县进行蚊虫标本采集,并通过病毒分离和序列分析确定该地区的虫媒病毒种类、分布及分子生物学特征。
1 材料与方法 1.1 标本采集2010年7-8月,使用诱蚊灯(功夫小帅)和自制吸蚊管在湖北省恩施州、神农架林区、随州市和江陵县的猪圈、牛舍以及农村居民房屋等环境采集蚊虫标本。标本经过分类鉴定后,按照采集地区和蚊虫种类分装于冻存管中,50~100只/批,置于液氮罐中保存。
1.2 标本处理和病毒分离从液氮罐中取出蚊虫标本,将其倒入加有5 mm滚珠的2 ml圆底管中,向管中加入1.5 ml白纹伊蚊(Aedes albopictus)卵细胞(C6/36细胞)维持液(含60%DMEM、40%1640、双抗、谷氨酰氨),在组织振荡仪上以25次/s的频率,振荡3 min。将圆底管置于低温离心机4 ℃,15 000×g离心20 min,离心后取100 μl研磨液上清感染生长至70%~80%的单层BHK-21和C6/36细胞,吸附1 h后,弃上清,加入1 ml细胞维持液,分别置于37 ℃和28 ℃培养箱,每日观察细胞病变情况。当细胞病变达++++(约80%)时收获,-20 ℃反复冻融3次,然后于4 ℃,15 000×g离心5 min,取上清再次接种两种细胞;以相同程序盲传3代,无病变者舍弃。对出现病变的样品继续传代,直至出现规律病变。
1.3 病毒分离株的鉴定 1.3.1 间接免疫荧光(IFA)检测在病毒感染细胞后病变达到++~+++时吹下细胞,制备抗原片。使用鼠源性黄病毒属、布尼亚病毒属和甲病毒属特异性多克隆抗体以及JEV特异性单克隆抗体和盖塔病毒(Getah virus,GETV)特异性抗体作为一抗,FITC标记的羊抗鼠IgG 抗体作为二抗,参照文献[5]的方法进行IFA检测。
1.3.2 分子生物学检测用QIAamp? Viral RNA提取试剂盒(Qiagen公司)提取病毒RNA,利用随机引物p(dN)6和Ready to GoTM You prime First?Strand Beads试剂盒(英国GE Healthcare公司)制备病毒cDNA。参照文献[6, 7]中使用的黄病毒属、布尼亚病毒属、甲病毒属及JEV和GETV特异性引物进行PCR检测。对得到的阳性PCR样品进行回收,连接入pGEM?T easy载体(Promega公司)进行序列测定。
1.4 序列比对和进化分析使用Clustal X2.09软件进行序列比对,Bioedit进行序列编辑,MegAlign软件对病毒核苷酸和氨基酸的同源性进行分析,使用Mega 5.0软件绘制JEV和GETV系统发生树(Neighbor Joining方法),Bootstrap值设定为1000。
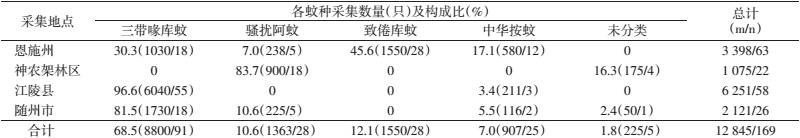
2 结 果 2.1 蚊虫种类及构成2010年7-8月在湖北省恩施州、神农架林区、随州市和江陵县共采集到3属4种12 845只蚊虫标本,包括三带喙库蚊(Culex tritaeniorhynchus)、中华按蚊(Anopheles sinensis)、致倦库蚊(Cx. pipiens quinquefasciatus)、骚扰阿蚊(Armigeres subalbatus)和未分类蚊虫。库蚊属是恩施州的主要优势蚊属,占该州诱蚊总数的75.9%(2580/3398);骚扰阿蚊是神农架林区的优势蚊种,占该林区诱蚊总数的83.7%(900/1075);三带喙库蚊是江陵县和随州市的优势蚊种,占两地诱蚊总数的92.8%(7770/8372)(表 1)。
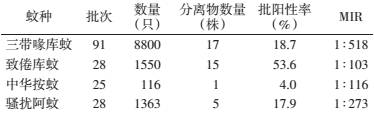
将蚊虫标本分为169批进行研磨处理,所有蚊悬上清液在BHK-21和C6/36细胞上连续盲传3代,结果显示获得能够引起C6/36细胞和BHK细胞稳定病变的阳性分离物38株(表 2),其中32株阳性分离物在接种BHK细胞后72 h开始出现规律病变,主要表现为细胞圆缩和脱落,120 h病变程度可达+++~++++;6株阳性分离物在接种BHK细胞后24 h便出现圆缩,72 h病变程度可达+++~++++;38株阳性分离物C6/36细胞病变多表现为48~72 h开始聚集、拉网、融合等。
 |
另外,从病毒分离物的蚊种来源看(表 3),致倦库蚊的批阳性率为53.6%(15/28),其次为三带喙库蚊、骚扰阿蚊和中华按蚊;致倦库蚊的最低现场感染率(MIR)最高,为1∶103,其他依次为中华按蚊、骚扰阿蚊和三带喙库蚊。
使用IFA进行血清学鉴定,将38株阳性分离物分别与黄病毒属、甲病毒属、布尼亚病毒属、JEV特异性单克隆抗体和GETV特异性抗体进行IFA检测,结果显示,32株分离物在使用黄病毒属和JEV特异性抗体进行IFA检测时,5株分离物在使用甲病毒属和GETV特异性抗体进行IFA检测时,1株分离物在使用黄病毒属、甲病毒属、JEV和GETV特异性抗体检测时,可以观察到特异性强荧光信号,提示分离物可能为JEV、GETV以及JEV和GETV的混合感染株。
2.3.2 分子生物学鉴定在IFA鉴定的基础上,使用针对JEV PrM基因和GETV NS2部分基因特异性引物对38株阳性分离物的cDNA进行序列扩增,进一步对新分离病毒进行分子生物学鉴定。对PCR扩增产物进行电泳,结果显示32株分离物在使用JEV PrM基因引物扩增获得约675 bp的目的核酸片段,5株分离物在使用GETV NS2基因特异引物扩增可获得约780 bp的目的核酸片段,1株分离物在使用两种引物扩增时分别获得675 bp和780 bp的目的核酸片段,测序结果经Blast比对后显示32株分离物为JEV,6株分离物为GETV,1株分离物为JEV和GETV混合感染株。
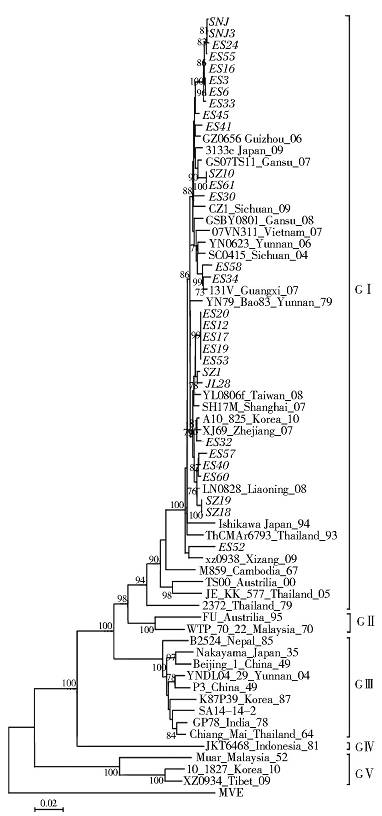
2.3.3 新分离JEV系统进化分析对部分新分离JEV进行E基因序列扩增测序,将得到的基因序列与GenBank中登录的来源于不同国家(地区)、不同年代的60株JEV的E基因核苷酸序列进行系统进化分析。以墨累山谷热病毒(MVE)为外群,构建基于Neighbor Joining方法的核苷酸系统进化树,结果显示(图 1),JEV分布在5个基因型别中,我国湖北省分离JEV均分布在基因Ⅰ型中,且新分离病毒未出现地域聚集现象,广泛地分布于基因Ⅰ型的不同进化分支中。E基因序列同源性分析结果显示,新分离JEV核苷酸同源性很高,为98.7%~100%,与疫苗株SA14-14-2(基因Ⅲ型)比较,核苷酸同源性为87.7%~88.1%,氨基酸同源性为98.2%~98.4%。新分离株与中国最早的基因Ⅰ型分离株M28的核苷酸和氨基酸同源性分别为95.1%~95.7%和99.2%~99.4%。
|
| 图 1 JEV E 基因为基础的系统进化分析 Figure 1 Phylogenetic analysis of JEV isolates based on E gene sequence |
以罗斯河病毒RRV2982为外群,将获得的4株新分离GETV的NS2基因序列与已在GenBank中注册的分离于其他地区和年代的GETV的NS2基因核苷酸序列进行系统进化分析,结果显示(图 2),湖北省新分离GETV与我国分离株HB0234、YN0540和韩国2004年分离株Korea的进化关系最近,位于同一个进化分支中;而与分离株LEIV/17441、M1、LEIV/16275和Sagiyama的进化关系较远。核苷酸序列同源性比较发现,新分离株同源性为98.0%~100%,同其他7株GETV分离株比较,核苷酸序列差异在0.5%~2.9%之间,与俄罗斯分离株LEIV16275同源性最低,为97.1%~97.4%,与我国河北省分离株HB0234和韩国分离株Korea的同源性最高,为98.2%~99.5%。

|
| 图 2 GETV NS2基因为基础的系统进化分析 Figure 2 Phylogenetic analysis of GETV isolates based on NS2 gene sequence |
湖北省曾是乙脑高发省份,各地市均有乙脑病例报告,20世纪90年代后发病主要集中在恩施州、十堰等鄂西地区[3]。本次调查分离到的33株JEV中28株分离自恩施州和神农架林区等,提示JEV在鄂西流行活跃,从病原学角度证实乙脑在鄂西持续高发病的原因。本次调查也从随州市和江陵县分离到JEV,说明JEV在湖北省流行活跃,具有广泛的分布。33株JEV中有14株分离自三带喙库蚊,15株来自致倦库蚊,表明当地的乙脑传播媒介以致倦库蚊和三带喙库蚊为主,与我国其他地区的JEV媒介一致[8]。另外也从中华按蚊和骚扰阿蚊中分离到JEV,说明JEV在湖北省具有广泛的传播媒介。
本研究通过对JEV E基因序列进行进化分析,发现新分离JEV均为基因Ⅰ型,说明基因Ⅰ型是目前湖北省流行的主要型别。此外,进化分析显示湖北省新分离JEV未聚集在一起,而是广泛地分布在基因Ⅰ型大进化分支中,与我国云南、河南、甘肃、广西、浙江、江西、台湾地区,越南和韩国等的分离株聚在多个分支中,提示湖北省JEV具有广泛的地域来源。
本次调查首次在湖北省分离到GETV,共分离到6株,其中4株来自三带喙库蚊,2株来自骚扰阿蚊。以往曾在我国河北、上海、云南、甘肃、山东和海南省(直辖市)等地多种传播媒介中分离到GETV[9, 10],此次又在湖北省首次分离到GETV,提示该病毒在我国具有广泛的地域分布。对新分离GETV的NS2片段的基因序列分析显示,新分离株与我国河北省分离株和韩国分离株的同源性最高,而与俄罗斯分离株的同源性最低。
本次调查从采集自恩施州同一猪圈同一批次的三带喙库蚊中同时分离到JEV和GETV,本课题组在山东、云南等地虫媒病毒调查中也发现这种现象,提示JEV和GETV具有相同或者相似的循环生境和传播媒介,对于两种病毒是否出自同一只蚊虫以及两种病毒共同感染是否会对彼此的复制产生影响,需要进一步验证。另外,两种病毒共同感染提示要加强当地病例中两种病毒抗体的同时检测。
| [1] | 梁国栋. 虫媒病毒是我国亟待加强的研究领域[J]. 中华实验和临床病毒学杂志, 2005, 19(4):305-306. |
| [2] | 王莉莉, 刘亦仁. 湖北省已知按蚊种类及其与疾病传播的关系[J]. 中国媒介生物学及控制杂志, 1996, 7(3):170-173. |
| [3] | 姜红月, 李铭华, 杨小兵, 等. 湖北省新分离的2株乙型脑炎病毒全基因组序列特征分析[J]. 中华预防医学杂志, 2010, 44(5):438-443. |
| [4] | 高晓艳, 付士红, 邹文菁, 等. 湖北省部分地区2009年蚊传虫媒病毒调查[J]. 中国媒介生物学及控制杂志, 2012, 23(5):421-423, 427. |
| [5] | 自登云, 陈伯权, 俞永新. 虫媒病毒与虫媒病毒病[M]. 昆明:云南科技出版社, 1995:381-423. |
| [6] | Kuno G. UniversaldiagnosticRT-PCR protocol for arboviruses[J]. J Virol Methods, 1998, 72(1):27-41. |
| [7] | 翟友刚, 王焕琴, 许海魁, 等. 甘肃省天水及陇南部分地区虫媒病毒调查[J]. 中国人兽共患病学报, 2008, 24(2):95-99. |
| [8] | Zheng YY,Li MH,Wang HY,et al. Japanese encephalitis and Japanese encephalitis virus in mainland China[J]. Rev Med Virol, 2012, 22(5):301-322. |
| [9] | ZhaiYG, WangHY, SunXH,etal. Complete sequence characterization of isolates of Getah virus(genus Alphavirus,family Togaviridae) from China[J]. J Gen Virol, 2008, 89(6):1446-1456. |
| [10] | 陈维欣, 王环宇, 付士红, 等. 我国新分离盖塔病毒的部分基因组分子特征研究[J]. 中华微生物学和免疫学杂志, 2010, 30(5):399-404. |
 2015, Vol. 26
2015, Vol. 26