扩展功能
文章信息
- 郑雅匀, 付士红, 唐晓燕, 李幸乐, 尚思远, 徐超, 梁国栋
- ZHENG Ya-yun, FU Shi-hong, TANG Xiao-yan, LI Xing-le, SHANG Si-yuan, XU Chao, LIANG Guo-dong
- 河南省新安县和息县2012年蚊传虫媒病毒调查
- Surveillance on mosquito-borne arboviruses in Xixian county and Xin'an county, Henan province, 2012
- 中国媒介生物学及控制杂志, 2015, 26(2): 127-132
- Chin J Vector Biol & Control, 2015, 26(2): 127-132
- 10.11853/j.issn.1003.4692.2015.02.005
-
文章历史
- 收稿日期:2014-11-20
2 河南省疾病预防控制中心;
3 新安县疾病预防控制中心;
4 息县疾病预防控制中心
2 Henan Center for Disease Control and Prevention;
3 Xin'an Center for Disease Control and Prevention;
4 Xixian Center for Disease Control and Prevention
蚊传病毒是通过蚊虫叮咬敏感脊椎动物导致人畜患病的一类病毒,蚊虫携带传播病毒但自身不患病[1]。国内外已报道多种对人畜致病的蚊传病毒,其中已证实在我国存在和流行的包括流行性乙型脑炎病毒(Japanese encephalitis virus,JEV)、登革热病毒(Dengue virus,DENV)及Tahyna病毒(Tahyna virus,TAHV)[1, 2]。河南省地处北亚热带、暖温带地区,四季分明,夏日炎热,降雨充沛,适宜的生态环境有利于蚊虫孳生。对河南省病毒性脑炎的流行病学监测结果显示,在蚊虫活动高峰的夏秋季节,当地存在病毒性脑炎患者[3]。本研究对河南省部分地区开展蚊虫调查和病毒分离,以掌握当地蚊虫及蚊传病毒分布特点和类型,为相关疾病的预防控制提供病原学依据。
1 材料与方法 1.1 蚊虫标本采集于2012年5-8月在洛阳市新安县磁涧镇的尤彰村和李村镇的晁庄村选择树林、牛棚和居民住房捕捉蚊虫;2012年8月期间在信阳市息县城郊乡新铺村、何店村的居民住房和猪圈中采集蚊虫。采用电动吸蚊器(DX-3型,慈溪市亚细亚卫生杀虫药械厂生产)和人诱法(蚊帐)相结合的方法采集蚊虫标本。在人房、牛圈和猪圈等环境采用电动吸蚊器采集蚊虫;在村庄周围的树林中采用人诱法捕捉蚊虫。每天采集时间为19:00-20:30。将采集到的蚊虫置-20 ℃冰箱冷冻,之后解剖镜下分类鉴定和计数分装,随后立即液氮冻存。
1.2 标本处理与病毒分离使用细胞培养法分离病毒。首先从液氮中取出装标本的冻存管,迅速将蚊虫倒入已编号并预冷的2 ml无菌平底离心管中,加入1.5 ml无血清MEM液(含8%双抗),用组织振荡仪Tissue lyser(QIAGEN,Germany)研磨至蚊虫组织碎片消失为止。将研磨液在4 ℃条件下以18 000×g离心30 min,取上清150 μl接种于生长成单层的BHK-21细胞和C6/36细胞的24孔细胞培养板,并分别于37 ℃和28 ℃的CO2孵箱中培养,连续培养6 d,逐日观察并记录细胞病变(CPE,cytopathic effects),当CPE达到++++时收获,反复冻融3次,以充分裂解细胞释放病毒,离心取上清液再次接种正常细胞,依此法连续盲传3代,无病变者剔除。
1.3 病毒鉴定通过反转录-聚合酶链反应(RT?PCR)法及序列分析法鉴定病毒。用Viral RNA Mini Kit(QIAGEN,Germany)从阳性分离物上清中提取病毒总RNA,操作流程参照试剂盒说明书;使用Invitrogen公司 “SuperScriptTMⅢFirst?Strand Synthesis System for RT?PCR”试剂盒及随机引物Oligo(dT20)反转录获得cDNA;取2 μl cDNA作为模板,使用TaKaRa公司GoTaq Green Master Mix,以及本室常规鉴定引物进行PCR扩增,引物信息详见表 1。反应结束后以1%琼脂糖凝胶电泳检测扩增产物,回收阳性PCR产物并测定产物序列信息(北京博迈德科技发展有限公司完成)。
 |
使用DNAMAN软件进行测序结果的序列拼接、编辑及校正;用Clustal X2.1软件进行序列比对;用DNAStar软件包的MegAlign软件完成核苷酸差异度分析;应用Mega v5.1生物信息学软件构建系统进化树(Neighbor?Joining法,自展值为1000)。
2 结 果 2.1 蚊虫标本种类分布2012年夏季在河南省共采集4属5种7149只蚊虫标本。其中洛阳市新安县采集蚊虫标本4001只(4001/7149,55.97%);信阳市息县共采集蚊虫标本3148只(3148/7149,44.03%)。两县优势蚊种各不相同,新安县骚扰阿蚊(Armigeres subalbatus)居多(2055/4001,51.36%),其次包括淡色库蚊(Culex pipens pallens)(1019/4001,25.47%)和三带喙库蚊(Cx. tritaeniorhynchus)(909/4001,22.72%);而息县以淡色库蚊为优势蚊种(2964/3148,94.16%)。淡色库蚊是唯一在两个城市均能采集到的蚊种。
2.2 病毒分离将7149只蚊虫标本按照采集地和蚊种,分为170批研磨,标本研磨上清液接种BHK-21和C6/36单层细胞,连续盲传3代,获得5株轻微病变分离物(背景信息见表 2)。5株分离物均能导致C6/36细胞产生轻微CPE,表现为培养72 h后出现个别圆肿细胞(图 1A),但直至培养第6天仍不发生聚集、脱落等病变特征,对BHK-21细胞不能导致CPE(图 1B)。将阳性分离物的C6/36细胞第3代培养物上清接种BHK-21细胞,发现48 h左右出现明显CPE,病变特征为不规则缩小,72 h 80%细胞发生病变并逐步脱落(图 1C)。
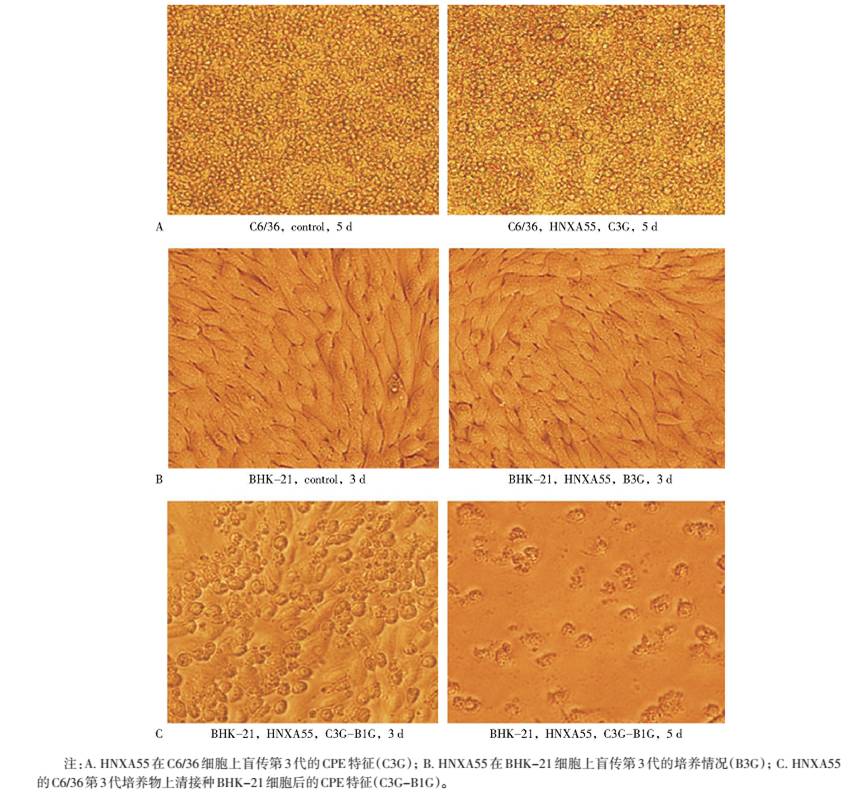
|
| 图 1 阳性分离物 HNXA55 在细胞培养中的病变特征 Figure 1 CPE caused by inoculating isolates HNXA55 in C6/36 and BHK-21 |
5株阳性分离物均来自于库蚊属蚊虫,结合其细胞培养特征,使用针对黄病毒属、JEV和CppDNV的特异引物对阳性分离物进行RT?PCR扩增。结果提示5株病毒均为JEV(图 2A),病毒在经C6/36细胞传代培养过程中确实实现了量的扩增,并且将其第3代C6/36细胞培养物上清液转接BHK-21细胞后,培养中发生了明显的病毒增殖(图 2B)。
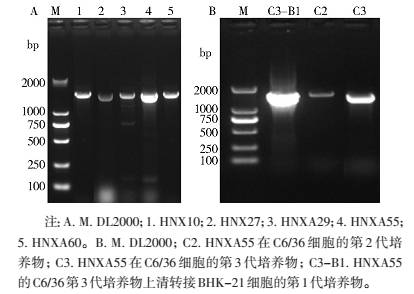
|
| 图 2 特异引物扩增新分离 JEV的 E 基因区段 Figure 2 RT-PCR amplification for E gene of new JEV isolates |
将5株JEV的基因序列提交GenBank比对,下载相关国内外毒株序列构建数据集,完成核苷酸同源性和系统进化分析。基于E基因序列的系统进化分析表明,目前已知JEV共分5个基因型,本研究获得的5株新分离JEV均为基因Ⅰ型,与山西省2009年(SX09S-01)和2012年(12LY039)分离株遗传关系最接近,其次与其较亲缘的毒株为辽宁省2007年分离株XJ69和江西省2008年分离株JX61,以上JEV毒株位于同一进化簇中(图 3)。
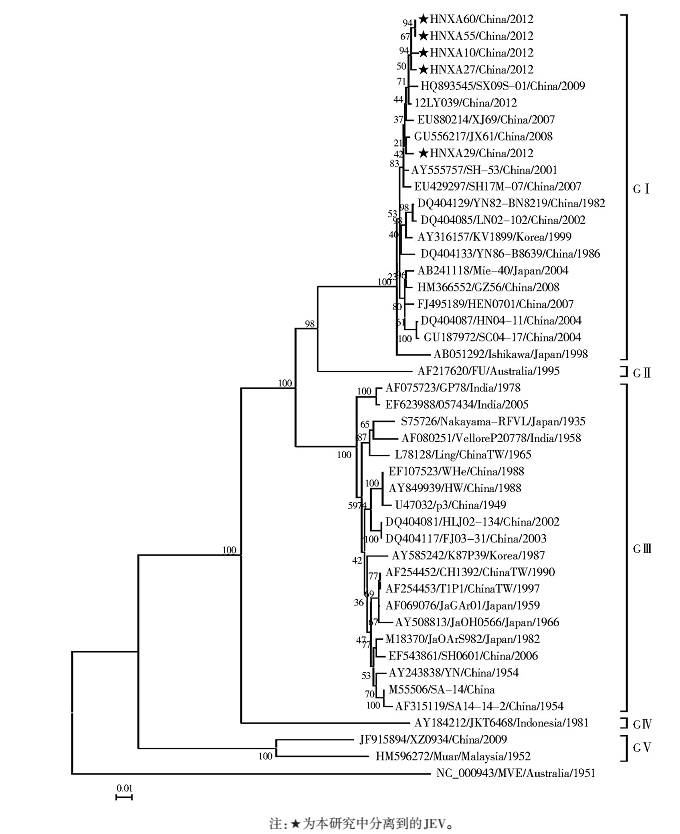
|
| 图 3 JEV分离株的 E 基因系统进化分析 Figure 3 Phylogenetic analysis of JEV isolates based on E gene sequences |
分析各毒株E基因序列同源性发现,河南省新分离株核苷酸一致性为98.6%~99.9%,其中HNXA55与HNXA60同源性最高达到99.9%;5株病毒氨基酸同源性为99.8%~100%,HNXA29、HNXA55、HNX10和HNX27的氨基酸同源性为100%;与河南省2004、2007年分离株相比,同源性分别为97.7%~98.0%和98.0%~98.3%;同基因Ⅰ型的其他JEV比较,与HEN0701、GZ56、SX09S-01、12LY039E氨基酸同源性最高均为99.8%。2012年河南省新分离株与我国目前使用的减毒疫苗株SA14-14-2之间存在11个共同差异位点(图 4红框标示),HNXA60自己有一个独特的位点E256(甘氨酸G→E谷氨酸);第76位氨基酸处,仅GP78和p3株为M(甲硫氨酸),包括河南省新分离JEV在内的其他毒株,此处均为T苏氨酸(图 4蓝框标示)。

|
| 图 4 新分离 JEV的 E 基因氨基酸比较 Figure 4 Comparison of E gene amino acid sequences of JEV Henan isolates |
流行性乙型脑炎(乙脑)是全球最严重的病毒性脑炎,病死率为35%~40%[4, 5]。目前发生并流行于亚太地区24个国家范围内[6],中国是乙脑的主要流行区。河南省长期以来属于我国乙脑高发省份,每年报告病例均位居前列[7, 8]。对河南省1950-2010年的乙脑监测统计分析显示,乙脑流行疫区主要分布在南部及东南部淮河流域平原盆地,疫情流行程度依地理分布南强北弱,7-9月为乙脑高发期[3, 9],近年来洛阳、信阳和南阳市成为河南省乙脑高发区,发病人数达该省总病例数的60.12%[3]。在2012年5月对洛阳市新安县和信阳市息县开展的乙脑发病率调查中[10],两个县5岁以下儿童均有乙脑病例,其中新安县出现低年龄组(<5岁儿童)和高年龄组(>40岁)发病率均较高的“双峰现象”,>80岁人群发病率达到26.93%[10]。上述结果提示目前河南省自然环境中存在JEV的活跃循环,蚊虫叮咬是该病毒传播的主要途径,但2010年以来当地未能从自然生境的蚊虫中分离到JEV。
本研究从河南省新安县和息县采集的淡色库蚊和三带喙库蚊(表 2)标本中最终鉴定分离到5株JEV,通过E基因氨基酸具体差异比较可以发现,河南省新分离株与减毒疫苗株SA14-14-2存在11个共同差异位点,比较E基因编码蛋白的8个重要位点(E107、E138、E176、E177、E264、E279、E315和E439)可知,河南省新分离株的神经毒力并未下降[11, 12, 13, 14],同时在E52、E270、E306位点处也与SA14-14-2一致[15, 16],提示新分离株同样具有较弱的神经侵入力。此外,国外有报道称E76位点改变(T转变为M)可导致病毒融合能力降低而致病变延迟[17],本研究中虽然新分离病毒株存在细胞培养时增殖异常、缓慢现象,但其E76位点并未发生氨基酸改变。自 2004年王环宇等[18]从南阳市唐河县蚊虫中分离到1株JEV并鉴定为基因Ⅰ型之后,2006、2007年也分别有从河南省的蚊虫和猪中分离到基因Ⅰ型JEV的报道[19, 20]。本研究自2012年采集的河南省库蚊中分离到5株基因Ⅰ型JEV,与以往报道一致,提示目前河南省自然界中循环的JEV仍以基因Ⅰ型为主。
值得注意的是,新分离JEV毒株均为将标本接种C6/36细胞传代培养后,才导致BHK-21细胞发生典型CPE,同时病毒本身在C6/36细胞传代过程中虽增殖,但CPE不明显。结合PCR扩增实验可以确定新分离毒株是经过C6/36细胞传代培养增殖后,才可在BHK-21增殖,其可能的深层次原因有待于进一步实验研究。C6/36细胞来自于白纹伊蚊(Aedes albopictus)卵细胞,对蚊媒病毒更加敏感而被广泛用于蚊传虫媒病毒的培养[21, 22],哺乳动物细胞BHK-21常被结合使用以分离对哺乳动物敏感的虫媒病毒。但本研究中发现,按照常规操作分别接种标本于2种细胞后,C6/36细胞CPE不明显、BHK-21细胞不病变的情况可能会错过获得阳性分离物,从而影响标本检测结果和结论。提示实验室检测人员,在从标本中分离JEV的过程中,最好增加将标本C6/36细胞培养物转接BHK-21细胞观察CPE的环节,并结合组织细胞培养和RT?PCR方法,增加病毒的检测及分离概率。
| [1] | 梁国栋. 我国新分离虫媒病毒及其传播媒介[J]. 中国媒介生 物学及控制杂志, 2010, 21(3):181-183. |
| [2] | Li WJ, Wang JL, Li MH, et al. Mosquitoes and mosquito-borne arboviruses in the Qinghai-Tibet Plateau-focused on the Qinghai area, China[J]. Am J Trop Med Hyg, 2010, 82(4):705-711. |
| [3] | 唐晓燕, 康锴, 李幸乐, 等. 河南省2006-2010年流行性乙型 脑炎病例监测[J]. 中华流行病学杂志, 2011, 32(11): 1128-1130. |
| [4] | Lindenbach BD, Thiel HJ, Rice CM. Flaviviridae:The viruses and their replication[M]/Knipe DM, Howley PM. Fields Virology,5th edition. Philadelphia: Lippincott Williams & Wilkins, 2007:1102-1153. |
| [5] | Halstead SB, Jacobson J. Japanese encephalitis vaccines[M]/Plotkin SA, Orenstein WA, Offitt PA. Vaccines, 5th edition. Philadelphia(PA):Saunders Elsevier, 2008:311-352. |
| [6] | Campbell GL, Hills SL, Fischer M, et al. Estimated global incidence of Japanese encephalitis:a systematic review[J]. Bull World Health Organ, 2011, 89(10):766-774. doi:10.2471/BLT.10.085233. |
| [7] | Wang HY, Li YX, Liang XF, et al. Japanese encephalitis in mainland China[J]. Jpn J Infect Dis, 2009, 62(5):331-336. |
| [8] | Zheng YY, Li MH, Wang HY, et al. Japanese encephalitis and Japanese encephalitis virus in mainland China[J]. Rev Med Virol, 2012, 22(5):301-322. |
| [9] | 唐晓燕, 许汴利, 郭万申, 等. 河南省1950-2008年流行性乙 型脑炎监测[J]. 中华流行病学杂志, 2009, 30(9):923-926. |
| [10] | 马红霞, 许玉玲, 李幸乐, 等. 河南省息县和新安县健康人群 乙型脑炎中和抗体阳性率及发病率[J]. 中国生物制品学杂 志, 2012, 25(6):1232-1235. |
| [11] | Ni HL, Burns NJ, Chang GJJ, et al. Comparison of nucleotide and deduced amino acid sequence of the 5'non-coding region and structural protein genes of the wild-type Japanese encephalitis virus strain SA14 and its attenuated vaccine derivatives[J]. J Gen Virol, 1994, 75(6):1505-1510. |
| [12] | Ni HL, Chang GJJ, Xie H, et al. Molecular basis of attenuation of neurovirulence of wild-type Japanese encephalitis virus strain SA14[J]. J Gen Virol, 1995, 76(2):409-413. |
| [13] | 李玉华, 胁田隆, 保井孝太郎. 流行性乙型脑炎病毒E蛋白上 与病原性相关的氨基酸[J]. 中国生物制品学杂志, 2002, 15 (1):5-8. |
| [14] | Zhao ZJ, Date T, Li YH, et al. Characterization of the E-138 (Glu/Lys)mutation in Japanese encephalitis virus by using a stable, full-length, infectious cDNA clone[J]. J Gen Virol,2005, 86(8):2209-2220. |
| [15] | Cecilia D, Gould EA. Nucleotide changes responsible for loss of neuroinvasiveness in Japanese encephalitis virus neutralization- resistant mutants[J]. Virology, 1991, 181(1):70-77. |
| [16] | Ni HL, Barrett ADT. Attenuation of Japanese encephalitis virus by selection of its mouse brain membrane receptor preparation escape variants[J]. Virology, 1998, 241(1):30-36. |
| [17] | Vrati S, Agarwal V, Malik P, et al. Molecular characterization of an Indian isolate of Japanese encephalitis virus that shows an extended lag phase during growth[J]. J Gen Virol, 1999, 80(Pt 7):1665-1671. |
| [18] | 王环宇, 郝宗宇, 付士红, 等. 河南省唐河县分离到基因1型乙 型脑炎病毒[J]. 中华实验和临床病毒学杂志, 2008, 22(2): 83-86. |
| [19] | 付士红, 翟友刚, 郝宗宇, 等. 2006年河南省南阳市流行性乙 型脑炎病毒的分离与分子特征分析[J]. 疾病监测, 2010, 25 (5):346-350. |
| [20] | Zheng H, Shan TL, Deng Y, et al. Molecular characterization of Japanese encephalitis virus strains prevalent in Chinese swine herds[J]. J Vet Sci, 2013, 14(1):27-36. |
| [21] | 自登云, 陈伯权, 俞永新. 虫媒病毒与虫媒病毒病[M]. 昆明: 云南科技出版社, 1995:1-383. |
| [22] | 黄桢祥. 医学病毒学基础及实验技术[M]. 北京:科学出版社,1990:286-290. |
 2015, Vol. 26
2015, Vol. 26



