扩展功能
文章信息
- 田建国, 黎桂福, 张小萍, 彭丽霞, 李俊, 徐海燕, 徐瑞芳
- TIAN Jian-guo, LI Gui-fu, ZHANG Xiao-ping, PENG Li-xia, LI Jun, XU Hai-yan, XU Rui-fang
- 剂量投螺条件下泥土中活性螺卵检测方法研究
- A comparative detections for active eggs of Oncomelania hupensis Gredler in soils with varying densities
- 中国媒介生物学及控制杂志, 2014, 25(6): 558-560
- Chin J Vector Biol & Control, 2014, 25(6): 558-560
- 10.11853/j.issn.1003.4692.2014.06.019
-
文章历史
- 收稿日期:2014-06-19
2 上海市疾病预防控制中心;
3 湖南省中医药研究院附属医院信息科, 长沙 410006
2 Shanghai Center for Disease Control and Prevention;
3 The Attached Hospital of Chinese Medicine Institute of Hunan Province, Changsha 410006, Hunan Province, China
钉螺(Oncomelania hupensis)是传播血吸虫的唯一中间宿主,已控制血吸虫病地区重新出现钉螺孳生,在有隐性感染病例的情况下造成流行的可能性不能完全排除[1, 2, 3]。钉螺可以通过多种介质进行传播[4],既往的研究中发现夏季高温季节的泥土中含有可孵化的螺卵[5, 6],因此含有钉螺螺卵的泥土作为介质传播钉螺的可能性需要进行研究,而对泥土中活性螺卵的检测是查出泥土中是否有活性螺卵的手段之一。目前已知的文献只有镜检法和收集螺卵恒温孵化法,但两种方法具有操作和实验条件的局限性,限制了现场应用,需要寻找出一种更简便易行的方法,为此我们开展了相同面积、模拟投入不同剂量钉螺条件下,对2年后土壤进行钉螺螺卵检验方法研究,现将结果报告如下。 1 材料与方法 1.1 实验现场
选择上海市历史上有钉螺孳生的任屯村作为实验现场,在血吸虫病防治馆内建成总面积约30 m2的钉螺饲养池,分为6个实验池,每块面积200 cm×200 cm,饲养钉螺实验土层厚度约33 cm。池与池之间设有防止钉螺逃逸约8 cm宽的防护沟,池中设有模拟水塘。 1.2 实验用土壤
采自青浦区任屯村周边,经镜检法和收集螺卵恒温孵化法进行检测未发现螺卵和钉螺的土壤作为实验用土。 1.3 钉螺
选择安徽省贵池区有螺地区野生湖北钉螺指名亚种(O. hupensis hupensis)成螺。采用逸蚴法剔除感染性血吸虫,鉴别雌雄后,在室内分开饲养1个月[5],选取有活力的雌雄钉螺,分别标记为白色和红色,分成6组,每组各为25、50、100、200、400、800只(雌雄各半),于2010年11月25日随机投放于实验池的土表,即投螺量分别为12.5、25、50、100、200、400只/m2钉螺。 1.4 仪器
土壤称重设备采用电子天平(JM12001型,浙江省余姚市纪铭称重校验设备有限公司生产)。 1.5 钉螺螺卵孵化实验
自然繁殖2年后,采用对角线采土法采取模拟饲养钉螺池内的泥土约2000 g,捡出成螺后分别称取3份500 g土壤用于下述4种方法实验,隔1周重复采样1次。 1.5.1 镜检法[7]
称取500 g泥土,用双筛水洗法获得筛取物,在解剖镜下直接查取螺卵。 1.5.2 收集螺卵恒温孵化法[8]
将1.5.1中镜检后获得的筛取物放入搪瓷碗内加去氯水。置24~25 ℃的恒温实验室进行孵化,每周观察1次,检查有无幼螺。3周后用去氯水淘洗后计数幼螺及死活只数。 1.5.3 直接恒温孵化法
称取500 g泥土,置于搪瓷碗中,以去氯水保持土壤湿度,在25 ℃的实验室自然孵化。每天观察1次,检查有无幼螺。2个月后用去氯水在铜箩内淘洗计数有无幼螺并获取筛取物,再次按照1.5.1、1.5.2方法重新进行实验。 1.5.4 自然状态孵化法
称取500 g泥土,置于搪瓷盆中,植入面积为33 cm×33 cm、土层厚约33 cm,与钉螺饲养相同的自然环境中,加入河道水自然孵化。每天观察3次,连续观察2个月检查有无幼螺出现。 1.6 统计学处理[9, 10]
不同投螺剂量与土壤中检出螺卵、孵化出新螺的剂量关系分析使用对数线性回归法进行分析,4种检测方法间螺卵或幼螺检出率采用χ2检验及一致性检验进行分析,Kappa值计算采用Excel软件自编程序,其余采用SPSS 10.0软件进行统计学分析。 2 结 果
2.1 螺卵和钉螺检出情况
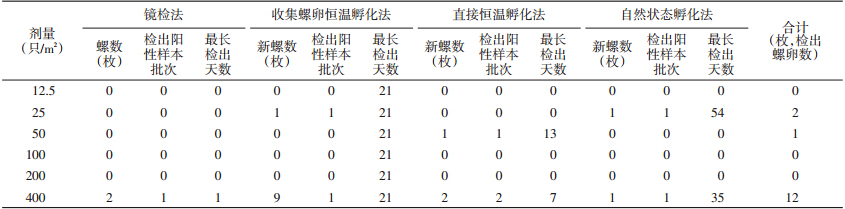
采集4个批次、6个不同剂量、500 g/份,共计24个样本的泥土标本进行实验。结果显示,采用收集螺卵恒温孵化法能检出25只/m2投螺剂量下泥土中的螺卵量,而镜检法只能检测出400只/m2投螺剂量下泥土中的含螺卵情况。镜检法检出1个批次、1个样品;收集螺卵恒温孵化法和自然状态孵化法检出2个批次、2个样品(表 1)。
为探讨投螺剂量与螺卵孵化关系,采用第1次收集螺卵孵化法孵化出的钉螺数与原始投螺量进行分析,对数线性回归无统计学意义(Y=1.7312Lnx-5.7060),无剂量反应关系(表 2)。
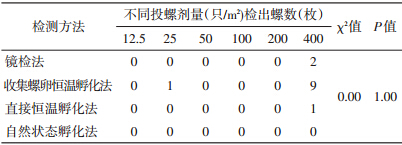
500 g土壤样品中检出螺数经多个样本比较,Kruskal?Wallis H 检验,4种方法螺卵或幼螺检出率差异无统计学意义(P=1.00)(表 3)。
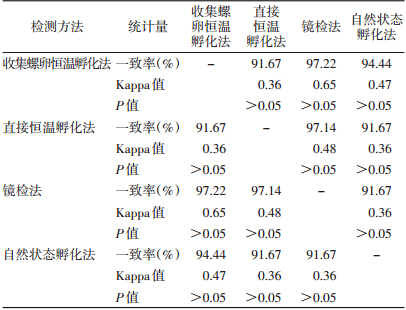
镜检法与收集螺卵恒温孵化法一致性检验(Kappa值=0.65,P>0.05),镜检法与直接恒温孵化法一致性检验(Kappa值=0.48,P>0.05),收集螺卵恒温孵化法与直接恒温孵化法一致性检验(Kappa值=0.36,P>0.05),收集螺卵恒温孵化法与自然状态孵化法一致性检验(Kappa值=0.47,P>0.05),直接恒温孵化法与自然状态孵化法一致性检验(Kappa值=0.36,P>0.05),镜检法与自然状态孵化法一致性检验(Kappa值=0.36,P>0.05),经统计学分析,均不具有一致性(表 4)。
通过研究发现,与水网地区钉螺可以在水网其他地区能够再生一样[11, 12],湖沼型钉螺也可以在水网地区再生,但生存情况不良[13]。有螺的泥土可以在实验室和自然状态下孵化出螺卵,说明泥土作为介质传播钉螺具备可能性。从表 1可以看出,4种检验方法的检出水平和检出时间不同。使用镜检法[6]直接检测螺卵法因受个人技术水平、显微镜配备及操作熟练程度、对钉螺螺卵形态学掌握程度的判定,在技术上受到一定限制,而且由于受到土壤中其他混杂螺卵的限制,直接影响到对是否有钉螺螺卵的判定,本研究第1次实验时,同一个土壤样本通过镜检只查到2只螺卵,而通过直接状态孵化法孵化出9只幼螺,说明镜检法的检测效率的确存在一定局限性。在处理样品时,如该检验方法不涉及进一步孵化实验,建议用普通水进行土壤预处理,可以降低检测成本。
本实验采用收集螺卵恒温孵化法有较高的检出率,但该检验方法需要进行土壤的预处理,处理过程中需使用大量的去氯水,一些不具备产生大量去氯水设施及恒温条件的实验室难以开展检测。直接恒温孵化法可以孵化出活性幼螺,该法比较简便,不需要较高的实验室条件,也不需要进行土壤的预处理。在2个月实验结束后,分别用镜检法和收集螺卵恒温孵化法进行重复实验,结果与本方法实验结果一致,即未发现螺卵和孵化出幼螺,证明实验的稳定性,是一种值得研究探讨的方法。
自然状态孵化法也可以孵化出幼螺,但孵化周期较长,检测阳性时间在35 d以上,而且样品的检出阳性率也有待进一步探讨。但该实验方法经过了高温季节,证明高温季节泥土中含有可孵化的活性螺卵。
从本研究看,土壤中螺卵和原始投螺数未表现出应有的剂量反应关系,不同投螺对数剂量与土壤中检出螺卵和孵化出幼螺不呈剂量反应关系。本研究在3个剂量水平下土壤中检出钉螺,分别是25、50和400只/m2剂量组。尤其是400只/m2剂量水平下检出螺卵和孵化出幼螺较多,因此认为,投入25只/m2钉螺是检出活性螺卵的下限,但较稳定检出钉螺螺卵或活性钉螺的检出限可能是400只/m2的投螺量的实验池,提示设置更高剂量组可能出现更好的阳性结果。出现此种现象,可能与泥土中活性螺卵在自然状态下是一种非连续性分布,其检出效率受到土壤中钉螺量和雌螺产卵量的综合限制等有关。
通过检出有阳性螺卵或孵化出活性钉螺方法的Kruskal?Wallis H检验和一致性检验,4种方法检出效果无差异。由于目前泥土中活性螺卵检出或孵化实验尚无统一标准,因此4种方法缺少标准方法对照,检验各具优缺点。
钉螺(Oncomelania hupensis)是传播血吸虫的唯一中间宿主,已控制血吸虫病地区重新出现钉螺孳生,在有隐性感染病例的情况下造成流行的可能性不能完全排除[1, 2, 3]。钉螺可以通过多种介质进行传播[4],既往的研究中发现夏季高温季节的泥土中含有可孵化的螺卵[5, 6],因此含有钉螺螺卵的泥土作为介质传播钉螺的可能性需要进行研究,而对泥土中活性螺卵的检测是查出泥土中是否有活性螺卵的手段之一。目前已知的文献只有镜检法和收集螺卵恒温孵化法,但两种方法具有操作和实验条件的局限性,限制了现场应用,需要寻找出一种更简便易行的方法,为此我们开展了相同面积、模拟投入不同剂量钉螺条件下,对2年后土壤进行钉螺螺卵检验方法研究,现将结果报告如下。 1 材料与方法 1.1 实验现场
选择上海市历史上有钉螺孳生的任屯村作为实验现场,在血吸虫病防治馆内建成总面积约30 m2的钉螺饲养池,分为6个实验池,每块面积200 cm×200 cm,饲养钉螺实验土层厚度约33 cm。池与池之间设有防止钉螺逃逸约8 cm宽的防护沟,池中设有模拟水塘。 1.2 实验用土壤
采自青浦区任屯村周边,经镜检法和收集螺卵恒温孵化法进行检测未发现螺卵和钉螺的土壤作为实验用土。 1.3 钉螺
选择安徽省贵池区有螺地区野生湖北钉螺指名亚种(O. hupensis hupensis)成螺。采用逸蚴法剔除感染性血吸虫,鉴别雌雄后,在室内分开饲养1个月[5],选取有活力的雌雄钉螺,分别标记为白色和红色,分成6组,每组各为25、50、100、200、400、800只(雌雄各半),于2010年11月25日随机投放于实验池的土表,即投螺量分别为12.5、25、50、100、200、400只/m2钉螺。 1.4 仪器
土壤称重设备采用电子天平(JM12001型,浙江省余姚市纪铭称重校验设备有限公司生产)。 1.5 钉螺螺卵孵化实验
自然繁殖2年后,采用对角线采土法采取模拟饲养钉螺池内的泥土约2000 g,捡出成螺后分别称取3份500 g土壤用于下述4种方法实验,隔1周重复采样1次。 1.5.1 镜检法[7]
称取500 g泥土,用双筛水洗法获得筛取物,在解剖镜下直接查取螺卵。 1.5.2 收集螺卵恒温孵化法[8]
将1.5.1中镜检后获得的筛取物放入搪瓷碗内加去氯水。置24~25 ℃的恒温实验室进行孵化,每周观察1次,检查有无幼螺。3周后用去氯水淘洗后计数幼螺及死活只数。 1.5.3 直接恒温孵化法
称取500 g泥土,置于搪瓷碗中,以去氯水保持土壤湿度,在25 ℃的实验室自然孵化。每天观察1次,检查有无幼螺。2个月后用去氯水在铜箩内淘洗计数有无幼螺并获取筛取物,再次按照1.5.1、1.5.2方法重新进行实验。 1.5.4 自然状态孵化法
称取500 g泥土,置于搪瓷盆中,植入面积为33 cm×33 cm、土层厚约33 cm,与钉螺饲养相同的自然环境中,加入河道水自然孵化。每天观察3次,连续观察2个月检查有无幼螺出现。 1.6 统计学处理[9, 10]
不同投螺剂量与土壤中检出螺卵、孵化出新螺的剂量关系分析使用对数线性回归法进行分析,4种检测方法间螺卵或幼螺检出率采用χ2检验及一致性检验进行分析,Kappa值计算采用Excel软件自编程序,其余采用SPSS 10.0软件进行统计学分析。 2 结 果
2.1 螺卵和钉螺检出情况
采集4个批次、6个不同剂量、500 g/份,共计24个样本的泥土标本进行实验。结果显示,采用收集螺卵恒温孵化法能检出25只/m2投螺剂量下泥土中的螺卵量,而镜检法只能检测出400只/m2投螺剂量下泥土中的含螺卵情况。镜检法检出1个批次、1个样品;收集螺卵恒温孵化法和自然状态孵化法检出2个批次、2个样品(表 1)。
为探讨投螺剂量与螺卵孵化关系,采用第1次收集螺卵孵化法孵化出的钉螺数与原始投螺量进行分析,对数线性回归无统计学意义(Y=1.7312Lnx-5.7060),无剂量反应关系(表 2)。
500 g土壤样品中检出螺数经多个样本比较,Kruskal?Wallis H 检验,4种方法螺卵或幼螺检出率差异无统计学意义(P=1.00)(表 3)。
镜检法与收集螺卵恒温孵化法一致性检验(Kappa值=0.65,P>0.05),镜检法与直接恒温孵化法一致性检验(Kappa值=0.48,P>0.05),收集螺卵恒温孵化法与直接恒温孵化法一致性检验(Kappa值=0.36,P>0.05),收集螺卵恒温孵化法与自然状态孵化法一致性检验(Kappa值=0.47,P>0.05),直接恒温孵化法与自然状态孵化法一致性检验(Kappa值=0.36,P>0.05),镜检法与自然状态孵化法一致性检验(Kappa值=0.36,P>0.05),经统计学分析,均不具有一致性(表 4)。
通过研究发现,与水网地区钉螺可以在水网其他地区能够再生一样[11, 12],湖沼型钉螺也可以在水网地区再生,但生存情况不良[13]。有螺的泥土可以在实验室和自然状态下孵化出螺卵,说明泥土作为介质传播钉螺具备可能性。从表 1可以看出,4种检验方法的检出水平和检出时间不同。使用镜检法[6]直接检测螺卵法因受个人技术水平、显微镜配备及操作熟练程度、对钉螺螺卵形态学掌握程度的判定,在技术上受到一定限制,而且由于受到土壤中其他混杂螺卵的限制,直接影响到对是否有钉螺螺卵的判定,本研究第1次实验时,同一个土壤样本通过镜检只查到2只螺卵,而通过直接状态孵化法孵化出9只幼螺,说明镜检法的检测效率的确存在一定局限性。在处理样品时,如该检验方法不涉及进一步孵化实验,建议用普通水进行土壤预处理,可以降低检测成本。
本实验采用收集螺卵恒温孵化法有较高的检出率,但该检验方法需要进行土壤的预处理,处理过程中需使用大量的去氯水,一些不具备产生大量去氯水设施及恒温条件的实验室难以开展检测。直接恒温孵化法可以孵化出活性幼螺,该法比较简便,不需要较高的实验室条件,也不需要进行土壤的预处理。在2个月实验结束后,分别用镜检法和收集螺卵恒温孵化法进行重复实验,结果与本方法实验结果一致,即未发现螺卵和孵化出幼螺,证明实验的稳定性,是一种值得研究探讨的方法。
自然状态孵化法也可以孵化出幼螺,但孵化周期较长,检测阳性时间在35 d以上,而且样品的检出阳性率也有待进一步探讨。但该实验方法经过了高温季节,证明高温季节泥土中含有可孵化的活性螺卵。
从本研究看,土壤中螺卵和原始投螺数未表现出应有的剂量反应关系,不同投螺对数剂量与土壤中检出螺卵和孵化出幼螺不呈剂量反应关系。本研究在3个剂量水平下土壤中检出钉螺,分别是25、50和400只/m2剂量组。尤其是400只/m2剂量水平下检出螺卵和孵化出幼螺较多,因此认为,投入25只/m2钉螺是检出活性螺卵的下限,但较稳定检出钉螺螺卵或活性钉螺的检出限可能是400只/m2的投螺量的实验池,提示设置更高剂量组可能出现更好的阳性结果。出现此种现象,可能与泥土中活性螺卵在自然状态下是一种非连续性分布,其检出效率受到土壤中钉螺量和雌螺产卵量的综合限制等有关。
通过检出有阳性螺卵或孵化出活性钉螺方法的Kruskal?Wallis H检验和一致性检验,4种方法检出效果无差异。由于目前泥土中活性螺卵检出或孵化实验尚无统一标准,因此4种方法缺少标准方法对照,检验各具优缺点。
| [1] | 江西均,王克泰,金仿贤,等. 上海市郊区河道钉螺分布及其生态环境调查[J]. 中国寄生虫病防治杂志,2003,15(6):456-458. |
| [2] | 张小萍,蔡黎,王龙英,等. 上海市外来流动人员血吸虫病调查[J]. 中国血吸虫病防治杂志,2006,18(1):48-51. |
| [3] | 周晓农,蔡黎,张小萍,等. 上海市流动人口对血吸虫病传播的潜在危险性研究[J]. 中国寄生虫学与寄生虫病杂志,2007,25(3):180-184. |
| [4] | 田建国,仲文江,黎桂福,等. 水网地区模拟输入性钉螺生存繁殖情况初步观察[J]. 中国血吸虫病防治杂志,2011,23(2):205. |
| [5] | 田建国,张小萍,洪国宝,等. 高温季节泥土中螺卵孵化结果分析[J]. 中国公共卫生,2011,27(5):612. |
| [6] | 田建国,仲文江,黎桂福,等. 上海市青浦区钉螺再生性研究[J]. 中国媒介生物学及控制杂志,2011,22(2):162-164. |
| [7] | 中华人民共和国卫生部. 血吸虫病防治手册[M]. 3版. 上海:上海科学技术出版社,2000:40. |
| [8] | 周晓农,张仪,洪青标,等. 实用钉螺学[M]. 北京:科学出版社,2005:82-87. |
| [9] | 孙振球. 医学统计学[M]. 3版. 北京:人民卫生出版社,2011:101. |
| [10] | 夏邦世,吴金华. Kappa一致性检验在检验医学研究中的应用[J]. 中华检验学杂志,2006,29(1):83-84. |
| [11] | 王学东,陈新峰,吴锋,等. 长江河口段苏南江滩水土对钉螺生存繁殖影响的研究[J]. 卫生研究,2011,49(36):113. |
| [12] | 王学东,陈新峰,吴锋,等. 钉螺在苏南血吸虫病非流行区的生存繁殖与易感性研究[J]. 中国血吸虫病防治杂志,2010,22(2):184. |
| [13] | 田建国,黎桂福,李俊,等. 上海市青浦区人工输入性钉螺生存模拟实验[J]. 中国血吸虫病防治杂志,2013,25(3):323. |
 2014, Vol. 25
2014, Vol. 25