扩展功能
文章信息
- 宋尔萍, 谈其干, 管怀斌, 宋雪松, 宋尔勇, 吴晓晨, 袁良, 王玉娇, 倪兴, 倪洋洋, 张亮亮, 武松
- SONG Er-ping, TAN Qi-gan, GUAN Huai-bin, SONG Xue-song, SONG Er-yong, WU Xiao-chen, YUAN Liang, WANG Yu-jiao, NI Xing, NI Yang-yang, ZHANG Liang-liang, WU Song
- 中华按蚊溴氰菊酯处理后存活与死亡群体击倒抗性突变型差异比较
- Comparison of knockdown resistance mutations between survival and death populations of Anopheles sinensis after deltamethrin resistance test
- 中国媒介生物学及控制杂志, 2014, 25(6): 527-529
- Chin J Vector Biol & Control, 2014, 25(6): 527-529
- 10.11853/j.issn.1003.4692.2014.06.011
-
文章历史
- 收稿日期:2014-06-12
2 安徽中医药大学, 合肥 230038
2 Anhui University of Chinese Medicine, Hefei 230038, Anhui Province, China
疟疾是世界上危害严重的虫媒传染病,是发病率和死亡率最高的疾病之一[1]。媒介控制是疟疾防治的重要手段。中华按蚊(Anopheles sinensis)为我国广大平原地区的主要传疟媒介,近年已有文献报道该蚊对拟除虫菊酯类杀虫剂产生抗性[2, 3, 4, 5],笔者在安徽省研究发现,中华按蚊对拟除虫菊酯已经产生抗性,并且该蚊钠离子通道蛋白S5-S6发生L/F和L/C两种突变类型,然而两种突变类型对蚊虫及拟除虫菊酯类杀虫剂的抗性影响目前尚无相关研究。我们对2011及2012年安徽省合肥市3县中华按蚊抗性测试后保留的蚊虫标本进行分子扩增,对测试后存活与死亡中华按蚊的基因型进行了比较,结果报道如下。 1 材料与方法 1.1 蚊虫来源
受试中华按蚊来自2011年和2012年合肥市中华按蚊抗性测试保存标本[6, 7],2011年调查点为合肥市下辖肥西县高店乡五四村(31°51′23.78″ N,116°51′17.99″E)、长丰县俞岗村(32°29′29.26″N,117°5′25.09″E)和肥东县梁园镇管湾陈小郢(32°1′26.11″N,117°32′54.59″E),其中存活中华按蚊标本251只,死亡中华按蚊标本62只;2012年调查点为合肥市肥东县回满族自治乡赵坊村(31°55′57.5″N,117°27′46.9″E)、店埠镇双桥村袁岗组(31°52′6.7″N,117°29′53.6″E)和肥东县梁园镇管湾陈小郢,其中存活中华按蚊标本259只,死亡标本56只。受试蚊虫为溴氰菊酯抗性测试后存活与死亡分开冻存的干燥标本,随机选取其中测试后存活及死亡标本各80份进行PCR扩增。 1.2 主要仪器和试剂
PCR 扩增仪(PTC-200型)购自美国Bio?Rad公司,凝胶成像系统(Alpha Imager HP/EP)购自美国AlphaInnotech 公司,电泳仪(DYY-2C 型)购自北京六一仪器厂。DNA 聚合酶和脱氧核苷三磷酸(dNTPs)购自上海赛百盛基因技术有限公司,RNA 酶和蛋白酶K购自上海鼎国生物技术有限公司。 1.3 分子实验方法 1.3.1 基因组模板制备
单只成蚊加入120 μl 65 ℃裂解液〔含0.025 mol/L 乙二胺四乙酸钠(EDTA)、0.2 mol/L氯化钠(NaCl)、10 mmol/L Tris?HCl(pH 8.0)、1%十二烷基磺酸钠(SDS)〕和1.5 μl RNAse酶(10 μg/μl),充分研磨,37 ℃水浴1 h。加入3 μl 蛋白酶K(20 μg/μl),50 ℃水浴1 h。加入苯酚和氯仿各60 μl,充分振荡混匀,13 000×g离心10 min,收集上清液。加入95%冰乙醇300 μl,-20 ℃沉淀过夜,13 000×g离心10 min,弃上清。37 ℃干燥,加入100 μl 1×TE(Tris/EDTA) 缓冲液,-20 ℃保存。 1.3.2 钠离子通道基因扩增
根据GenBank按蚊钠离子通道基因序列,自行设计1对引物KdrF1(5′- GTT TTC TTC ATT TAC TCC TGC-3′)和KdrR2(5′-ATT TTA TTC GTC TCG TTA TCC-3′)。PCR反应体系为50 μl: 5.0 μl 10×PCR 缓冲液、25 mmol/L MgCl2 4 μl,10 mmol/L dNTPs 1.0 μl、正向引物与反向引物各0.8 μl(20 mmol/L)、red Taq聚合酶1 μl(1 U/μl)、DNA模板1.5 μl,加水补至50 μl。PCR反应条件:94 ℃ 5 min,55 ℃ 90 s,72 ℃ 90 s,94 ℃ 1 min,最后一个循环结束后72 ℃温育10 min。 1.3.3 统计学处理
测序与同源性比对采用测序试剂盒和全自动测序仪进行双向测序,由上海生工生物工程技术服务有限公司完成。测序结果采用Bioedit软件进行拼接,Mega软件作多序列比对图;采用Cluxtal、Chromas软件对基因序列进行核实和比对,并登录NCBI Blast(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行同源性比对。数据分析采用SPSS软件,两组间基因频率比较采用χ2检验。P<0.05为差异有统计学意义。 2 结 果
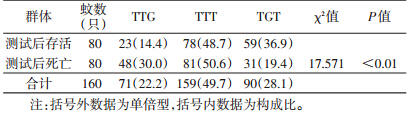
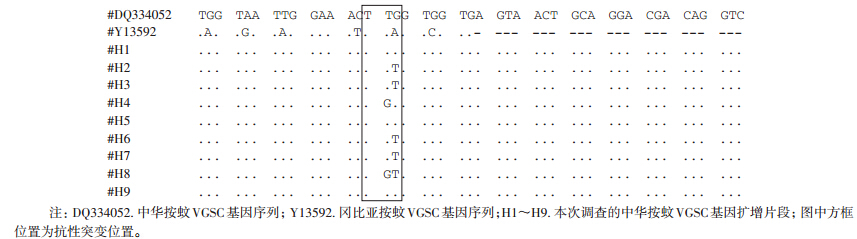
溴氰菊酯测试后生存与死亡群体kdr基因测序:提取溴氰菊酯抗性测试后存活的中华按蚊及死亡的中华按蚊基因组,进行钠离子通道蛋白基因(VGSC)扩增,并对产物进行测序,发现两种群体均存在2种突变类型,即由TTG向TTT及TGT突变(图 1)。对测序图进行比对发现存在4种突变组合(图 2)。对两种群体TTG、TTT及TGT 3种单倍型构成进行比较,差异有统计学意义(χ2=17.571,P<0.01)(表 1)。
|
| 图 1 钠离子通道蛋白基因部分序列单倍型 Figure 1 Haplotype of specific fragments of VGSC gene |

|
| 图 2 Kdr抗性突变位点测序图 Figure 2 Sequencing of kdr mutations |
中华按蚊是我国广大平原地区最主要的疟疾传播媒介,然而近年在全国范围内多地报道中华按蚊已对拟除虫菊酯类杀虫剂产生较为严重的抗性[2, 3, 4, 5, 6, 7]。化学防治是疟疾防制最重要的处理措施之一,蚊媒抗性的产生对我国实现疟疾消除将是严重的障碍。
击倒抗性(knockdown resistance,kdr)是昆虫对DDT和拟除虫菊酯类杀虫剂产生抗性的主要机制。kdr是指神经轴突钠离子通道(sodium channel,SC)延迟正常的电压依赖性失活机制导致SC的持续活化,而SC是DDT和拟除虫菊酯类杀虫剂的主要作用靶标,目前已经在抗除虫菊酯的斯氏按蚊(Anopheles stephensi)和冈比亚按蚊(An. gambiae)中发现钠离子通道S6节段发生L1014F和M918F型突变[8, 9]。同时在其他蚊虫中也曾发现L1014S、L1014H和L993F等突变[10]。不同蚊虫钠通道基因突变的位点和突变类型不完全相同,同种蚊虫可能存在单位点突变和多位点突变。
然而对于同一蚊虫为什么会发生几种以上的突变类型,各种不同突变类型对拟除虫菊酯类杀虫剂的抗性能力是否有差别至今尚无研究报道。笔者对2011及2012年安徽省合肥市溴氰菊酯抗性测试的中华按蚊存活与死亡群体进行钠离子通道蛋白基因扩增,并对两个群体中华按蚊的TTG、TTT及TGT基因单倍型进行比较,研究发现存活群体的TGT基因单倍型比例高于死亡群体(χ2=17.571,P<0.01),暗示TGT基因突变对中华按蚊的溴氰菊酯抗性能力可能要高于TTT突变。因调查仅限合肥地区,有待在中华按蚊分布的其他地区进行验证,如果确实存在这种关系,将有助于疾病控制工作者对现场中华按蚊的抗性情况进行判断。
| [1] | World Health Organization. World health report 2011[R]. Geneva:WHO,2011:1-2. |
| [2] | 周华云,李菊林,金小林,等. 江苏省传疟按蚊对菊酯类杀虫剂抗药性的监测[J]. 中国血吸虫病防治杂志,2004,16(3):199-201. |
| [3] | 沈宝祥,李菊林,周华云. 中华按蚊对常用菊酯类杀虫剂抗性现场调查[J]. 中国血吸虫病防治杂志,2002,14(2):148-149. |
| [4] | 潘波,朱泰华,刘勇鹰,等. 我国主要传疟媒介对杀虫剂的敏感性现状[J]. 中国媒介生物学及控制杂志,2001,12(2):145-148. |
| [5] | 曾林海,王善青,孙定炜,等. 海南省部分地区传疟媒介按蚊对4种常用杀虫剂的抗药性测定[J]. 中国寄生虫学与寄生虫病杂志,2011,29(3):200-203. |
| [6] | 武松,马尔健,陆群,等. 合肥市3县中华按蚊对溴氰菊酯抗性现状的研究[J]. 中国媒介生物学及控制杂志,2012,23(3):216-217. |
| [7] | 宋尔萍,谈其干,管怀斌,等. 安徽省肥东县中华按蚊对4 种常用杀虫剂抗性现状调查[J]. 国际医学寄生虫病杂志,2013,40(3):152-154. |
| [8] | Enayati AA,Vatandoost H,Ladonni H,et al. Molecular evidence for a kdr-like pyrethroid resistance mechanism in the malaria vector mosquito Anopheles stephensi[J]. Med Vet Entomol,2003,17:138-144. |
| [9] | Ranson H,Jensen B,Vulule J,et al. Identification of a point mutation in the voltage-gated sodium channel gene of Kenyan Anopheles gambiae associated with resistance to DDT and pyrethroid[J]. Insect Biochem Molec,2000,9(5):491-497. |
| [10] | Santolamazza F,Calzetta M, Etang J, et al. Distribution of knock down resistance mutations in Anopheles gambiae molecular forms in west and west-central Africa[J]. Malaria J,2008,29(7):74. |
 2014, Vol. 25
2014, Vol. 25