服务
文章信息
- 郭文宗,辛正,刘政明,王蕾,朱文刚,李殿香
- GUO Wen-zong, XIN Zheng, LIU Zheng-ming, WANG Lei, ZHU Wen-gang, LI Dian-xiang
- 96孔酶标板法检测家蝇血淋巴黑化反应的初步研究
- A preliminary study on melanization of hemolymph in Musca domestica by 96-well microplate assay
- 中国媒介生物学及控制杂志, 2014, 25(5): 388-392
- Chin J Vector Biol & Control, 2014, 25(5): 388-392
- 10.11853/j.issn.1003.4692.2014.05.002
-
文章历史
- 收稿日期:2014-04-24
2. 济南市疾病预防控制中心,济南250021;
3. 山东省医学科学院;
4. 济南大学-山东省医学科学院医学与生命科学学院
2 Jinan Center for Disease Control and Prevention, Jinan 250021, Shandong Province, China;
3 Shandong Academy of Medical Sciences;
4 School of Medicine and Life Science, Shandong Academy of Medical Sciences, University of Jinan
黑化反应是昆虫一种重要的先天性免疫防疫机 制[1,2],能够在感染或受伤的部位快速合成黑色素[3], 以便包裹病原物和促进伤口愈合,也参与昆虫卵壳褐 化、角皮硬化等多种反应[4,5]。黑化反应的关键是酚氧 化酶(phenoloxidase,PO)的激活,PO催化酚类物质氧 化为醌,醌被聚合生成黑色素[6]。在昆虫体内,PO一 般以非活化状态的酚氧化酶原(prophenoloxidase, proPO)形式储存在血细胞中,proPO一旦被激活便释 放到血淋巴,经限制性蛋白水解作用形成有活性的 PO,PO催化酚类形成不溶性的黑色素参与机体黑化 反应[7]。昆虫黑化反应的变化与昆虫血淋巴的PO活 性变化紧密相关。因此,探讨有效的昆虫血淋巴PO活 性检测方法,对了解昆虫的黑化反应机制有重要意义。
家蝇(Musca domestica)属于昆虫纲,双翅目,具有 独特而有效的免疫防御体系,酚氧化酶原系统 (prophenoloxidase-activating system,proPO 系统)是家 蝇重要的免疫组分,proPO系统激活直接引起家蝇的 黑化反应。目前,除少量的对lectins和PO生化性质的 研究报道[8,9],对家蝇proPO系统激活的黑化反应以及 其proPO系统关键基因的功能还缺乏研究。我们曾采 用分光光度计法对病原入侵引起的家蝇体内PO活性 变化进行检测[10],其检测结果虽然能够反映家蝇的黑 化反应变化,但是需要的反应液体积过大、家蝇样本 多、耗时长、灵敏度和重复性较差。为了进一步了解病 原在体外刺激对家蝇血淋巴PO活性变化的影响,本研 究探讨了简单、方便、灵敏的96孔酶标板法检测家蝇 血淋巴PO活性的可行性。 1 材料与方法 1.1 材料
家蝇,本实验室饲养。大肠埃希菌 (Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、藤黄微球菌(Micrococcus luteus),本实验 室-20 ℃保存。 1.2 仪器
SW-CJ-JCU 超净工作台,苏州安泰空气技 术有限公司产品;酶标仪为Thermo Multiskan型号。 1.3 方法 1.3.1 试剂准备
多巴(L-DOPA)为美国进口分装,其 他试剂为国产分析纯。配制pH 7.0 的任氏液 (Ringer):NaCl 110.5 mmol/L、KCl2 mmol/L、NaHCO3 2.4 mmol/L、NaH2PO4 0.083 mmol/L、EDTA 20 mmol/L。 配制pH 7.0的1×PBS缓冲溶液:KH2PO4 1.76 mmol/L、 Na2HPO4 10.14 mmol/L、KCl 2.7 mmol/L、NaCl 140 mmol/L。20 mmol/L多巴溶液现用现配,与25 μg/μl 的抗生素(氨苄西林)都是抽滤除菌。170 mmol/L CaCl2、 1×PBS、Ringer液以及0.8%生理盐水均高压灭菌。 1.3.2 菌液准备
在超净工作台上用接种环取少量菌 液接种到5 ml 液体LB中,37 ℃水浴200 r/min振荡培 养12 h。4200×g 离心5 min,收集菌体,用计数器在显 微镜下计数,用LB调菌浓度为1.84×109 cfu/ml,混菌 1∶1混合,4 ℃保存。 1.3.3 家蝇3龄幼虫血淋巴的提取
挑取正常的3龄 幼虫,置于培养皿中,用0.8%生理盐水清洗2次,然后 取出幼虫,置于吸水纸上,吸净幼虫表面的生理盐水, 再移幼虫至倒扣在冰块上的培养皿上,剪去幼虫头端, 用移液枪在剪口处吸取幼虫的血淋巴置于预冷的 Ringer液中混匀,抽滤除菌,冰上放置待用。 1.3.4 样品与反应液准备
按表 1准备待检测的样 品:先吸取家蝇3龄幼虫的血淋巴到预冷的Ringer液, 再迅速加入菌液。每种样品有3个重复和1个空白对 照(其中的血淋巴用Ringer液替代)。样品液体积为 150 μl。待检测样品包括3种含不同菌量的实验样品 和1种不加菌的正常对照样品。
反应液准备:180 μl的体系,包括待检测的样品 30 μl、1×PBS 90 μl、170 mmol/L CaCl2 30 μl、20 mmol/L 多巴溶液30 μl(检测时现加)。 1.3.5 酶标仪检测反应液的A630和A490
先把不含多巴 溶液的反应液混匀,放入96孔酶标板中,再将96孔酶 标板放回酶标仪中,让其在酶标仪中30 ℃振荡孵育 10 min,然后向反应液中加30 μl多巴溶液,在同样条 件下继续反应,读取反应时间内待测溶液的A630和A490 值,每隔5 min重复检测1次。酶标仪设定程序:30 ℃ 孵育→检测A630→检测A490→振荡5 min重复检测。最 后,以反应时间为横坐标,以记录的每个样品3次重复 与空白的A 差值的平均数作纵坐标,绘制家蝇血淋巴 的A值随反应时间的变化曲线。 2 结果 2.1 混菌刺激对家蝇血淋巴黑化反应影响的检测
对加E. coli 和S. aureus 混菌不同量的3种样品和不加 E. coli 和S. aureus 混菌的正常样品用酶标仪进行检测, 记录样品在60 min内的A630和A490值,根据这些数据做 它们的变化曲线(图 1)。
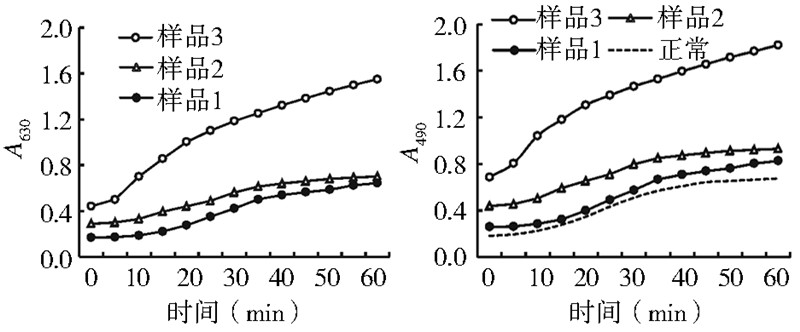
|
| 图 1 家蝇血淋巴的A630和A490随E. coli和S. aureus混合菌体外 刺激不同时间的变化曲线 Figure 1 The changes in A630 and A490 with stimulation time in housefly hemolymph challenged by the mixture of E. coli and S. aureus in vitro |
样品1~3含有E. coli 和S. aureus 混菌的起始个数 分别为2.76×107、8.28×107和1.38×108 cfu,正常为不 加E. coli和S. aureus混菌的对照。
相比正常的起始A630 值,样品1~3 的A630 值为 0.17~0.44,含菌量越多的样品,其A630值也越大。在随 后的60 min反应时间内,所有检测品的A630值都随反应 时间的延长而不断增加,与起始A630值相比,60 min样 品1~3的A630值依次增加了3.80、2.40和3.50倍。样品 含菌量越多,其A630值越大,形成了从上到下类似平行 排列的随反应时间不断上升的3条曲线,含菌量越多 的样品曲线越靠上,最下面的是样品1的曲线。说明 样品1~3随反应时间延长,其中的细菌数不断增加, A630值越来越大。
样品1~3的A490值增加的趋势与其A630值增加的 趋势基本一致。就单一检测点来看,相比正常的A490 值,样品1~3中添加了E. coli 和S. aureus 混菌,其A490 值增加明显,加菌量越多,其A490值增加的也越多。检 测的起始数据显示:相比正常的A490 值,样品1~3的 A490值分别增加了1.40、2.40和3.80倍。另外,在检测 的60 min内,所有样品的A490值均随反应时间延长而增 长,相比它们各自起始的A490 值,60 min样品1~3 的 A490值增加的倍数依次为3.20、2.10和2.70倍。说明起 始样品中加入E. coli 和S. aureus 混菌的量越多,样品 起始A490值越大,同时,反应时间越长,样品的A490值也 不断增加,引起样品的PO活性增高,产生的黑色素增 多,引起的黑化反应越强。
显然,家蝇血淋巴受体外刺激的E. coli和S. aureus 混菌浓度越大、时间越长,其PO活性提高越快,导致的 黑化反应越强。 2.2 单菌刺激对家蝇血淋巴黑化反应影响的检测
按表 1准备了分别加E. coli、S. aureus 和M. luteus 3种 单菌的样品,利用与检测混菌刺激对家蝇血淋巴黑化 反应影响的同样方法,用酶标仪记录不同菌量和不同 类型的单菌体外刺激家蝇血淋巴的A630和A490值,并依 此制作相应的曲线图。样品1~3含有单菌的起始数 分别为2.76×107、8.28×107和1.38×108 cfu,正常为无 菌对照,抗生素为加氨苄西林的对照。 2.2.1 E. coli刺激对家蝇血淋巴黑化反应的影响
图 2 是酶标仪记录的样品在90 min反应时间内家蝇血淋巴 的A630 值与A490 值随不同量E. coli 体外刺激的变化曲 线。加E. coli 样品1~3的A630曲线起点比较集中,其 A490曲线的起点也相对集中,正常与加氨苄西林的曲线 起点相同,说明反应初期,1~3样品中的E. coli 菌数 差别不大,几乎检测不到黑化反应的差别。检测样品 的起始A490数据也证实了这点:相比正常的A490值,样品 1~3的A490值分别增加了1.33、1.36和1.38倍,E. coli菌 量越多的样品其A490、A630值也越大,其增幅明显低于与 E. coli 和S. aureus 混菌刺激的效果。在90 min反应时 间内,无菌正常对照的A490值几乎不变,而加E. coli 的 样品1~3的A490、A630值均随反应时间延长明显增加, 而且A490 值与A630 值增加趋势一致。相比E. coli 和 S. aureus 混菌刺激,E. coli单菌刺激的样品A490、A630值增 幅在60 min时更大,与对照的差别更明显,推测E. coli 单菌刺激的效果应在反应后期。显然,随反应时间延 长,样品1~3中的E. coli 量越来越多,引起样品中的 PO活性越来越高,产生的黑色素越来越多,样品的黑 化反应越来越强;加氨苄西林对照中的E. coli 被杀死, 检测到的样品A490值恒定,其PO活性几乎不变,产生的 黑色素一直未增加;正常对照随反应时间延长,其血淋 巴中的血细胞可能破裂,少量的proPO蛋白会被激活 使PO活性略有提高,检测到A490值有少许增加。因此, E. coli体外刺激较长时间后能明显引起家蝇血淋巴PO 活性的提高。
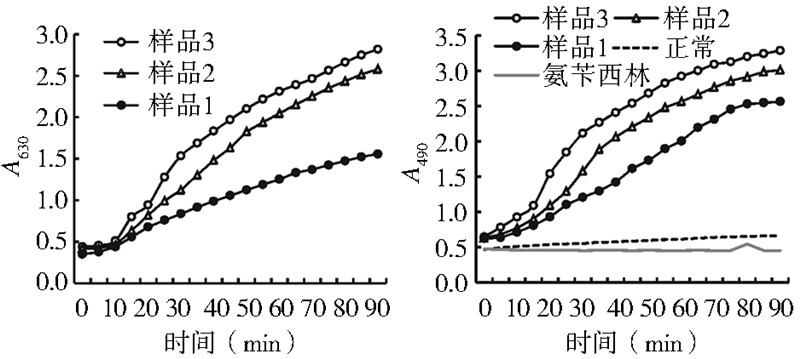
|
| 图 2 家蝇血淋巴的A630和A490随E. coli单菌体外刺激 不同时间的变化曲线 Figure 2 The changes in A630 and A490 with stimulation time in housefly hemolymph challenged by E. coli in vitro |
用酶标仪记录按表 1加不同量S. aureus的样品在90 min 内的A630和A490值,样品中的血淋巴没有抽滤除菌(图 3)。
图 3显示,样品1~3含有的起始S. aureus 菌量依 次增加,其起始A630值有明显不同,随反应时间延长,它 们的A630值也在不断增加,说明其中的菌不断增殖,但 是速度比图 2中的E. coli 要慢。同样,也比较了样品 1~3 的起始A490 值与正常的A490 值的比值,结果为 1.30~2.40倍,增幅略高于E. coli,但明显低于E. coli和 S. aureus混菌的增幅;在90 min内,正常样品起初少量 的菌也在增殖,但量低于加S. aureus 的样品1~3,引起 的PO活性略有提高,其A490值略有上升,幅度小于加 S. aureus 的样品1~3;加氨苄西林的抗生素样品A490值 略有下降,说明其中起始较高量的菌被氨苄西林抑杀, 使PO活性变低,引起A490值略有下降;样品1~3的A490 值增加趋势与其A630值相似。说明反应液中S. aureus浓 度越大,引起同量血淋巴的PO活性越高,产生的黑化反 应越强。

|
| 图 3 家蝇血淋巴的A630和A490随S. aureus单菌体外刺激 不同时间的变化曲线 Figure 3 The changes in A630 and A490 with stimulation time in housefly hemolymph challenged by S. aureus in vitro |
用酶标仪记录按表 1 加不同量M. luteus 的反应液在 90 min内的A630和A490值,根据这些数据做曲线图(图 4)。 样品中的血淋巴未抽滤除菌。
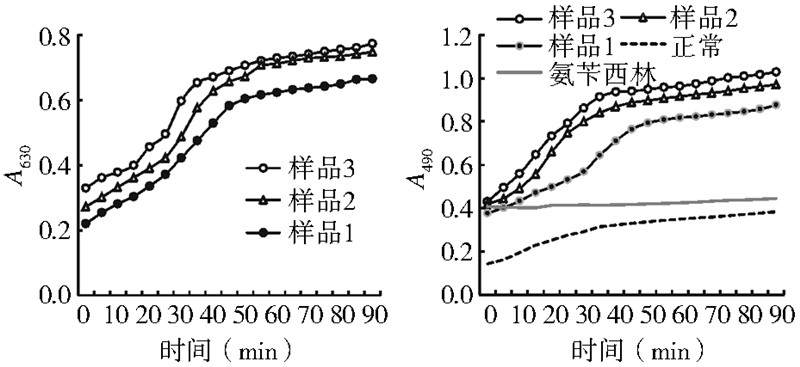
|
| 图 4 家蝇血淋巴的A630和A490随M. luteus单菌体外刺激 不同时间的变化曲线 Figure 4 The changes in A630 and A490 with stimulation time in housefly hemolymph challenged by M. luteus in vitro |
样品1~3含有的M. luteus 浓度同前,也是依次增 加。在90 min内,测得的A630值与A490值也依次增加,增 加幅度比含S. aureus 的相同样品要高,比含E. coli 的 相同样品要低,但是,其起始A490值与正常A490值的比值 最大,分别为2.60、2.80和3.00倍,该数据在单菌刺激 中是最大的,其3 号样品的比值(3.00 倍)略低于E. coli 和S. aureus 混菌(3.80倍)。正常样品起初有少量 的菌,但未加S. aureus,其PO活性随反应时间略有提 高,A490值略有上升,幅度小于加S. aureus 的样品1~3; 加氨苄西林的抗生素样品起初含有的S. aureus 菌量与 样品2相当,但被氨苄西林有效抑杀后,样品的PO活 性基本不变,A490 值保持恒定。显然,反应液中起始 M. luteus 浓度越大,引起同量血淋巴的黑化反应越强, 其作用强度比S. aureus 与E. coli 强,略弱于E. coli 和 S. aureus混菌。 3 讨论
黑化反应是家蝇重要的先天性免疫防御机制,当 外源性物质入侵时,家蝇体内的proPO系统被激活,使 proPO形成PO,引起黑色素和毒性物质生成,抵御入侵 物[10]。本研究发现,在体外,免疫刺激物不同,引起的 家蝇幼虫血淋巴的黑化反应不同。
当用E. coli、M. luteus、S. aureus 单菌或E. coli 与 S. aureus 混菌体外刺激家蝇3龄幼虫的血淋巴时,96 孔酶标板法能够检测到菌刺血淋巴的PO活性快速提 高。在90 min的检测时间内,随时间延长,无菌刺的正 常家蝇血淋巴A490缓慢增加,而菌刺样品的A490快速增 加,增加的幅度与刺激菌的浓度成正比,加抗生素的样 品A490基本不变。从而证明:在体外,家蝇血淋巴受菌 刺激会促进其中的proPO激活产生大量的PO;没有病 原刺激,正常血淋巴中的proPO也会有少许被激活产 生少量的PO。PO催化反应液中的多巴生成黑色素而 使样品的A490增加。
另外,在一定的反应时间内,合适的菌浓度范围 (1.38×107~1.38×108 cfu)下,体外刺激菌的浓度越 大,对血淋巴中proPO的激活作用越强,导致的黑化作 用越明显。从4种菌刺的检测曲线来看,使用除菌血 淋巴检测菌刺效果更明显,E. coli 和S. aureus 混菌刺激 引起家蝇血淋巴A490的变化与单菌刺激的类似。从检 测到的4种菌刺样品起始A490值与正常的A490值比率来 看,3 种单菌刺激的效果是M. luteus>S. aureus> E. coli,而E. coli 和S. aureus 混菌刺激的效果要比单菌 刺激的效果好,而且,刺激菌的浓度越大,引起家蝇血 淋巴的黑化反应越明显。
王秀华等[11]曾探讨96孔酶标板法检测对虾血淋 巴过氧化物酶活性的优势,那些优势在本研究中也体 现得更为充分。①节约试剂。以前检测家蝇的黑化反 应用分光光度计法,反应液要3 ml,是96孔酶标板法 180 μl反应液的17倍,分光光度计法检测1个样品用 的血淋巴量为20 μl,若重复检测3次就需要至少60 μl 的血淋巴,是96孔酶标板法使用血淋巴量的7倍。② 简单快速。分光光度计法每次只能检测1个样品,而 96孔酶标板法1次可以同时检测多个样品。③稳定灵 敏。分光光度计法每次检测需要人工调试,获得的重 复数据间误差较大,96孔酶标板法只需将每个样品定 容,完全自动检测,数据稳定。总之,96孔酶标板法比 分光光度计法用于检测家蝇血淋巴的黑化反应更加方 便快捷。
| [1] | Cerenius L,Lee BL,Soderhall K. The proPO-system:pros andcons for its role in invertebrate immunity[J]. Trends Immunol,2008,29:263-271. |
| [2] | Tang H. Regulation and function of the melanization reaction inDrosophila[J]. Fly(Austin),2009,3(1):105-111. |
| [3] | Binggeli O,Neyen C,Poidevin M,et al. Prophenoloxidase activationis required for survival to microbial infections in Drosophila[J].PLoS Pathog,2014,10(5):e1004067. |
| [4] | An C,Zhang M,Chu Y,et al. Serine protease MP2 activatesprophenoloxidase in the melanization immune response ofDrosophila melanogaster[J]. PLoS One,2013,8(11):e79533. |
| [5] | Nappi A,Poirie M,Carton Y. The role of melanization and cytotoxicby-products in the cellular immune responses of Drosophila againstparasitic wasps[J]. Adv Parasitol,2009,70:99-121. |
| [6] | Cerenius L,Kawabata S,Lee BL,et al. Proteolytic cascades andtheir involvement in invertebrate immunity[J]. Trends Biochem Sci,2010,35(10):575-583. |
| [7] | Chen K,Liu C,He Y,et al. A short-type peptidoglycan recognitionprotein from the silkworm: expression, characterization andinvolvement in the prophenoloxidase activation pathway[J]. DevComp Immunol,2014,45(1):1-9. |
| [8] | Cao X,Zhou M,Wang C,et al. Musca domestica pupae Lectinimproves the immunomodulatory activity of macrophages byactivating nuclear factor-κ B[J]. J Med Food,2012,15(2):145-151. |
| [9] | Sun SG,Liu WG,Wang JG,et al. Endonuclease activity of phenoloxidase from Musca domestica larvae[J]. Biol Bull,2008,215(1):108-114. |
| [10] | 李殿香,刘晖,王军,等. 家蝇对病原入侵黑化反应的研究[J]. 中华卫生杀虫药械,2013,19(3):193-196. |
| [11] | 王秀华,雷质文,黄倢,等. 96孔酶标板法测定对虾血淋巴的过氧化物酶相对活性的初步研究[J]. 海洋科学,2001,25(11):55-58. |
 2014, Vol. 25
2014, Vol. 25



