扩展功能
文章信息
- 唐继霞, 何贤海, 吴胜春, 孟娇, 陈醒醒, 陈秋, 林祉君, 代义松, 吴家红, 江佳富, 孙毅, 曹务春, 余福勋, 詹琳
- TANG Ji-xia, HE Xian-hai, WU Sheng-chun, MENG Jiao, CHEN Xing-xing, CHEN Qiu, LIN Zhi-jun, DAI Yi-song, WU Jia-hong, JIANG Jia-fu, SUN Yi, CAO Wu-chun, YU Fu-xun, ZHAN Lin
- 贵州省印江土家族苗族自治县微小扇头蜱携带RNA病毒分析
- RNA viruses carried by Rhipicephalus microplus in Yinjiang Tujia and Miao Autonomous County, Guizhou Province, China
- 中国媒介生物学及控制杂志, 2024, 35(5): 621-626
- Chin J Vector Biol & Control, 2024, 35(5): 621-626
- 10.11853/j.issn.1003.8280.2024.05.019
-
文章历史
- 收稿日期: 2024-03-25
2 德江县农业农村局动物疫病预防控制中心, 贵州 铜仁 565299;
3 贵州省人民医院, 国家卫生健康委肺脏免疫性疾病诊治重点实验室, 贵州 贵阳 550002;
4 遵义医科大学公共卫生学院, 贵州 遵义 563006;
5 贵州大学医学院, 贵州 贵阳 550025;
6 军事科学院军事医学研究院, 北京 100001
2 Dejiang County Agriculture and Rural Affairs Bureau Animal Disease Prevention and Control Center, Tongren, Guizhou 565299, China;
3 NHC Key Laboratory of Pulmonary Immune-related Diseases, Guizhou Provincial People's Hospital, Guiyang, Guizhou 550002, China;
4 School of Public Health, Zunyi Medical University, Zunyi, Guizhou 563006, China;
5 Medical School of Guizhou University, Guiyang, Guizhou 550025, China;
6 Academy of Military Medicine, Academy of Military Sciences, Beijing 100001, China
蜱是危害人类健康的重要吸血节肢动物,宿主包括陆生哺乳类、鸟类、爬行类和两栖类等脊椎动物,通过吸食动物血液完成发育,是仅次于蚊的第二大病原体传播媒介[1]。近10年来,蜱传疾病对公共卫生构成重要的威胁,其中病毒是引起严重蜱传疾病的重要病原体类别,蜱媒病毒(tick-borne viruses)在媒介蜱和脊椎动物宿主之间感染和传播,引起人兽共患病[2]。重要的人兽共患蜱媒病毒包括蜱传脑炎病毒(Tick-borne encephalitis virus)[3]、克里米亚-刚果出血热病毒(Crimean-Congo hemorrhagic fever virus)[4]、大别班达病毒(Dabie bandavirus)[5]以及新发的荆门蜱病毒(Jingmen tick virus)、阿龙山病毒(Alongshan virus)和哈特兰病毒(Heartland virus)等[6]。
传统的病毒检测方法包括病原体的分离和鉴定、聚合酶链式反应(polymerase chain reaction,PCR)和实时荧光定量PCR(real-time quantitative PCR,qPCR)等,这些方法通常只针对1种已知病原体,不能检测未知病原体[7]。而宏转录组和宏基因组学[8]的出现推动了人们对蜱携带的已知或未知病毒的研究[9]。目前,研究人员已在我国东北地区[10]、中西部地区[11]和中朝边境地区[12]开展了蜱病毒组的相关分析研究,但尚不能全面覆盖不同地域蜱病毒组的特点。
贵州省是蜱媒疾病的重要自然疫源地[13]。李洁等[14]2017-2019年在贵州省发现蜱携带MIV-2病毒,阳性率为9.52%,且MIV-2可感染多个蜱种。2019年在贵州省毕节市的微小扇头蜱(Rhipicephalus microplus)和长角血蜱(Haemaphysalis longicornis)中发现大别山病毒(Dabieshan tick virus),感染率为3.28%[15]。2021年遵义市采集的微小扇头蜱中发现荆门蜱病毒,并且获得了全基因序列[16]。这些研究提示贵州省蜱传病毒的多样性,可能仍有更多的未知蜱媒病毒待进一步发现和研究。掌握蜱媒病毒多样性有利于蜱媒疾病的预防和控制。本研究从贵州省印江土家族苗族自治县(印江县)收集牛体表寄生蜱,运用病毒宏基因组学的方法发现蜱样本中病毒情况,分析重要的蜱传病毒白纤病毒科(Phenuiviridae)尤库病毒属(Uukuvirus)的遗传进化特征,为该地蜱媒疾病的预防控制措施提供针对性的重要科学数据。
1 材料与方法 1.1 蜱的采集2023年7月15日,对贵州省印江县中心街道中坝村和蔓庖村的散养牛进行牛体表寄生蜱的采集,分别在中坝村的5头牛和蔓庖村的1头牛体表共采集23只寄生蜱,放入15 ml的离心管内暂时保存。
1.2 蜱种的鉴定将采集的蜱置于洁净载玻片上,镜下观察蜱的形态特征,重点观察假头基、口器、盾板、生殖孔和尾突等结构,依据蜱形态学特征对蜱种进行初步鉴定及分类,再通过扩增蜱线粒体16S rDNA基因,鉴定蜱种,引物为16S+1(5'-CCGGTCTGAACTCAGATCAAGT-3')和16S-1(5'-CTGCTCAATGATTTTTTAAATTGCTGTGG-3'),扩增程序为95 ℃ 5 min;95 ℃30 s,51 ℃ 1 min,72 ℃ 1 min,30个循环;72 ℃ 5 min。
1.3 蜱总RNA提取首先使用75%乙醇溶液擦拭蜱表面2次,再用磷酸盐缓冲液(phosphate buffered saline,PBS)清洗3次,去除蜱表面的部分细菌及杂质,单只放于1.5 ml的无RNA酶离心管中,随后加入250 μl MagZol Reagent(Magen公司),立即用研磨杵进行充分匀浆,研磨结束后将20只蜱的研磨液混为1管,将混合蜱样本在组织匀浆后采用HiPure Universal RNA Mini Kit(Magen公司)试剂盒进行总RNA提取。
1.4 RNA文库的构建和测序提取后的总RNA使用Thermo NanoDrop One、Life Technologies Qubit 4.0和1%琼脂糖电泳进行质量检查,合格的RNA蜱样本使用Ribo-off rRNA Depletion Kit (Human/Mouse/Rat)(Vazyme公司)试剂盒去除蜱样本内的rRNA,后将剩余所有RNA使用ALFA-SEQ RNA Library Prep Kit(Findrop)进行文库的构建,包括反转录和双链的合成。构建的文库样本随后使用Qubit® dsDNA HS Assay Kit(赛默飞世尔科技公司)和Agilent 4200 TapeStation(安捷伦公司)进行质检,再采用Illumina NovaSeq 6000平台150 bp paired-end模式进行测序。
1.5 生物信息学分析高通量测序下机的原始数据通过Trimmomatic软件将低质量数据去除,得到高质量的质控数据,使用BWA软件(v 0.7.17,默认参数:mem-k30)将经过质量控制的数据与宿主牛和微小扇头蜱、核糖体(Silva.132)比对,过滤比对长度低于测序片段总长80%的比对结果,然后去除相应序列。
使用Megahit(v1.1.2,默认参数:-presets meta-large-min-contig-len 300)软件对去除污染后的质控数据进行组装,同时使用blast(v2.9.0+)软件把组装的重叠群序列与宿主序列比对,去除宿主序列。通过CheckV软件中封装的Prodigal包对组装的重叠群序列进行基因注释,同时通过序列比对等方法鉴定潜在的病毒序列。对筛选出鉴定到的RNA病毒序列,从门、纲、目、科、属、种不同的分类水平对病毒群落进行分类。登录美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)网站,将鉴定出的病毒基因序列同GenBank中注册的基因序列通过基于局部比对算法的搜索工具(BLAST)进行同源比对,同时从GenBank数据库中下载参考序列,用MEGA 7.0构建系统发育进化树,采用邻接法,自展检验1 000次,进一步确定蜱及其携带病毒的种类和进化关系。
2 结果 2.1 蜱种鉴定采集的23只蜱依据形态学特征初步鉴定均为微小扇头蜱,随机抽取3只蜱,通过扩增蜱线粒体16S rDNA基因,经测序比对后,证实均为微小扇头蜱(基因登录号:PP446796、PP446801、PP446805)。
2.2 病毒宏基因组测序和组装研究借助Illumina测序平台,直接对蜱样本进行高通量测序,将测序得到的数据进行病毒的筛查。本研究按照采样点构建了1个20只蜱的RNA测序文库,将蜱研磨后构建文库并测序,共获得14.3GB下机数据。对原始下机数据进行质量控制,去除低质量的数据,包括带接头的测序序列、PCR扩增产生的重复序列和单端测序片段中含有的低质量碱基数超过该条测序片段碱基总数的20%的序列。该文库经过质量控制获得21 708 942个序列,去除核糖体和宿主污染后再进行数据的组装得到216 738个重叠群序列,平均N50为675 bp。
2.3 病毒宏基因组分类学分析通过CheckV软件对组装后的重叠群序列进行基因注释,并筛选鉴定RNA病毒序列,对不同分类水平的RNA病毒重叠群序列数进行统计,在印江县的蜱中,从门水平分析,共注释到2个门的病毒,分别是Negarnaviricota和Duplornaviricota;从纲水平分析,共注释到3个纲的病毒,分别是Chrymotiviricetes、Ellioviricetes和Monjiviricetes;从目水平分析,共注释到4个目的病毒,其中荆楚病毒目丰度最高;从科水平分析,至少携带4个科的病毒,包括的基因组类型有dsRNA和ssRNA,丰度最高的是楚病毒科(Chuviridae),其次是白纤病毒科和弹状病毒科(Rhabdoviridae),丰度较低的是分体病毒科(Totiviridae)。从属水平分析,在楚病毒科中发现Mivirus属,白纤病毒科中发现白蛉病毒属(Phlebovirus)和尤库病毒属。研究获得的弹状病毒和楚病毒基因序列,经BLAST同源比对发现,弹状病毒序列与在长角血蜱中发现的序列(基因登录号:MZ244313)同源性最高,序列一致性为98.18%;与云南省微小扇头蜱中发现的弹状病毒(基因登录号:ON812510)同源性为98.13%;与2017年在四川省微小扇头蜱中发现的弹状病毒(基因登录号:ON812505)同源性为97.50%。楚病毒序列与2017年在四川省微小扇头蜱中发现的武汉Mivirus分离株TIGMIC-21(基因登录号:OP628592)同源性最高,序列一致性为99.17%;其次是四川省武汉Mivirus分离株TIGMIC-19(基因登录号:OP628590),一致性为99.14%。
2.4 Lihan蜱病毒的系统发育分析测序文库中,注释到的白纤病毒科尤库病毒属的Lihan蜱病毒核酸长度为5 008 bp。将该病毒的基因序列同GenBank中注册的基因序列进行BLAST同源比对,与2019年在重庆市微小扇头蜱中发现的Lihan蜱病毒TIGMIC-5分离株序列(基因登录号:ON812189)同源性最高,序列一致性是98.20%。同时从GenBank数据库中下载参考序列,以潜在对人致病的古尔图病毒序列(基因登录号:MH688509)和牡丹江白蛉病毒序列(基因登录号:OR148750)为外群构建进化树。本研究通过病毒宏基因组测序获得的尤库病毒属Lihan蜱病毒序列(基因登录号:PP386538)与云南省Lihan病毒分离株TIGMIC-60(基因登录号:ON812433)和TIGMIC-59(基因登录号:ON812432)属于同一分支,亲缘关系最近;与湖南省微小扇头蜱中的分离株TIGMIC-1(基因登录号:ON812170)互为姐妹分支,亲缘关系较近;与2011年获得的中国大别班达病毒(基因登录号:JQ733567)、波兰塔城蜱病毒2(Tacheng tick virus 2)(基因登录号:OR327613)、美国密苏里州哈特兰病毒(基因登录号:JX005847)、埃及发现的裂谷热病毒(Rift Valley fever virus)(基因登录号:DQ375403)等已知对人致病的病毒不在同一分支,基因序列遗传关系较远。见图 1。
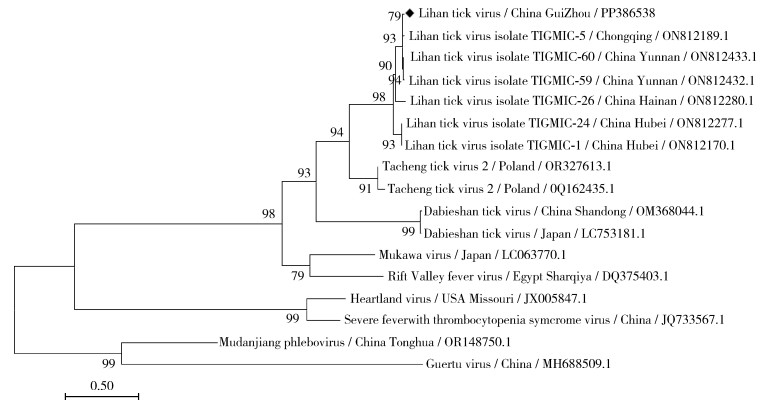
|
| 注:◆本研究检测序列。 图 1 贵州省印江县基于蜱携带的5 008 bp Lihan病毒序列的系统发育分析 Figure 1 Phylogenetic tree based on the 5 008-bp Lihan virus sequence from ticks in Yinjiang County, Guizhou Province |
| |
印江县植被丰富,具备良好的生态环境和气候优势,适宜蜱的生长和繁殖。新型蜱媒病毒的发现扩大了蜱媒病毒谱的多样性[17]。微小扇头蜱是贵州省的优势蜱种[18],本次采用病毒宏基因组测序技术对印江县的微小扇头蜱携带病毒进行调查,初步了解该地区蜱媒病毒存在情况。
根据最新的分类标准,蜱传病毒包括5个病毒目,18个病毒科[19],病毒数量排名前5位的病毒家族为内罗病毒科(Nairoviridae)、黄病毒科(Flaviviridae)、细小病毒科(Parvoviridae)、白纤病毒科和弹状病毒科[20]。经蜱传播的病毒多数为白纤病毒科的白蛉病毒属和尤库病毒属病毒[21]。白蛉病毒和尤库病毒可通过蜱叮咬传播给人和动物,导致肾综合征出血热等严重疾病[22]。人感染白蛉病毒属的大别班达病毒可导致发热性疾病,造成多器官损害,严重可导致出血甚至死亡[23]。人感染尤库病毒属的塔城蜱病毒2可导致患者出现头痛、发热和皮疹等症状[24]。Lihan蜱病毒属于尤库病毒属的一种病毒,于2015年首次在中国报道[9]。本研究通过病毒宏基因组测序在微小扇头蜱中获得了Lihan蜱病毒序列,该序列与2019年重庆市和云南省的微小扇头蜱中检出的Lihan蜱病毒核酸序列一致性在95.00%以上。在湖北、福建、广东、云南、重庆、四川等省(直辖市)的微小扇头蜱中均发现了Lihan蜱病毒[25-27],提示微小扇头蜱可能是Lihan蜱病毒的重要媒介。目前,Lihan蜱病毒是一种致病性未知的病毒,国内外未见感染人和动物的相关报道。但有研究显示,Lihan蜱病毒序列与2009年在湖北首次发现的白蛉病毒属中的大别班达病毒序列同源性为30.00%~35.00%[28],而本研究发现的Lihan蜱病毒序列与大别班达病毒的参考序列同源性为37.00%~54.00%,提示这2种病毒之间可能存在更多的相似性,也可能会具有相似的生物学特征和致病性。虽然至今未发现Lihan蜱病毒感染人,但病毒本身属于单链RNA,结构不稳定,易突变,此病毒是否有可能突变成可感染人的病毒有待研究。
从印江县牛体表寄生蜱中获得的弹状病毒和楚病毒序列,经过BLAST同源比对发现,本研究所获弹状病毒序列与2019年在云南省微小扇头蜱中检出的弹状病毒序列一致性为98.13%,与2015年首次在中国发现的弹状病毒同源性为98.05%。弹状病毒可感染脊椎动物、无脊椎动物和植物等[29]。楚病毒于2015年首次通过宏基因组学和元转录组学技术被发现,其基因组结构包括环形、无节段和双节段结构[11]。近年来,我国河南、湖南、甘肃、青海、四川、新疆等省(自治区)均检出楚病毒,其宿主有微小扇头蜱、长角血蜱、血红扇头蜱(R. sanguineus)、亚洲璃眼蜱(Hyalomma asiaticum)等[30]。本研究在印江县的微小扇头蜱中发现的楚病毒序列,与在四川省发现的武汉Mivirus同源性最高,其次是在新疆发现的Mivirus 1号。截至目前,尚无相关研究报道过蜱传楚病毒感染人类或动物,楚病毒在人类和动物中的传播性和致病性也尚未清楚,但该病毒在我国多个省份的蜱中均有检出,需进一步的研究来揭示该病毒的流行情况和致病性。
本研究也存在一定的局限性,如采样数量仅有23只、采样区域的局限以及宿主血液内病原体影响的局限性,今后需扩大样本量和采样区域进一步研究,来全面监测蜱媒病毒在不同宿主、不同蜱种和不同地区之间的分布情况。
本研究对贵州省印江县的微小扇头蜱病毒组进行初步检测,发现蜱中存在白纤病毒、弹状病毒和楚病毒,同时,首次在该地区蜱中检测到白纤病毒科中的致病性未知的Lihan蜱病毒。研究结果为贵州省蜱媒疾病的防控提供了数据参考。
志谢 贵州省人民医院中心实验室老师、师姐们对课题给予支持,印江县村民配合和协助采样,一并志谢利益冲突 无
| [1] |
Damian D, Maghembe R, Damas M, et al. Application of viral metagenomics for study of emerging and reemerging tick-borne viruses[J]. Vector Borne Zoonotic Dis, 2020, 20(8): 557-565. DOI:10.1089/vbz.2019.2579 |
| [2] |
Shi JM, Hu ZH, Deng F, et al. Tick-borne viruses[J]. Virol Sin, 2018, 33(1): 21-43. DOI:10.1007/s12250-018-0019-0 |
| [3] |
Johnson N, Migné CV, Gonzalez G. Tick-borne encephalitis[J]. Curr Opin Infect Dis, 2023, 36(3): 198-202. DOI:10.1097/QCO.0000000000000924 |
| [4] |
Hawman DW, Feldmann H. Crimean-Congo haemorrhagic fever virus[J]. Nat Rev Microbiol, 2023, 21(7): 463-477. DOI:10.1038/s41579-023-00871-9 |
| [5] |
Meng F, Ding MM, Tan ZZ, et al. Virome analysis of tick-borne viruses in Heilongjiang Province, China[J]. Ticks Tick Borne Dis, 2019, 10(2): 412-420. DOI:10.1016/j.ttbdis.2018.12.002 |
| [6] |
马静阁, 刘宁, 刘紫嫣, 等. 我国致病性蜱媒病毒流行现状[J]. 中国血吸虫病防治杂志, 2023, 35(4): 325-330, 348. Ma JG, Liu N, Liu ZY, et al. Epidemiology of pathogenic tick-borne viruses in China: A review[J]. Chin J Schistosom Control, 2023, 35(4): 325-330, 348. DOI:10.16250/j.32.1374.2023128 |
| [7] |
Růžek D, Yakimenko VV, Karan LS, et al. Omsk haemorrhagic fever[J]. Lancet, 2010, 376(9758): 2104-2113. DOI:10.1016/S0140-6736(10)61120-8 |
| [8] |
Xu L, Guo MJ, Hu B, et al. Tick virome diversity in Hubei Province, China, and the influence of host ecology[J]. Virus Evol, 2021, 7(2): veab089. DOI:10.1093/ve/veab089 |
| [9] |
Chandra S, Harvey E, Emery D, et al. Unbiased characterization of the microbiome and virome of questing ticks[J]. Front Microbiol, 2021, 12: 627327. DOI:10.3389/fmicb.2021.627327 |
| [10] |
Liu ZY, Li L, Xu WB, et al. Extensive diversity of RNA viruses in ticks revealed by metagenomics in northeastern China[J]. PLoS Negl Trop Dis, 2022, 16(12): e0011017. DOI:10.1371/journal.pntd.0011017 |
| [11] |
Yang ZJ, Wang H, Yang SX, et al. Virome diversity of ticks feeding on domestic mammals in China[J]. Virol Sin, 2023, 38(2): 208-221. DOI:10.1016/j.virs.2023.02.001 |
| [12] |
Wang RC, Liu SH, Sun HL, et al. Metatranscriptomics reveals the RNA virome of ixodes persulcatus in the China-North Korea Border, 2017[J]. Viruses, 2023, 16(1): 62. DOI:10.3390/v16010062 |
| [13] |
Xiang YL, Zhou JZ, Yu FX, et al. Characterization of bacterial communities in ticks parasitizing cattle in a touristic location in southwestern China[J]. Exp Appl Acarol, 2023, 90(1/2): 119-135. DOI:10.1007/s10493-023-00799-y |
| [14] |
李洁, 王倩, 夏珞媛, 等. 我国不同地域蜱类自然感染MIV-2病毒的调查[J]. 寄生虫与医学昆虫学报, 2021, 28(2): 99-103. Li J, Wang Q, Xia LY, et al. Natural infection of MIV-2 virus in ticks of different regions of China[J]. Acta Parasitol Med Entomol Sin, 2021, 28(2): 99-103. DOI:10.3969/j.issn.1005-0507.2021.02.006 |
| [15] |
Wang AA, Pang Z, Liu L, et al. Detection and phylogenetic analysis of a novel tick-borne virus in Yunnan and Guizhou provinces, southwestern China[J]. Pathogens, 2021, 10(9): 1143. DOI:10.3390/pathogens10091143 |
| [16] |
Li WY, Li RT, Tang XM, et al. Genomics evolution of Jingmen viruses associated with ticks and vertebrates[J]. Genomics, 2023, 115(6): 110734. DOI:10.1016/j.ygeno.2023.110734 |
| [17] |
Ni XB, Cui XM, Liu JY, et al. Metavirome of 31 tick species provides a compendium of 1 801 RNA virus genomes[J]. Nat Microbiol, 2023, 8(1): 162-173. DOI:10.1038/s41564-022-01275-w |
| [18] |
肖鹏. 微小扇头蜱空间分布及感染病原体流行情况分析[D]. 北京: 北京化工大学, 2022. DOI: 10.26939/d.cnki.gbhgu.2022.001560. Xiao P. Prediction of spatial distribution and epidemic analysis of pathogens of Rhipicephalus microplus[D]. Beijing: Beijing University of Chemical Technology, 2022. DOI: 10.26939/d.cnki.gbhgu.2022.001560.(inChinese) |
| [19] |
Amarasinghe GK, Ayllón MA, Bào Y, et al. Taxonomy of the order Mononegavirales: Update 2019[J]. Arch Virol, 2019, 164(7): 1967-1980. DOI:10.1007/s00705-019-04247-4 |
| [20] |
Liu MC, Zhang JT, Chen JJ, et al. A global dataset of microbial community in ticks from metagenome study[J]. Sci Data, 2022, 9(1): 560. DOI:10.1038/s41597-022-01679-7 |
| [21] |
韩焕美, 张玉磊, 彭健, 等. 医学媒介生物蜱虫与病毒性传染病概述[J]. 中国口岸科学技术, 2021, 3(10): 4-11. Han HM, Zhang YL, Peng J, et al. Overview of medical vector tick organisms and viral infectious diseases[J]. China Port Sci Technol, 2021, 3(10): 4-11. DOI:10.3969/j.issn.1002-4689.2021.10.001 |
| [22] |
Rodino KG, Pritt BS. Novel applications of metagenomics for detection of tickborne pathogens[J]. Clin Chem, 2021, 68(1): 69-74. DOI:10.1093/clinchem/hvab228 |
| [23] |
Li YH, Wang XH, Huang WW, et al. Retracted: Severe fever with thrombocytopenia syndrome virus induces platelet activation and apoptosis via a reactive oxygen species-dependent pathway[J]. Redox Biol, 2023, 65: 102837. DOI:10.1016/j.redox.2023.102837 |
| [24] |
Dong ZH, Yang MH, Wang ZD, et al. Human Tacheng tick virus 2 infection, China, 2019[J]. Emerg Infect Dis, 2021, 27(2): 594-598. DOI:10.3201/eid2702.191486 |
| [25] |
滕艾颖. 中国布尼亚病毒目病原体的空间分布及传播风险预测研究[D]. 北京: 军事科学院, 2022. DOI: 10.27193/d.cnki.gjsky.2022.000008. Teng AY. Spatial distribution and transmission risk prediction of the viral pathogens belonging to the order Bunyavirales in China[D]. Beijing: The Academy of Military Sciences, 2022. DOI: 10.27193/d.cnki.gjsky.2022.000008.(inChinese) |
| [26] |
Guo LY, Ma J, Lin JW, et al. Virome of Rhipicephalus ticks by metagenomic analysis in Guangdong, southern China[J]. Front Microbiol, 2022, 13: 966735. DOI:10.3389/fmicb.2022.966735 |
| [27] |
王娟. 云南省怒江州蜱携带病原体的调查研究[D]. 大理: 大理大学, 2023. DOI: 10.27811/d.cnki.gdixy.2023.000143. Wang J. Investigation of tick-borne pathogens in Nujiang, Yunnan Province[D]. Dali: Dali University, 2023. DOI: 10.27811/d.cnki.gdixy.2023.000143.(inChinese) |
| [28] |
Wang WJ, Shin WJ, Zhang BJ, et al. The cap-snatching SFTSV endonuclease domain is an antiviral target[J]. Cell Rep, 2020, 30(1): 153-163.e5. DOI:10.1016/j.celrep.2019.12.020 |
| [29] |
Walker PJ, Freitas-Astúa J, Bejerman N, et al. ICTV virus taxonomy profile: Rhabdoviridae 2022[J]. J Gen Virol, 2022, 103(6): 001689. DOI:10.1099/jgv.0.001689 |
| [30] |
杨子君. 蜱虫病毒群落解析及新发病毒遗传特征研究[D]. 镇江: 江苏大学, 2022. DOI: 10.27170/d.cnki.gjsuu.2022.000092. Yang ZJ. Analysis of tick virus community and genetic characteristics of emerging viruses[D]. Zhenjiang: Jiangsu University, 2022. DOI: 10.27170/d.cnki.gjsuu.2022.000092.(inChinese) |
 2024, Vol. 35
2024, Vol. 35


