扩展功能
文章信息
- 王博, 孙英伟, 李鑫, 王子江, 于维君, 雷露, 于伟, 毛玲玲
- WANG Bo, SUN Ying-wei, LI Xin, WANG Zi-jiang, YU Wei-jun, LEI Lu, YU Wei, MAO Ling-ling
- 2015-2021年辽宁省疟疾诊断参比实验室疟疾样本复核结果
- Review results of malaria samples by Liaoning provincial malaria diagnostic reference laboratories in Liaoning Province, 2015-2021
- 中国媒介生物学及控制杂志, 2024, 35(5): 581-586
- Chin J Vector Biol & Control, 2024, 35(5): 581-586
- 10.11853/j.issn.1003.8280.2024.05.013
-
文章历史
- 收稿日期: 2024-04-17
疟疾(malaria)是主要依靠蚊虫叮咬或/和输血2种途径传播的寄生虫病,是世界卫生组织(WHO)公布的重要传染病之一,疟疾的发病与传播严重危害人类的身体健康和影响社会经济发展[1],因此与艾滋病、结核病一起被列为全球三大公共卫生问题[2]。2021年在全球范围内的疟疾流行国家仍然有大约有2.47亿疟疾病例患者,死亡人数大约为61.9万[3]。我国疟疾防控从控制到消除经历5个阶段:重点调查和防治阶段(1949-1959年)、控制严重流行阶段(1960-1979年)、降低发病率阶段(1980-1999年)、巩固防治成果阶段(2000-2009年)和消除疟疾阶段(2010-2020年)[4]。20世纪60年代后,我国曾出现2次大范围疟疾暴发流行。2010年中国启动消除疟疾计划[5],随着全国消除疟疾工作进展顺利,中国本地疟疾病例迅速减少[6-9],并于2021年6月全国通过了WHO消除疟疾认证认可[10]。
疫情报告数据显示辽宁省疟疾最早发现于1951年,1951-2010年全省共报告疟疾病例277 760例,分布在85个县(区),占全省总县(区)数的85%,报告疟疾死亡病例25例,2015年报告最后1例本地病例,2020年辽宁省通过了国家对辽宁的疟疾消除审核工作。新中国成立后,辽宁省每年均有疟疾病例报告,其中有3次较大的疟疾流行,经过不断地大力防治与整治,3次疫情均得到了迅速有效的控制。2020年以来,全国共发现疟疾病例4 561例,均为境外感染来源病例,未发现本地原发病例或由输入病例引起的输入继发病例[5]。现阶段全国包括辽宁省疟疾防控面临的最重要挑战是防止输入性疟疾再传播,保持现阶段取得的来之不易的疟疾消除状态[11],自2017年起,辽宁省要求所有发现的疑似疟疾病例样本需送各地市疾病预防控制(疾控)中心进行实验室诊断复核,再由省级参比实验室进行诊断复核确认。本研究对辽宁省疾控中心疟疾诊断参比实验室自2015年建成以来至2021年期间各地市上报的实验室疟疾病例血涂片和抗凝血样本,进行结果复核诊断以及回顾性研究分析,旨在全面了解分析目前辽宁省各地市疾控中心实验室疟疾检测的综合能力,提出改进措施,保证辽宁省疟疾实验室一直维持较高的检测水平,为消除疟疾后疟疾防控和防止再传播提供科学的指导依据。
1 材料与方法 1.1 样本来源全省各地市疾控中心采集的2015-2021年疟疾患者外周抗凝血3 ml,及使用患者乙二胺四乙酸(EDTA)抗凝血制作的标准厚薄血涂片样本。
1.2 主要仪器和试剂核酸提取试剂盒(QIAamp DNA Mini Kit,批号:175038376,德国Qiagen公司),荧光定量PCR核酸检测试剂盒(江苏硕世生物科技股份有限公司,疟原虫批号:YJW20102N;恶性疟批号:YJW20103N;间日疟批号:YJW20104N;三日疟批号:YJW20105N;卵形疟批号:YJW20106N),PCR反应聚合酶[宝生物工程(大连)有限公司,TaKaRa Ex Taq酶,货号:R001A]。普通PCR仪(苏州东胜兴业科学仪器有限公司,东胜龙),电泳仪(北京六一仪器厂,DYY-8B),凝胶成像系统(美国BIO-RAD),琼脂糖(西班牙SIGMA VETEC)。
1.3 检测方法 1.3.1 疟原虫显微镜镜检采集患者EDTA抗凝血制作标准血涂片,将其干燥、固定后使用Giemsa染色,在油镜高倍镜(×1 000)下观察疟原虫虫体的形态并且鉴定。复核人员均经验丰富并获得WHO颁发的一级镜检能力认证的资质证书。
1.3.2 疟原虫核酸检测 1.3.2.1 巢式PCR法采用巢式PCR法[12-15]对疟疾病例抗凝血进行核酸检测。第1轮PCR反应总体系(25 µl):10 µmol/L正、反向引物各1 μl,10×PCR缓冲液2.5 µl,2.5 mmol/L dNTP 2 µl,5 U/µl Taq酶0.125 µl,DNA模板2 µl,ddH2O补足至25 µl。PCR反应条件:94 ℃预变性3 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸60 s,25个循环;72 ℃延伸5 min。反应结束后,降温至25 ℃。第2轮反应体系(25µl):10×PCR缓冲液2.5 µl,2.5 mmol/L dNTP 2 µl,5 U/µl Taq酶0.125 µl,模版(第1轮PCR产物)2 µl,10 µmol/L正、反向引物各1 μl。恶性疟原虫(Plasmodium falciparum)、间日疟原虫(P. vivax)、三日疟原虫(P. malariae)和卵形疟原虫(P. ovale)分别使用FAL1 F/FAL2 R、VIV1 F/VIV1R、MAL1 F/MAL1 R和OVA1F/OVA1 R 4对引物进行扩增,见表 1。1.5%琼脂糖凝胶电泳对第2轮PCR产物进行目标DNA鉴定。
根据试剂盒说明书进行目标DNA检测。反应体系:核酸扩增反应液12.5 µl,型别检测液7.5 µl,模板为5 µl,总反应体系为25 µl。反应条件:95 ℃预变性5 min;95 ℃变性10 s,58 ℃退火、延伸及检测荧光30 s,共扩增40个循环。58 ℃时荧光检测。
1.4 评价标准以省疟疾诊断参比实验室确认结果为标准,评价各年及辽宁省各地市网络上报结果的阳性符合率和虫种符合率。阳性符合率=省级复核确诊阳性数/省级复核网报病例数×100%;虫种符合率=与省级复核虫种一致样本数/省级复核确诊阳性病例数×100%。
1.5 统计学分析应用SPSS 17.0软件,率的比较采用χ2检验和Fisher确切概率法,检验水准α=0.05。
2 结果 2.1 各地市疾控中心报送标本基本情况辽宁省12个地市疾控中心疟疾实验室报送的疟疾抗凝血全血样本和厚、薄血涂片总计380份,各地市报送的样本数见表 2。
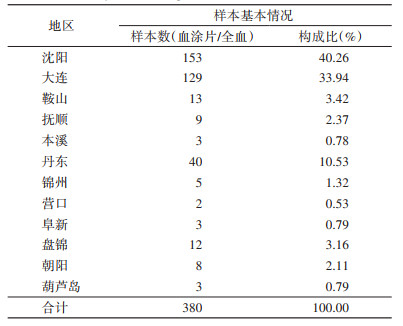
|
对标本进行巢式PCR检测后计算符合率,从地区看,沈阳和大连市报送疟疾病例标本的实验室检测符合率较高,鞍山和抚顺市的较低。2019-2021年大部分地市样本符合率普遍高于2015-2018年,但各地区不同年份间符合率差异均无统计学意义(均P > 0.05),辽宁省疟疾样本复核总符合率不同年份间差异有统计学意义(χ2=22.594,P=0.002)。见表 3。
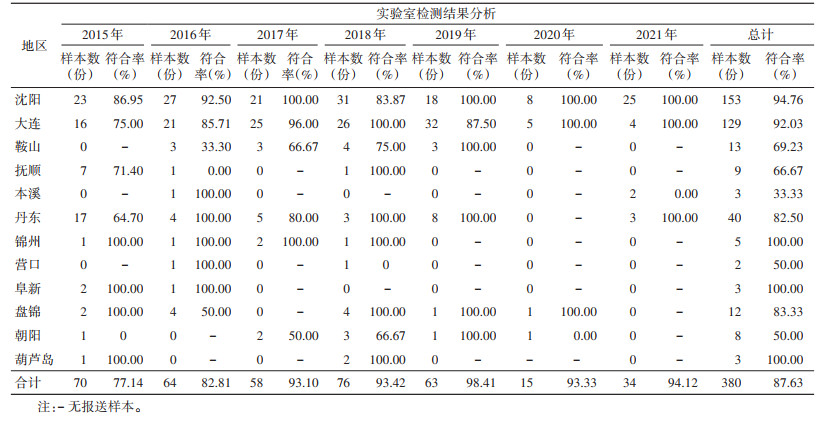
|
在报送的阴性样本中,误判最多的为恶性疟原虫,有5份最终省级复核结果订正为恶性疟原虫,其次是间日疟原虫和卵形疟原虫,各1份;卵形疟原虫误判为间日疟原虫的比例最高(3/20);三日疟原虫则误判为间日疟原虫(1/11),见表 4。对报送各型别标本的符合率进行卡方检验,各型别标本符合率差异无统计学意义(χ2=7.091,P=0.313)。

|
报送的疟疾病例标本,巢式PCR检测阳性率为87.63%(333/380),血片镜检阳性率为74.47%(283/380),2种方法检测结果差异有统计学意义(χ2=46.296,P < 0.001)。见表 5。
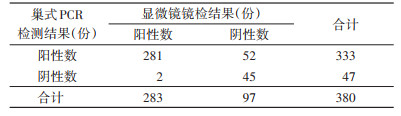
|
2015年-2021年上报标本中剔除诊断不全的疟疾样本,将巢式PCR和qPCR 2种方法复核结果进行比较,总一致率为97.00%(323/333),巢式PCR的灵敏性检出率略高于qPCR法的检出率(诊断不全结果除外)。见表 6。
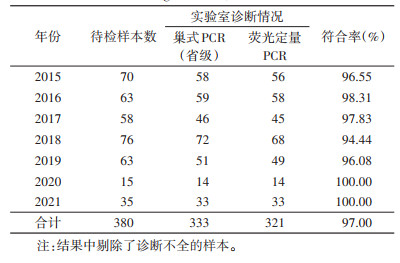
|
我国曾经蚊虫肆虐,是疟疾高发大国,国民健康深受疟疾困扰。辽宁省作为我国最北方的疟疾流行省,属于非稳定性低度疟疾流行区。辽宁省流行的疟原虫种类为间日疟原虫,长、短潜伏期皆有,以长潜伏期为主。随着疟疾防治工作的深入推进,以及社会经济的发展,人民生活水平的提高,疟疾知识宣传的加强和普通百姓对疟疾的了解,1977年以来辽宁省疟疾发病率始终保持在1/10万以下[16]。尤其是2010年《中国消除疟疾行动计划(2010-2020)》实施以来,根据全国疟疾消除行动,辽宁省结合实际情况制定了本省疟疾消除计划,加大了对疟疾的防控力度,辽宁疟疾疫情得到有效控制,并于2020年通过了国家消除疟疾考核。我国自2017年以来未发现本地感染疟疾病例,并于2021年通过WHO的消除疟疾认证,但是境外输入性疟疾疫情仍居高不下[7],且国内有疟疾的传播媒介,不能排除境外输入病例导致出现输入性继发病例的可能,因此我国现阶段疟疾防控工作的重点已转变为“谨防输入性疟疾,持续巩固消除成果”。辽宁省病媒监测发现,全省疟疾传播条件并未发生根本性变化,全省各地市仍有中华按蚊(Anopheles sinensis)分布,且中华按蚊蚊密度未发生明显变化,蚊媒活动季节输入性疟疾仍存在引起本地再传播风险。目前经过省级实验室持续地参与技术指导与积极进行实验室质量控制,辽宁省市级疾控中心的疟疾检测能力已经从开展疟疾消除这项工作最初期的单一疟原虫镜检过渡到了能同时开展镜检+快速检测(rapid diagnostic tests,RDT)+核酸PCR检测的水平,大大提高了对输入性疟疾病例诊断的实验室检测及时性和准确性。通过对全省14个地市实验室检测数据分析发现,病例数较多的沈阳和大连市实验室检测的符合率较高,可以达到95.36%和92.97%;而其他病例数少的地区符合率则较低,说明实验室检测能力与所在地区的病例数密切相关,对于低发病数地区应如何进一步强化疟疾诊断参比实验室的能力,以便及时、准确地发现疟疾患者,是巩固疟疾消除成果的重中之重。
为了评价2015年-2021年辽宁省各市级疾控中心实验室的检测水平,归纳、总结检测中存在的问题,本次研究首先对不同年份不同地区的复核结果进行分析,可以看出辽宁省主要的疟疾病例都集中在了沈阳和大连2个城市,其报告病例占全省报告病例总数的74.20%,实验室检测符合率除最开始的2年其他各年均 > 93.00%,全省总符合率也近90.00%,说明为做好疟疾消除工作,对各地市进行的相关实验室检测技术培训确实卓有成效,但部分地市标本复核符合率较低,推断这些地市由于病例较少,部分城市甚至几年才出现1例疟疾病例,实验人员检测机会少,造成检测能力相对薄弱,导致符合率较低;而沈阳、大连这样病例较多的城市,接触样本多,“练兵”机会多,见识的疟原虫种类多,符合率也较高。从年度看,大部分地市符合率是上开的,特别是近3年依托疟疾消除项目的开展,上升更为明显,这主要是由于辽宁省在疟疾消除行动中,省级实验室多次面向基层,开展实验室人员技能训练和质控考核,整体提高了全省疟疾实验室方面的诊断能力。
对不同的虫种复核结果看,发现恶性疟原虫和阴性结果间发生型别误判的比例最高,其次是间日疟原虫和卵形疟原虫间,分析原因可能有三,原因一:血涂片制作质量不高,杂质多,对结果产生干扰,导致阴性结果误判为恶性疟原虫和恶性疟原虫误判阴性结果;原因二:实验室疟疾检测人员变动,基层疾控部门实验室人员流动性大,部分新上岗人员疟疾检测能力相对较弱,导致对检测结果错误判断的产生;原因三:卵形疟原虫和间日疟原虫有很多相似的地方,虫体形态,包括发育过程中的裂殖体和滋养体都较易混淆,细微的差别主要在于虫体大小和裂殖体的数目和肿胀程度,这就需要镜检人员具有非常丰富的镜检经验和对型别之间细小差别的把握能力,每年辽宁省报告的卵形疟病例在5例左右,各地检验人员经验相对不足,这也是此类虫种型别易发生误判的最主要原因。
从检测方法来看,对报送的疟疾病例样本,巢式PCR检测阳性率为87.63%,血涂片镜检阳性率则为74.47%,2种方法间检出阳性率差异具有统计学意义,血涂片镜检结果为阴性的52份样本,经巢式PCR检测更正为阳性,巢式PCR检测方法的灵敏度要高于血涂片镜检。镜检与巢式PCR结果出现偏差的原因有可能是病例处于抗疟药物处置后采血,大量疟原虫被杀死,虫体被分解,仅疟原虫的核酸被保留,患者血涂片当中虫密度很低,所以血片镜检假阴性,也有可能是血涂片本身制作质量不高,干扰了镜检人员对病例的正确判断所导致。对比巢式PCR和qPCR 2种PCR检测方法对报送疟疾样本的检测结果来看,2015-2021年中剔除诊断不全的样本,检测结果总一致率为97.00%,巢式PCR的灵敏性要略高于qPCR检测方法,但总体差异不大,产生这种结果的原因可能与PCR扩增选择的引物特异性有关。我国目前疟原虫基因PCR扩增主要的靶标基因是18S rRNA,但每种疟原虫至少有2类18S rRNA[17],如果采用错误的或非特异性的引物序列进行扩增就可能出现假阴性的情况,提示实验室检测人员在实际操作过程中要选择合适的方法,也提示试剂盒的选择对于病例的正确诊断也起到很重要的作用。
综上所述,通过本次对辽宁省2015-2021年报送的疟疾病例样本的回顾性研究,在消除疟疾后防止输入再传播阶段,虽然辽宁省各地市实验室检测整体水平在逐渐提高,但在显微镜镜检血涂片和核酸检测工作方面仍存在不足。
因此要继续推进各市级实验室检测疟疾样本能力培训,不断加强对各地市疟疾实验室检测队伍的质控和指导,做到疟疾病例的及时发现,准确诊断,促进辽宁省整体疟疾实验室诊断能力的提高。
利益冲突 无
| [1] |
李硕, 张云辉, 王永怡, 等. 2016年全球传染病热点回顾[J]. 传染病信息, 2017, 30(1): 1-7. Li S, Zhang YH, Wang YY, et al. Hot spots review of global infectious diseases in 2016[J]. Infect Dis Inform, 2017, 30(1): 1-7. DOI:10.3969/j.issn.1007-8134.2017.01.003 |
| [2] |
齐小秋. 疟疾防治手册[M]. 3版. 北京: 人民卫生出版社, 2007: 78-79. Qi XQ. Malaria control manual[M]. 3rd ed. Beijing: People's Medical Publishing House, 2007: 78-79. |
| [3] |
张耀光, 江莉, 王真瑜, 等. 2017-2019年上海市各区疟疾实验室检测能力分析[J]. 中国寄生虫学与寄生虫病杂志, 2021, 39(3): 337-342. Zhang YG, Jiang L, Wang ZY, et al. Analysis of malaria detection capability of laboratories in the districts of Shanghai during 2017-2019[J]. Chin J Parasitol Parasit Dis, 2021, 39(3): 337-342. DOI:10.12140/j.issn.1000-7423.2021.03.007 |
| [4] |
World Health Organization. World malaria report 2020[R]. Geneva: WHO, 2020: 18, 20.
|
| [5] |
高琪. 当前疟疾形势与我国消除疟疾后的再传播风险与对策[J]. 中国热带医学, 2024, 24(1): 1-5. Gao Q. Risk and countermeasures of re-establishment after malaria elimination in China[J]. China Trop Med, 2024, 24(1): 1-5. DOI:10.13604/j.cnki.46-1064/r.2024.01.01 |
| [6] |
朱国鼎, 高琪, 曹俊. 中国防止疟疾输入再传播面临的挑战和应对策略[J]. 中国血吸虫病防治杂志, 2021, 33(1): 7-9, 21. Zhu GD, Gao Q, Cao J. Challenges and countermeasures in prevention of re-establishment of imported malaria in China[J]. Chin J Schisto Control, 2021, 33(1): 7-9, 21. DOI:10.16250/j.32.1374.2021008 |
| [7] |
Feng J, Zhang L, Huang F, et al. Ready for malaria elimination: Zero indigenous case reported in the People's Republic of China[J]. Malar J, 2018, 17(1): 315. DOI:10.1186/s12936-018-2444-9 |
| [8] |
朱国鼎, 曹俊. 全球消除疟疾进展及面临的挑战[J]. 中国血吸虫病防治杂志, 2019, 31(1): 19-22, 52. Zhu GD, Cao J. Progress and challenges of global malaria elimination[J]. Chin J Schisto Control, 2019, 31(1): 19-22, 52. DOI:10.16250/j.32.1374.2019006 |
| [9] |
Feng J, Xiao HH, Xia ZG, et al. Analysis of malaria epidemiological characteristics in the People's Republic of China, 2004-2013.[J]. Am J Trop Med Hyg, 2015, 93(2): 293-299. DOI:10.4269/ajtmh.14-0733 |
| [10] |
Feng J, Zhang L, Xia ZG, et al. Malaria-free certification in China: Achievements and lessons learned from the National Malaria Elimination Programme[J]. Zoonoses, 2021, 1(1): 3-6. DOI:10.15212/ZOONOSES-2021-1002 |
| [11] |
王博, 毛玲玲, 王子江, 等. 辽宁省2017年5例输入性卵形疟疾的实验室诊断[J]. 中国媒介生物学及控制杂志, 2019, 30(1): 80-83. Wang B, Mao LL, Wang ZJ, et al. Imported oval malaria in Liaoning Province, China, in 2017: A laboratory diagnosis of 5 cases[J]. Chin J Vector Biol Control, 2019, 30(1): 80-83. DOI:10.11853/j.issn.1003.8280.2019.01.019 |
| [12] |
World Health Organization. Guidelines for the treatment of malaria[M]. 2nd ed. Geneva: WHO, 2010: 35-36.
|
| [13] |
Snounou G, Viriyakosol S, Zhu XP, et al. High sensitivity of detection of human malaria parasites by the use of nested polymerase chain reaction[J]. Mol Biochem Parasitol, 1993, 61(2): 315-320. DOI:10.1016/0166-6851(93)90077-b |
| [14] |
Snounou G, Viriyakosol S, Jarra W, et al. Identification of the four human malaria parasite species in field samples by the polymerase chain reaction and detection of a high prevalence of mixed infections[J]. Mol Biochem Parasitol, 1993, 58(2): 283-292. DOI:10.1016/0166-6851(93)90050-8 |
| [15] |
Singh B, Bobogare A, Cox-Singh J, et al. A genus- and species-specific nested polymerase chain reaction malaria detection assay for epidemiologic studies[J]. Am J Trop Med Hyg, 1999, 60(4): 687-692. DOI:10.4269/ajtmh.1999.60.687 |
| [16] |
滕聪, 雷露, 孙英伟, 等. 2008-2013年辽宁省疟疾流行病学分析[J]. 中国血吸虫病防治杂志, 2014, 26(2): 200-202. Teng C, Lei L, Sun YW, et al. Prevalence of malaria in Liaoning Province, 2008 to 2013[J]. Chin J Schisto Control, 2014, 26(2): 200-202. DOI:10.16250/j.32.1374.2014.02.005 |
| [17] |
李美, 王真瑜, 张淘, 等. 一步反转录PCR技术在检测4种人疟原虫中的初步应用[J]. 中国寄生虫学与寄生虫病杂志, 2016, 34(6): 500-505. Li M, Wang ZY, Zhang T, et al. Exploration of using one-step reverse transcription PCR in detection of four species of human malaria parasites[J]. Chin J Parasitol Parasit Dis, 2016, 34(6): 500-505. |
 2024, Vol. 35
2024, Vol. 35



