扩展功能
文章信息
- 刘鹃, 刘鹏, 王雅伟, 余小梅, 黎雪梅, 邱星辉
- LIU Juan, LIU Peng, WANG Ya-wei, YU Xiao-mei, LI Xue-mei, QIU Xing-hui
- 家蝇抗药性相关羧酸酯酶MdαE7 G137D和乙酰胆碱酯酶V260L与F407Y突变的核酸检测方法
- Nucleic acid-based method for detection of insecticide resistance-associated mutations in carboxylesterase MdαE7 (G137D) and acetylcholinesterase (V260L and F407Y) of Musca domestica
- 中国媒介生物学及控制杂志, 2024, 35(5): 564-568
- Chin J Vector Biol & Control, 2024, 35(5): 564-568
- 10.11853/j.issn.1003.8280.2024.05.010
-
文章历史
- 收稿日期: 2024-03-19
2 中国科学院动物研究所 农业虫害鼠害综合治理研究国家重点实验室, 北京 100101
2 State Key Laboratory of Integrated Managemeat of Pest Insects and Rodents, Institute of Zoology, Chinese Academy of Sciences, Beijing 100101, China
家蝇(Musca domestica)是一种重要的公共卫生和畜牧业病媒昆虫,可机械性传播200多种人畜病原体[1],侵扰畜禽导致产品产量和质量的降低[2]。家蝇的防治长期以来主要依赖有机磷、氨基甲酸酯和拟除虫菊酯等化学杀虫剂,导致抗药性问题日益突出[3-5]。研究表明,家蝇的抗药性与羧酸酯酶MdαE7和乙酰胆碱酯酶(AChE)某些位点的氨基酸突变有着密切关系。已知羧酸酯酶MdαE7的G137D和W251L/S位点突变与家蝇对有机磷或拟除虫菊酯杀虫剂抗性相关[3, 6],AChE的V260L、G342A/V、F407Y和G445A位点突变或突变组合可以导致家蝇产生对有机磷、氨基甲酸酯类杀虫剂的抗性[7-8]。
及时了解抗药性相关基因突变的频率和动态,能为家蝇的有效防治提供科学依据。Qiu等[9]已建立了家蝇MdαE7 251L/S/W和AChE342G/V/A核酸检测方法,但至今未见有对其他抗性突变位点检测方法的报道。本研究中,我们建立了基于聚合酶链式反应-限制性片段长度多态性(polymerase chain reaction-restriction fragment length polymorphism,PCR-RFLP)技术的基因分型方法,可用于家蝇羧酸酯酶MdαE7 G137D和AChE V260L、F407Y突变的检测。
1 材料与方法 1.1 家蝇样品2022年6-7月,在四川省内江市资中、威远、隆昌、市中和东兴5个县(市、区),按照东、南、西、北、中不同方位选择家禽养殖场作为采样点,采用诱蝇笼或捕虫网从现场采集家蝇成虫,存放于无水乙醇溶液中,4 ℃条件下进行短期保存,于-20 ℃条件下进行长期保存。
1.2 家蝇基因组DNA提取参照Rinkevich等[10]的方法提取家蝇基因组DNA,步骤如下:(1)取单只家蝇,用无菌水冲洗数次,洗去表面残留的乙醇溶液,去掉腹部后,放入1.5 ml离心管中,加入50 μl裂解液充分研磨后再加裂解液400 μl(100 mmol/L Tris-HCl,pH 8.0,50 mmol/L NaCl,10 mmol/L EDTA,1% SDS)以及5 μl蛋白酶K(Protease K)(20 mg/ml,天根生化科技有限公司),混匀后在56 ℃水浴锅中水浴1 h。(2)再加入50 μl 8 mol/L醋酸钾(KAc)溶液,混匀后冰上放置10 min,之后14 000×g离心30 min。(3)取出样品,吸取400 μl上清于新离心管中,加入800 μl冰无水乙醇,颠倒混匀,室温静置20 min。(4)14 000×g离心10 min,弃上清,加入500 μl 70%乙醇溶液清洗。(5)8 000×g离心10 min,弃尽上清,沉淀干燥后,加入50 μl无核酸酶水溶解。制备的DNA样品可直接用于后续的PCR,也可以将样品保存在4 ℃下备用,或在-20 ℃条件下长期保存。
1.3 PCR扩增与PCR产物的电泳检测采用基因特异性引物,设置3个不同的PCR反应以分别扩增包含抗药性相关突变位点的基因片段,对应的PCR产物分别命名为MdαE7-137、AChE-260和AChE-407,见表 1。PCR反应体系(总体积20 μl)包含10 μl 2× ES Taq MasterMix(康为世纪生物科技股份有限公司),正、反向引物(10 μmol/L)各0.5 μl,ddH2O 8.4 μl,模板DNA 0.6 μl。扩增MdαE7-137和AChE-260基因片段时,PCR程序设置为94 ℃ 2 min;94 ℃ 30 s,62 ℃ 30 s,72 ℃ 15 s,35个循环;72 ℃ 5 min。扩增AChE-407基因片段采用的PCR程序为94 ℃ 2 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 15 s,35个循环;72 ℃ 5 min。PCR反应结束后,取5 μl PCR产物在1.5%琼脂糖凝胶上样,140 V电泳30 min后在凝胶成像仪观测。
|
为对家蝇抗药性相关的位点进行基因分型,将1.3中获得PCR产物进一步做酶切反应,所用的限制性内切酶及其酶切识别位点见表 1。MdαE7-137酶切反应体系(20 μl):Bst XI(10 U/μl)1 μl,10× NEB Buffer r3.1 2 μl,PCR产物2 μl,ddH2O15 μl。AChE-260的酶切体系(20 μl):Sal Ⅰ-HF®(20 U/μl)0.5 μl,10× NEB rCutSmart Buffer 2 μl,PCR产物2 μl,ddH2O 15.5 μl。AChE-407酶切反应体系:Eco RV-HF®(20 U/μl)0.5 μl,10× NEB rCutSmart Buffer 2 μl,PCR产物4 μl,ddH2O 13.5 μl。以上酶切反应均在37 ℃下进行2 h,酶切产物在2.5%琼脂糖凝胶上上样,140 V条件下电泳30 min后,紫外成像检测。根据酶切产物的电泳条带,判定家蝇样品抗药性相关位点的个体基因型。
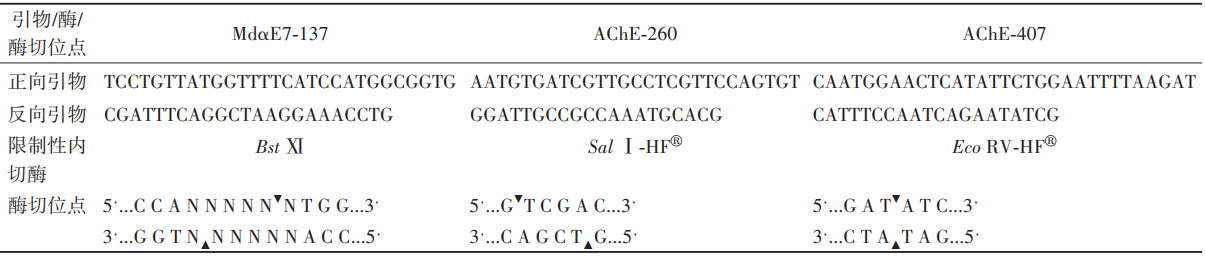
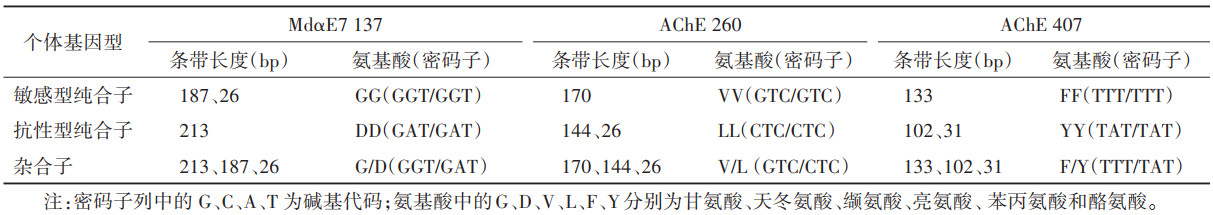
2 结果 2.1 羧酸酯酶MdαE7 137位点基因分型方法扩增出包含137位点的MdαE7基因片段,大小符合预期(213 bp),见图 1A。经Bst XI酶切后,不同基因型个体的PCR产物酶切图谱不同。敏感纯合子(137GG)的产物经酶切后可以产生187和26 bp的产物,其中26 bp片段在琼脂糖凝胶电泳中不易识别,如电泳图出现187 bp 1条条带,该个体MdαE7的基因型为敏感纯合。相反,抗性纯合子(137DD)的PCR产物中不包含Bst Ⅺ的酶切位点,因此不能被该酶酶切,其电泳结果仅213 bp 1条条带。杂合基因型个体的PCR产物同时包含可被Bst Ⅺ酶切和不能被酶切的基因片段,经酶消化后,产生3种不同大小的产物,即26、187和213 bp条带,见图 1B、表 2。
|
| 注:DD为MdαE7 137D抗性型纯合子;GG为MdαE7 137G敏感型纯合子;G/D为MdαE7 137杂合子;M为DNA marker。 图 1 基于聚合酶链式反应-限制性片段长度多态性的家蝇MdαE7 137位点基因分型 Figure 1 Genotyping of Musca domestica on site 137 in MdαE7 using polymerase chain reaction-restriction fragment length polymorphism |
| |
|
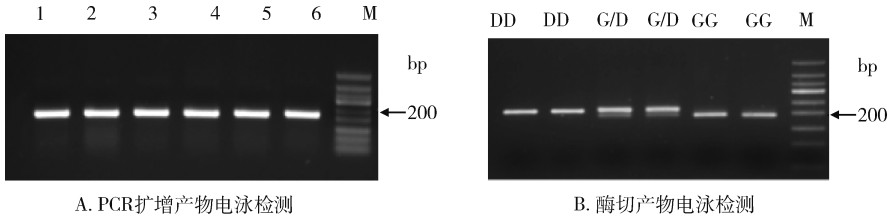
采用AChE-260的特异性引物,经PCR反应扩增出单一、符合预期大小(170 bp)的条带,见图 2A。由于敏感等位基因AChE 260V的PCR产物不存在Sal Ⅰ-HF®酶切位点,与Sal Ⅰ-HF®温浴后保持不变,电泳显示大小为170 bp的单一条带。抗性等位基因AChE 260L的PCR产物经Sal I-HF®作用后,可以产生144和26 bp的产物。杂合个体同时包含AChE 260V和AChE 260L,其PCR产物经Sal I-HF®酶切后,理论上产生170、144和26 bp 3个不同长度的产物,见图 2B和表 2。

|
| 注:VV为AChE 260敏感型纯合子;L/L为AChE 260抗性型纯合子;V/L为AChE 260杂合子;M为DNA marker。 图 2 基于聚合酶链式反应-限制性片段长度多态性的家蝇AChE 260位点基因分型 Figure 2 Genotyping of Musca domestica on site 260 in AChE using polymerase chain reaction-restriction fragment length polymorphism |
| |
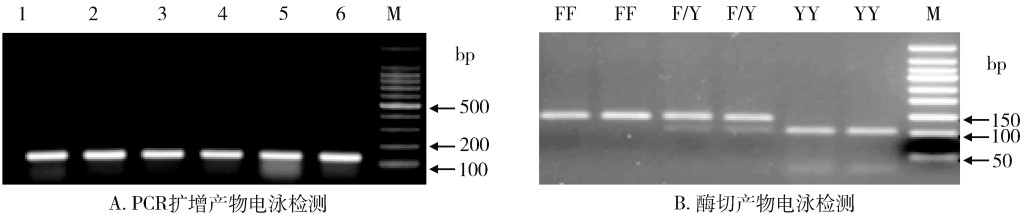
采用基因特异性引物,扩增出了包含407位点的AchE基因片段,其长度为133 bp,见图 3A。PCR产物经Eco RV-HF®消化后,敏感纯合子(AchE 407-FF)的产物因不存在酶切位点,其大小保持133 bp不变,抗性纯合子(AchE 407-YY)的产物经酶切后可以产生102和31 bp的产物。杂合个体包含抗性和敏感等位基因,其产物经Eco RV-HF®作用后,产生133、102和31 bp 3种产物,在电泳图中显示出3条条带,见图 3B、表 2。
|
| 注:FF为AChE 407敏感型纯合子;YY为AChE 407抗性型纯合子;F/Y为AChE 407杂合子;M为DNA marker。 图 3 基于聚合酶链式反应-限制性片段长度多态的家蝇AChE 407位点基因型检测 Figure 3 Genotyping of Musca domestica AChE at position 407 based on polymerase chain reaction-restriction fragment length polymorphism |
| |
大规模、长时间地使用杀虫剂导致的抗药性问题[3-4, 11],已成为家蝇有效控制的一大障碍。系统开展家蝇抗药性监测,可以为杀虫剂的合理使用以及延缓抗药性的产生提供科学依据。传统的家蝇抗药性生物测定法人力消耗大、时间周期长,不便于经常性开展抗性监测工作,亟需更加快速和简便的检测方法。等位基因特异性PCR(allele-specific PCR,AS-PCR)技术也被用于病媒生物突变的个体基因型检测,但特异性不高[12],本研究采用PCR-RFLP法建立家蝇抗性基因突变位点检测技术,具有简单、高效、精准的优点。
家蝇羧酸酯酶MdαE7表达量的增加和某些位点的氨基酸替换会导致昆虫产生抗药性[6, 13],137和251位点突变与有机磷或拟除虫菊酯类杀虫剂抗性相关,其中G137D突变是二嗪磷抗性的诊断特征[14]。137和251位点突变在国内外家蝇自然种群中普遍存在[3, 9, 15]。MdαE7 251位点突变检测方法已有报道[9],本研究建立的MdαE7 G137D位点快速检测方法,有利于更全面地检测家蝇羧酸酯酶MdαE7抗性突变的种类和频率。
AChE V260L、G342A/V、F407Y等突变可以改变家蝇对有机磷、氨基甲酸酯类杀虫剂的敏感性[3, 8],这3个位点的突变在我国已被多次检测到[3, 16]。Qiu等[9]报道了G342A/V突变的检测方法,本研究建立了另外2个抗性突变(V260L、F407Y)的检测方法,拓展了家蝇AChE抗性突变的检测范畴。
本研究建立的羧酸酯酶MdαE7 G137D和AChE V260L、F407Y突变核酸检测方法,能够准确、快速地鉴定与杀虫剂抗性相关突变的存在和频率,研究结果可用于监测或预测家蝇由羧酸酯酶MdαE7 137位点和AChE 260、407位点变异介导的对有机磷、氨基甲酸酯和拟除虫菊酯类杀虫剂抗性,为家蝇的有效控制提供决策依据。在MdαE7 G137D、AChE V260L和AChE F407Y位点酶切产物的小片段的大小均在30 bp左右,在常规琼脂糖凝胶电泳中不易看到,但可以根据另一大片段的存在与否判断样品的基因型。本研究建立的检测方法仅适用于已知的特定基因突变的检测,具有一定的局限性。如果目标基因存在新的突变类型,可采用基因测序的方法去发现。
利益冲突 无
| [1] |
Nayduch D, Burrus RG. Flourishing in filth: House fly-microbe interactions across life history[J]. Ann Entomol Soc Am, 2017, 110(1): 6-18. DOI:10.1093/aesa/saw083 |
| [2] |
孙雪峰, 李巧丽, 刘希望, 等. 养殖场的蝇类危害及防控方法[J]. 中兽医医药杂志, 2024, 43(1): 82-86. Sun XF, Li QL, Liu XW, et al. Harms of flies in livestock breeding farms and control methods[J]. J Tradit Chin Vet Med, 2024, 43(1): 82-86. DOI:10.13823/j.cnki.jtcvm.2023.124 |
| [3] |
Wang QM, Li M, Pan J, et al. Diversity and frequencies of genetic mutations involved in insecticide resistance in field populations of the house fly (Musca domestica L.) from China[J]. Pestic Biochem Physiol, 2012, 102(2): 153-159. DOI:10.1016/j.pestbp.2011.12.007 |
| [4] |
宋丙栋, 张艳, 闵玥, 等. 南京市2022年蝇类生态学监测及家蝇对常用杀虫剂的抗药性调查[J]. 中国媒介生物学及控制杂志, 2023, 34(5): 637-641. Song BD, Zhang Y, Min Y, et al. Ecological surveillance result of flies and resistance of Musca domestica to commonly used insecticides in Nanjing, China, 2022[J]. Chin J Vector Biol Control, 2023, 34(5): 637-641. DOI:10.11853/j.issn.1003.8280.2023.05.010 |
| [5] |
吴瑜燕, 刘钦梅, 王金娜, 等. 2021年浙江省家蝇对常见卫生杀虫剂的抗药性研究[J]. 中国媒介生物学及控制杂志, 2023, 34(1): 26-30. Wu YY, Liu QM, Wang JN, et al. Resistance of Musca domestica to commonly used insecticides in Zhejiang Province, China, 2021[J]. Chin J Vector Biol Control, 2023, 34(1): 26-30. DOI:10.11853/j.issn.1003.8280.2023.01.005 |
| [6] |
Zhang Y, Li J, Ma Z, et al. Multiple mutations and overexpression of the MdαE7 carboxylesterase gene associated with male-linked malathion resistance in housefly, Musca domestica (Diptera: Muscidae)[J]. Sci Rep, 2018, 8(1): 224. DOI:10.1038/s41598-017-17325-x |
| [7] |
Kozaki T, Brady SG, Scott JG. Frequencies and evolution of organophosphate insensitive acetylcholinesterase alleles in laboratory and field populations of the house fly, Musca domestica L.[J]. Pestic Biochem Physiol, 2009, 95(1): 6-11. DOI:10.1016/j.pestbp.2009.04.015 |
| [8] |
Kozaki T, Shono T, Tomita T, et al. Fenitroxon insensitive acetylcholinesterases of the housefly, Musca domestica associated with point mutations[J]. Insect Biochem Mol Biol, 2001, 31(10): 991-997. DOI:10.1016/S0965-1748(01)00047-9 |
| [9] |
Qiu XH, Pan J, Li M, et al. PCR-RFLP methods for detection of insecticide resistance-associated mutations in the house fly (Musca domestica)[J]. Pestic Biochem Physiol, 2012, 104(3): 201-205. DOI:10.1016/j.pestbp.2012.08.002 |
| [10] |
Rinkevich FD, Zhang L, Hamm RL, et al. Frequencies of the pyrethroid resistance alleles of Vssc1 and CYP6D1 in house flies from the eastern United States[J]. Insect Mol Biol, 2006, 15(2): 157-167. DOI:10.1111/j.1365-2583.2006.00620.x |
| [11] |
侯银续, 刘志伟, 张燕婕, 等. 2021年合肥市家蝇对6种常用卫生杀虫剂的抗药性调查[J]. 中国媒介生物学及控制杂志, 2023, 34(1): 105-108. Hou YX, Liu ZW, Zhang YJ, et al. Resistance of Musca domestica to six insecticides commonly used in Hefei, China, 2021[J]. Chin J Vector Biol Control, 2023, 34(1): 105-108. DOI:10.11853/j.issn.1003.8280.2023.01.019 |
| [12] |
Zhu CY, Zhao CC, Wang YG, et al. Establishment of an innovative and sustainable PCR technique for 1534 locus mutation of the knockdown resistance (kdr) gene in the dengue vector Aedes albopictus[J]. Parasit Vectors, 2019, 12(1): 603. DOI:10.1186/s13071-019-3829-5 |
| [13] |
Zhang L, Shi J, Shi XY, et al. Quantitative and qualitative changes of the carboxylesterase associated with beta-cypermethrin resistance in the housefly, Musca domestica (Diptera: Muscidae)[J]. Comp Biochem Physiol B Biochem Mol Biol, 2010, 156(1): 6-11. DOI:10.1016/j.cbpb.2010.01.011 |
| [14] |
Claudianos C, Russell RJ, Oakeshott JG. The same amino acid substitution in orthologous esterases confers organophosphate resistance on the house fly and a blowfly[J]. Insect Biochem Mol Biol, 1999, 29(8): 675-686. DOI:10.1016/S0965-1748(99)00035-1 |
| [15] |
杨婵, 潘婧, 李梅, 等. 家蝇羧酸酯酶MdαE7抗药性相关基因突变检测及其进化起源分析[J]. 寄生虫与医学昆虫学报, 2023, 30(2): 88-94. Yang C, Pan J, Li M, et al. Occurrence and evolutionary origin of insecticide resistance-conferring mutations in carboxylesterase (MdαE7) in Chinese house fly populations from five provinces[J]. Acta Parasitol Med Entomol Sin, 2023, 30(2): 88-94. DOI:10.3969/j.issn.1005-0507.2023.02.006 |
| [16] |
杨婵, 朱江, 潘婧, 等. 家蝇抗药性相关乙酰胆碱酯酶基因突变的进化起源分析[J]. 寄生虫与医学昆虫学报, 2023, 30(1): 46-50. Yang C, Zhu J, Pan J, et al. Evolutionary origins of insecticide resistance-conferring mutations in the acetylcholinesterase in Chinese house fly populations[J]. Acta Parasitol Med Entomol Sin, 2023, 30(1): 46-50. DOI:10.3969/j.issn.1005-0507.2023.01.008 |
 2024, Vol. 35
2024, Vol. 35


