扩展功能
文章信息
- 陈秋, 何贤海, 孟娇, 吴胜春, 唐继霞, 林祉君, 余福勋, 江佳富, 孙毅, 曹务春, 詹琳, 周远忠
- CHEN Qiu, HE Xian-hai, MENG Jiao, WU Sheng-chun, TANG Ji-xia, LIN Zhi-jun, YU Fu-xun, JIANG Jia-fu, SUN Yi, CAO Wu-chun, ZHAN Lin, ZHOU Yuan-zhong
- 贵州省罗甸县山羊体表寄生蜱携带柯克斯体属细菌的基因特征分析
- Analysis of genetic characteristics of Coxiella carried by parasitic ticks on goat body surface in Luodian County, Guizhou Province, China
- 中国媒介生物学及控制杂志, 2024, 35(4): 417-421
- Chin J Vector Biol & Control, 2024, 35(4): 417-421
- 10.11853/j.issn.1003.8280.2024.04.006
-
文章历史
- 收稿日期: 2023-11-27
2 德江县农业农村局动物疫病预防控制中心, 贵州 铜仁 565299;
3 贵州医科大学公共卫生与健康学院, 环境污染与疾病监控教育部重点实验室, 贵州 贵阳 550025;
4 贵州大学, 贵州 贵阳 550025;
5 国家卫生健康委肺脏免疫性疾病诊治重点实验室(贵州省人民医院), 贵州 贵阳 550002;
6 军事科学院军事医学研究院, 北京 100001;
7 贵州省高等学校孕妇儿童健康与暴露科学重点实验室, 贵州 遵义 563006
2 Animal Disease Prevention and Control Center of Dejiang County Agriculture and Rural Bureau, Tongren, Guizhou 565299, China;
3 School of Public Health, the Key Laboratory of Environmental Pollution Monitoring and Disease Control, Ministry of Education, Guizhou Medical University, Guiyang, Guizhou 550025, China;
4 Guizhou University, Guiyang, Guizhou 550025, China;
5 NHC Key Laboratory of Pulmonary Immune-related Diseases, Guizhou Provincial People's Hospital, Guiyang, Guizhou 550002, China;
6 Academy of Military Medicine, Academy of Military Sciences, Beijing 100001, China;
7 Key Laboratory of Maternal & Child Health and Exposure Science of Guizhou Higher Education Institutes, Zunyi, Guizhou 563006, China
柯克斯体属(Coxiella)是一种可导致人类机会性感染的蜱传细菌性病原体,包括贝氏柯克斯体(C. burnetii)、马氏柯克斯体(Candidatus Coxiella mudrowiae)、柯克斯体共生菌(Coxiella-like endosymbionts)等[1]。贝氏柯克斯体具有致病性高、抵抗力强、易存储、易播散等特征,可导致人Q热发生或暴发流行[2]。2019年我国珠海市暴发Q热疫情,其传染源可能为当地感染贝氏柯克斯体的山羊[3]。柯克斯体共生菌与贝氏柯克斯体亲缘关系较近,在与宿主蜱长期共生关系中,可向贝氏柯克斯体进化并感染脊椎动物[4]。Chisu等[5]研究表明柯克斯体共生菌可能与人类菌血症有关。马氏柯克斯体同贝氏柯克斯体进化关系较远,现流行于中国的嗜群血蜱(Haemaphysalis concinna)等媒介蜱种中,参与能量代谢、胞间囊泡形成、受体细胞识别等生理过程。尽管对马氏柯克斯体的自然感染状况及其流行病学意义尚不得而知,但其在探究柯克斯氏体家族进化以及贝氏柯克斯体起源中具有重要的科学价值[6]。蜱传疾病是全球范围内新兴的公共卫生问题之一,对蜱携带的微生物进行调查是制定有效的蜱及蜱传疾病控制策略的先决条件。
高通量测序技术通过对生物样本中所有微生物DNA或RNA扩增,并与数据库中序列信息对比分析,可帮助研究人员识别已知病原体和发现完全未知的病原体[7]。与传统的病原体分离培养和基因及血清学诊断技术相比,高通量测序技术在筛查病原微生物方面,更具有全面性、广泛性和预见性等优点[8]。
贵州省具有独特的喀斯特地貌,是蜱的适应栖息地之一[9],曾报道过Q热病例[10];另外,柯克斯体属细菌潜在的健康风险是目前调查的主要关注点[6]。本研究从罗甸县收集山羊体表寄生蜱,运用分子生物学方法调查其携带的柯克斯体属细菌的基本情况,为贵州省的蜱媒疾病的预防和控制提供一定的本底数据。
1 材料与方法 1.1 蜱样本收集2021年9月和2022年1月,从贵州省罗甸县大关村散养山羊体表采集寄生蜱66只。
1.2 蜱DNA提取将前期采集到的蜱用无菌磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗3次,单只放于1.5 ml的离心管中,先用75%乙醇溶液清洗3次,再用无菌PBS清洗。加入210 µl无菌PBS缓冲液,用电动组织研磨器研磨蜱组织,制成悬液。依据西安天隆科技有限公司的qEx-DNA/RNA核酸提取试剂盒说明书对蜱组织悬液进行DNA提取。
1.3 蜱种鉴定参照邓国藩等[11]对蜱种进行初步鉴定,同一蜱种随机抽取2~3只,采用蜱种鉴定特异性引物进行分子生物学鉴定[12]。
1.4 高通量测序根据公司送样要求,每只蜱取5 µl DNA进行混样。然后将混样之后的标本送生工生物工程(上海)股份有限公司。采用Nanopore三代测序技术对标本进行高通量测序,引物序列为8F(5′-AGAGTTTGATCATGGCTCAG-3')和1492R(5′-CGGTTACCTTGTTACGACTT-3'),然后使用Kraken2数据库对获得的每一条序列进行物种注释,并统计物种数目构建操作分类单元(operational taxonomic units,OTU)表,然后根据OTU表挑选出对应的序列在美国国立生物技术信息中心(NCBI)上进行基于局部比对算法的搜索工具(BLAST)比对分析获得的柯克斯体属的序列。
1.5 PCR验证参考柯克斯体属的16S rRNA基因选择引物[13],扩增目的片段为680~710 bp,PCR反应体系为:Taq DNA polymerase 0.125 µl,10×PCR buffer 2.5 µl,dNTP(10 mmol/L)2 µl,上下游引物各0.5 µl(10 µmol/L),DNA模板1 µl,双蒸水补足体积,终体积为25 µl。扩增程序为95 ℃ 3 min;95 ℃ 30 s,52 ℃ 30 s,72 ℃ 45 s,35个循环;72 ℃ 5 min。扩增结束取5 µl的PCR扩增产物经1.5%琼脂糖凝胶电泳,凝胶成像仪观察结果。本实验使用的阴性对照为双蒸水,阳性对照为柯克斯体属PCR阳性DNA。出现目的条带为阳性,选取部分阳性扩增产物送至深圳华大基因股份有限公司测序。使用Vector NTI 11.5软件中的Align X分析从高通量测序获得的属于柯克斯体属的序列与PCR阳性样本DNA序列之间的差异。
1.6 遗传进化分析从NCBI的GenBank数据库中选择与柯克斯体属16S rRNA基因同源性最高的序列和其他不同种的对应序列,通过MEGA 7.0软件中Bootstrap Test of Phylogeny项目下的neighbor-joining法构建系统发育树,分析本研究获得的柯克斯体属序列的遗传进化特点。
2 结果 2.1 蜱种鉴定通过形态学和分子生物学方法确认本次共采集到63只长角血蜱(Ha. longicornis)和3只微小扇头蜱(Rhipicephalus microplus),长角血蜱的基因登录号为OQ568709,微小扇头蜱的基因登录号为OQ568714。
2.2 高通量测序本次扩增子测序获得的原始数据已上传到序列读取归档(sequence read archive,SRA)数据库,对应的序列号为SRR28055682。经生物信息学分析共获得17条柯克斯体属细菌16S rRNA序列。高通量数据库中获得的17条16S rRNA序列经BLAST后,获得了90%以上相近的序列。见表 1。
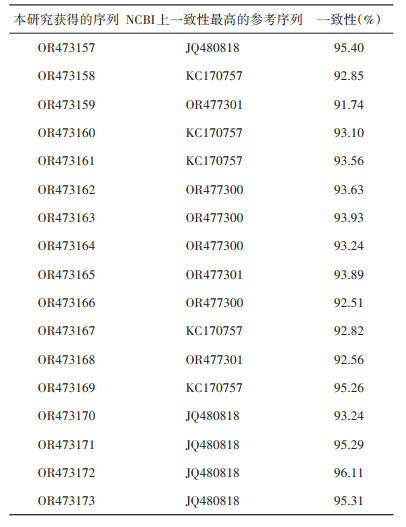
|
在66份蜱样本中共有19份出现目的条带,总阳性率为28.78%,选取6份条带扩增较好样本送测序,仅有3份双向测序拼接成功并确认是柯克斯体属细菌。通过Vector NTI 11.5软件中的Align X进行多序列分析发现高通量测序获得的17条序列的一致性83.00%~96.00%,其中OR473157与OR473170~OR473173的一致性 > 90.00%,OR473158~OR473169间的一致性 > 90.00%。3个PCR扩增序列(LD14-4、LD14-14、LD28-1,683 bp)一致性均为100%,与本研究高通量测序获得序列一致性最高的是OR473159(97.00%),最低的是OR473157(89.00%)。见图 1。
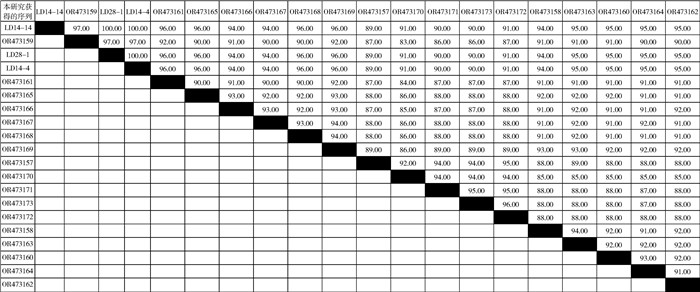
|
| 注:LD14-4、LD14-14、LD28-1为PCR阳性样本的序列(683 bp);OR473157~OR473173为高通量测序获得的柯克斯体属细菌的序列(1 394~1 490 bp)。 图 1 贵州省罗甸县蜱携带柯克斯体属16S rRNA序列之间的一致性分析 Figure 1 Identity analysis of 16S rRNA sequences of Coxiella carried by ticks in Luodian County, Guizhou Province |
| |
在NCBI上选取与柯克斯体共生菌16S rRNA基因同源性最高的序列和同属种类序列,并以Rickettsiella共生菌为外群构建进化树。本研究通过高通量测序获得的柯克斯体属16S rRNA序列(基因登录号:OR473157)与分离自以色列的柯克斯体共生菌(基因登录号:JQ480818)属于同一分支,PCR测序获得的柯克斯体共生菌(LD14-4)和高通量测序获得的柯克斯体共生菌(基因登录号:OR473159)与分离自泰国的柯克斯体共生菌(基因登录号:KC170759)位于同一分支,遗传进化关系较近,而与分离自南非(基因登录号:CP094378)和中国台湾(基因登录号:MZ836864)的柯克斯体共生菌不在同一分支,遗传进化关系较远。见图 2。
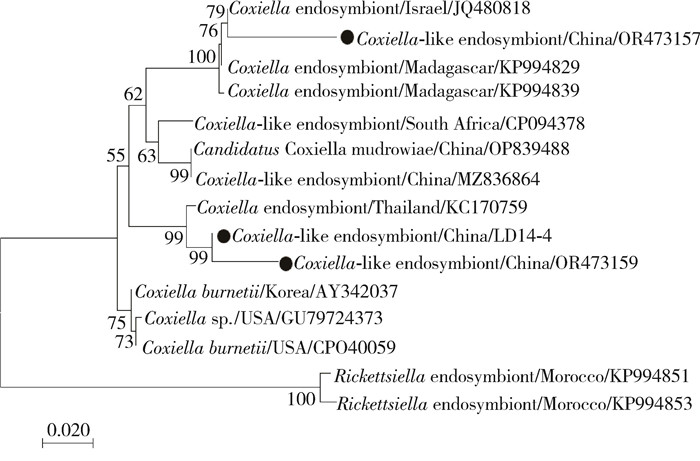
|
| 注:●为本研究获得的序列。 图 2 贵州省罗甸县蜱携带柯克斯体属细菌16S rRNA的系统发育树分析 Figure 2 Phylogenetic tree based on 16S rRNA of Coxiella carried by ticks in Luodian County, Guizhou Province |
| |
Q热的病原体(贝氏柯克斯体)被美国疾病预防控制中心归类为B类生物恐怖剂[13]。全球暂未研究出高效安全的Q热疫苗[14]。2020年李军等[15]在广西壮族自治区(广西)南宁市进行了Q热的血清流行病学调查,发现牛、羊血清的Q热抗体阳性率分别为14.50%和26.50%。
本研究通过高通量测序技术对与广西接壤的罗甸县山羊体表寄生蜱携带的细菌进行了调查,并对发现的柯克斯体属的序列进行了综合分析。结果表明本研究获得的细菌为柯克斯体共生菌,而柯克斯体共生菌和Q热的病原体之间有着密切的联系,Duron等[16]通过全基因组测序数据和多位点系统发育分析发现所有已知的贝氏柯克斯体都起源于柯克斯体共生菌。Thanchomnang等[17]提出携带柯克斯体共生菌的蜱更可能携带埃立克体或无形体。蜱及其携带的柯克斯体属细菌存在共分化[18],李兰花[19]发现降低柯克斯体共生菌含量与镰形扇头蜱(Rh. haemaphysaloides)和长角血蜱孤雌株的繁殖力下降有关。
本研究获得的蜱体内柯克斯体共生菌16S rRNA基因的核苷酸一致性在83%~96 %,表明其具有遗传多样性。PCR测序结果与高通量测序结果存在差异,其原因可能是传统PCR扩增的检测鉴定能力局限,而高通量测序识别鉴定的病原谱更广泛。
本研究存在的局限性:第一,由于受采样数量、地区和季节等的局限,本研究所获得的蜱种仅有长角血蜱和微小扇头蜱且数量较少,且有一部分饱血蜱,在饱血蜱中检测出的细菌有可能来自宿主动物。第二,本实验获得的柯克斯体共生菌的基因序列多态性较高,但本研究是把蜱DNA进行混样之后再进行扩增子测序,无法追溯其与采集时间、吸血状态及蜱种之间的关联性。第三,本实验以电泳出现目的条带来计算柯克斯体共生菌的阳性率,因PCR反应受多种条件的限制,例如DNA样品的新鲜程度,且Sanger测序对样品的浓度要求较高等。尽管研究中选取了6份扩增条带较好的样本送测序,但仅有3份测序成功,有可能存在假阴性。
综上所述,本研究对贵州省罗甸县山羊体表寄生蜱携带的柯克斯体共生菌的基因序列进行了分析,发现存在基因多态性,其致病性及公共卫生意义还待进一步研究。
志谢 贵州省人民医院中心实验室老师、师姐们对课题给予支持,罗甸县村民们配合和协助样本采集,一并志谢利益冲突 无
| [1] |
Lu M, Tang GP, Ren ZQ, et al. Ehrlichia, Coxiella and Bartonella infections in rodents from Guizhou Province, southwest China[J]. Ticks Tick Borne Dis, 2022, 13(5): 101974. DOI:10.1016/j.ttbdis.2022.101974 |
| [2] |
熊小路, 焦俊, 温博海. 加强我国Q热的防控[J]. 寄生虫与医学昆虫学报, 2020, 27(4): 258-263. Xiong XL, Jiao J, Wen BH. Strengthen the prevention and control of Q fever in China[J]. Acta Parasitol Med Entomol Sin, 2020, 27(4): 258-263. DOI:10.3969/j.issn.1005-0507.2020.04.011 |
| [3] |
Huang MX, Ma JM, Jiao J, et al. The epidemic of Q fever in 2018 to 2019 in Zhuhai City of China determined by metagenomic next-generation sequencing[J]. PLoS Negl Trop Dis, 2021, 15(7): e0009520. DOI:10.1371/journal.pntd.0009520 |
| [4] |
卢志宇, 付梦姣, 熊进峰, 等. 湖北省东北部地区蜱携立克次体的调查[J]. 军事医学, 2021, 45(4): 262-266. Lu ZY, Fu MJ, Xiong JF, et al. Investigation of rickettsiae in ticks from the northeast of Hubei Province[J]. Mil Med Sci, 2021, 45(4): 262-266. DOI:10.7644/j.issn.1674-9960.2021.04.005 |
| [5] |
Chisu V, Mura L, Foxi C, et al. Coxiellaceae in ticks from Human, domestic and wild hosts from Sardinia, Italy: High diversity of Coxiella-like endosymbionts[J]. Acta Parasitol, 2021, 66(2): 654-663. DOI:10.1007/s11686-020-00324-w |
| [6] |
Shi MJ, Qin T, Liu ZT, et al. Molecular detection of Candidatus Coxiella mudorwiae in Haemaphysalis concinna in China[J]. Zoonoses, 2022, 2: 39. DOI:10.15212/ZOONOSES-2022-0041 |
| [7] |
孙璐. 宏基因组生物信息学分析方法[J]. 青海畜牧兽医杂志, 2022, 52(1): 64-67, 69. Sun L. Metagenomic bioinformatics analysis method[J]. Chin Qinghai J Anim Vet Sci, 2022, 52(1): 64-67, 69. DOI:10.3969/j.issn.1003-7950.2022.01.016 |
| [8] |
姚佳玲, 陈兆国, 龚海燕. 几种动物来源的蜱携带的细菌和原虫的检测[J]. 中国动物传染病学报, 2021, 29(3): 107-113. Yao JL, Chen ZG, Gong HY. Investigation of tick harbored bacteria and protoza from several animal species[J]. Chin J Vet Parasitol, 2021, 29(3): 107-113. DOI:10.19958/j.cnki.cn31-2031/s.2021.03.016 |
| [9] |
向昱龙, 周敬祝, 刘英, 等. 贵州省部分地区蜱及其携带细菌调查[J]. 中国媒介生物学及控制杂志, 2022, 33(1): 148-152. Xiang YL, Zhou JZ, Liu Y, et al. An investigation of ticks and tick-borne bacteria in some areas of Guizhou Province, China[J]. Chin J Vector Biol Control, 2022, 33(1): 148-152. DOI:10.11853/j.issn.1003.8280.2022.01.027 |
| [10] |
El-Mahallawy HS, Lu G, Kelly P, et al. Q fever in China: A systematic review, 1989-2013[J]. Epidemiol Infect, 2015, 143(4): 673-681. DOI:10.1017/S0950268814002593 |
| [11] |
邓国藩, 姜在阶. 中国经济昆虫志 第三十九册 蜱螨亚纲 硬蜱科[M]. 北京: 科学出版社, 1991: 34-43. Deng GF, Jiang ZJ. Economic insect fauna of China. Fasc. 39 (Acari: Ixodidae)[M]. Beijing: Science Press, 1991: 34-43. |
| [12] |
孟娇, 陈醒醒, 张霞, 等. 贵阳市乌当区宠物中心犬体表寄生血红扇头蜱检出劳氏立克次体[J]. 中国媒介生物学及控制杂志, 2022, 33(4): 536-542. Meng J, Chen XX, Zhang X, et al. Detection of Rickettsia raoultii in Rhipicephalus sanguineus parasitized on the body surfaces of dogs in pet centers in Wudang District, Guizhou, China[J]. Chin J Vector Biol Control, 2022, 33(4): 536-542. DOI:10.11853/j.issn.1003.8280.2022.04.018 |
| [13] |
何培圣. 我国部分地区蜱和鼠类携带贝氏柯克斯体的基因分型研究[D]. 合肥: 安徽医科大学, 2023. DOI: 10.26921/d.cnki.ganyu.2023.001710. He PS. Genotyping of Coxiella burnetii carried by ticks and rats in some regions in China[D]. Hefei: Anhui Medical University, 2023. DOI: 10.26921/d.cnki.ganyu.2023.001710.(inChinese) |
| [14] |
张培培, 王毓秀, 孙翔翔. Q热病原学和流行病学特点及其防控[J]. 中国动物检疫, 2021, 38(1): 81-86. Zhang PP, Wang YX, Sun XX. Etiological and epidemiological characteristics of Q fever and its prevention and control[J]. China Anim Health Insp, 2021, 38(1): 81-86. DOI:10.3969/j.issn.1005-944X.2021.01.017 |
| [15] |
李军, 吴翠兰, 陶飞, 等. 广西部分地区牛羊三种人兽共患病的血清学调查与分析[J]. 黑龙江畜牧兽医, 2020(4): 66-70. Li J, Wu CL, Tao F, et al. Serological investigation and analysis of three zoonoses in cattle and sheep in some areas of Guangxi[J]. Heilongjiang Anim Sci Vet Med, 2020(4): 66-70. DOI:10.13881/j.cnki.hljxmsy.2019.03.0232 |
| [16] |
Duron O, Noël V, McCoy KD, et al. The recent evolution of a maternally-inherited endosymbiont of ticks led to the emergence of the Q fever pathogen, Coxiella burnetii[J]. PLoS Pathog, 2015, 11(5): e1004892. DOI:10.1371/journal.ppat.1004892 |
| [17] |
Thanchomnang T, Rodpai R, Thinnabut K, et al. Characterization of the bacterial microbiota of cattle ticks in northeastern Thailand through 16S rRNA amplicon sequencing[J]. Infect, Genet Evol, 2023, 115: 105511. DOI:10.1016/j.meegid.2023.105511 |
| [18] |
Tian JH, Hou X, Ge MH, et al. The diversity and evolutionary relationships of ticks and tick-borne bacteria collected in China[J]. Parasit Vectors, 2022, 15(1): 352. DOI:10.1186/s13071-022-05485-3 |
| [19] |
李兰花. 腾冲市蜱媒传播田鼠巴贝虫研究[D]. 北京: 中国疾病预防控制中心, 2016. Li LH. Transmission of Babesia microti by ticks in Tengchong[D]. Beijing: Chinese Center for Disease Control and Prevention, 2016. (in Chinese) |
 2024, Vol. 35
2024, Vol. 35


