扩展功能
文章信息
- 刘晓伟, 周松, 王启盟, 白雪薇, 王海峰, 申小娜, 张懿晖, 闫东, 杨顺林, 候芝林, 杜越聪, 栗晓芳, 杜国义, 刘合智
- LIU Xiao-wei, ZHOU Song, WANG Qi-meng, BAI Xue-wei, WANG Hai-feng, SHEN Xiao-na, ZHANG Yi-hui, YAN Dong, YANG Shun-lin, HOU Zhi-lin, DU Yue-cong, LI Xiao-fang, DU Guo-yi, LIU He-zhi
- 基于16S rDNA的河北省鼠疫自然疫源地自毙艾鼬携带病原菌研究
- 16S rDNA analysis of a pathogen carried by a naturally dead Mustela eversmanii at natural plague foci of Hebei Province
- 中国媒介生物学及控制杂志, 2024, 35(4): 389-393
- Chin J Vector Biol & Control, 2024, 35(4): 389-393
- 10.11853/j.issn.1003.8280.2024.04.001
-
文章历史
- 收稿日期: 2024-02-02
2 中国疾病预防控制中心传染病预防控制所, 北京 102206;
3 中国人民解放军陆军第八十一集团军医院, 河北 张家口 075000
2 National Institute for Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China;
3 Hospital of the PLA 81st Group Army, Zhangjiakou, Hebei 075000, China
艾鼬(Mustela eversmanni)属于鼬科(Mustelidae)鼬属,主要以啮齿动物鼠类为食物,是河北省鼠疫自然疫源地中分布广泛、数量较多的小型食肉兽类,也是控制鼠类蔓延、预防鼠传疾病流行的重要自然因素之一,对农牧业和草原鼠害控制具有重要作用。2020年从河北省鼠疫自然疫源地自毙艾鼬的肝、脾等脏器标本中均分离到同1株纯的未知病原菌,该菌株在光学显微镜下观察,为卵圆形、两端浓染的革兰阴性短小杆菌,与鼠疫耶尔森菌(Yersinia pestis,鼠疫菌)的菌体形态相似,但通过鼠疫细菌学一般检验程序排除了鼠疫菌的可能性。而近几年随着分子生物学技术的不断进步,尤其是DNA测序技术的快速发展和逐渐完善,通过DNA测序方法鉴定菌种目前已成为病原菌菌种鉴定的金标准,成为现代生物学研究中重要的手段之一[1]。16S rDNA存在于所有细菌染色体基因组中,是细菌进化过程中最为保守的基因。由于其分子大小适中,长度约1 540 bp,且突变率小,是细菌系统分类学研究中最为常用、最有用的“分子钟”,常被用作细菌种属鉴定的靶基因。因此,本研究拟应用16S rDNA测序技术对其进行鉴定分析,鉴别结果对未来河北省有针对性的动物疾病防制以及后续鼠疫自然疫源地内自毙动物携带未知病原菌的研究具有实际应用意义。
1 材料与方法 1.1 材料来源2020年4月,在河北省鼠疫自然疫源地康保牧场开展鼠疫常规踏查工作时,搜捡到1只自毙艾鼬,并分离到1株未知病原菌,编号为202001,封存于磁珠保菌管中,-20 ℃冷冻保存,待鉴定。
1.2 主要仪器和试剂自动核酸提取仪(tacoTM mini,金瑞鸿捷生物科技有限公司)、PCR扩增仪[TC-96/G/H(b)C,杭州博日科技股份有限公司]、琼脂糖水平电泳仪(DYCP-31DN,北京六一生物科技有限公司)、紫外透射仪(BG-gdsUVIEW,北京百晶生物技术有限公司)、凝胶成像分析系统(GBox F3,基因有限公司)。预分装DNA/RNA核酸共同提取试剂盒购自厦门普康同创生物科技有限公司;2×EasyTaq® PCR SuperMix(-dye)、6×loading buffer购自北京全式金生物技术股份有限公司;D2000 DNA Marker购自天根生化科技有限公司;琼脂糖购自西班牙biowest公司;磁珠法胶回收试剂盒购自上海硕美生物科技有限公司。
1.3 方法 1.3.1 鼠疫细菌学检验按照鼠疫病原学常规检测方法操作,无菌采集自毙艾鼬的腺、肝、脾、肺、心等脏器组织进行显微镜检查、分离培养和鼠疫噬菌体裂解试验[2-3]。(1)显微镜检查:将脏器标本分别压印涂片2张,晾干后浸在95%酒精固定液中固定5~10 min,取出晾干,分别用革兰染液和美蓝染液进行染色。(2)分离培养:将脏器标本分别压印在亚硫酸钠琼脂培养基上,连续划线后于28 ℃培养24 h,观察细菌的生长状况及菌落特征。(3)鼠疫噬菌体裂解试验:将脏器标本分别压印在亚硫酸钠琼脂培养基上,连续密集划线,然后在划线一侧滴加鼠疫噬菌体1滴,倾斜平皿,使其垂直流过划线,于28 ℃培养24 h观察结果。
1.3.2 细菌DNA模板的提取参照试剂盒说明书,使用磁珠法预分装DNA/RNA核酸共同提取试剂盒提取202001号菌株核酸,并于-20 ℃保存备用。
1.3.3 16S rDNA的PCR扩增所用16S rDNA引物由北京睿博兴科生物技术有限公司设计,引物序列信息见表 1。PCR反应体系为30 μl:2×EasyTaq® PCR SuperMix 15 μl,正、反向引物各1 μl,DNA模板1 μl,无菌ddH2O 12 μl。PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸90 s,25个循环;72 ℃延伸7 min。
PCR扩增产物在1.5%琼脂糖凝胶上电泳,将单一清晰的目标条带通过D2000 DNA Marker初步核对其大小,再使用磁珠法胶回收试剂盒对其进行纯化回收。回收产物送至北京睿博兴科生物技术有限公司进行双向测序,获得拼接后的序列数据。
1.3.5 序列分析登录美国国立生物技术信息中心(NCBI)网站,应用基于局部比对算法的搜索工具(BLAST)将202001号菌株的16S rDNA序列与基因库中已知核苷酸序列进行同源性比对分析,选取同源性较高的10个核苷酸序列,利用MEGA 11.0软件基于邻接(neighbor-joining,NJ)法构建系统发育树,并分析其进化关系,节点的置信度检验采用bootstrap分析(1 000个循环)[4-6]。
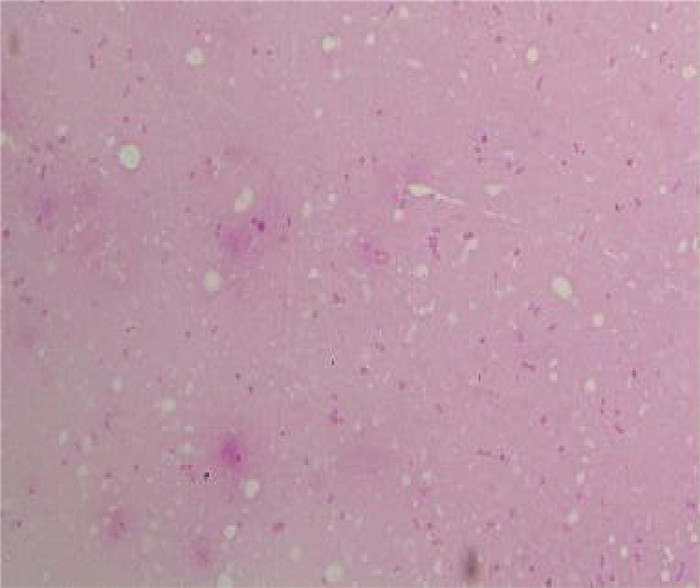
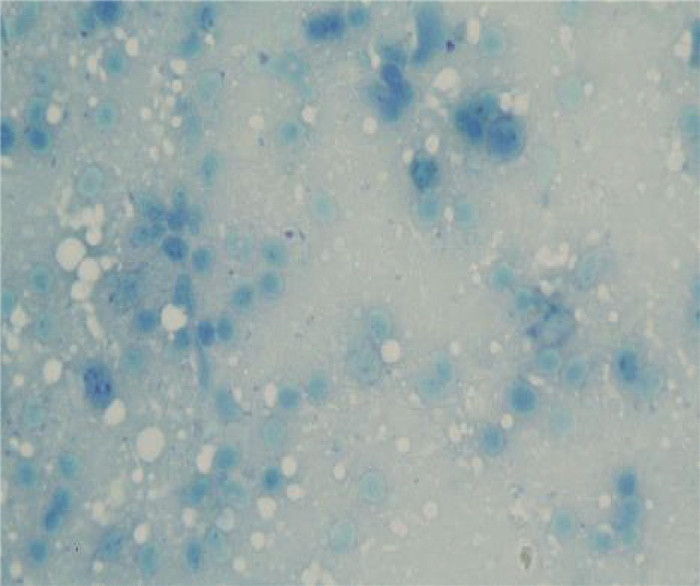
2 结果 2.1 鼠疫细菌学检验结果 2.1.1 显微镜检查用自毙艾鼬各脏器涂片镜检,在光学显微镜的油镜下可观察到革兰染色呈红色(图 1),美蓝染色呈蓝色(图 2),中段膨大,两端钝圆,两极浓染的卵圆形短小杆菌。
|
| 图 1 革兰染色(×1 000) Figure 1 Gram staining (×1 000) |
| |
|
| 图 2 美蓝染色(×1 000) Figure 2 Methylene blue staining (×1 000) |
| |
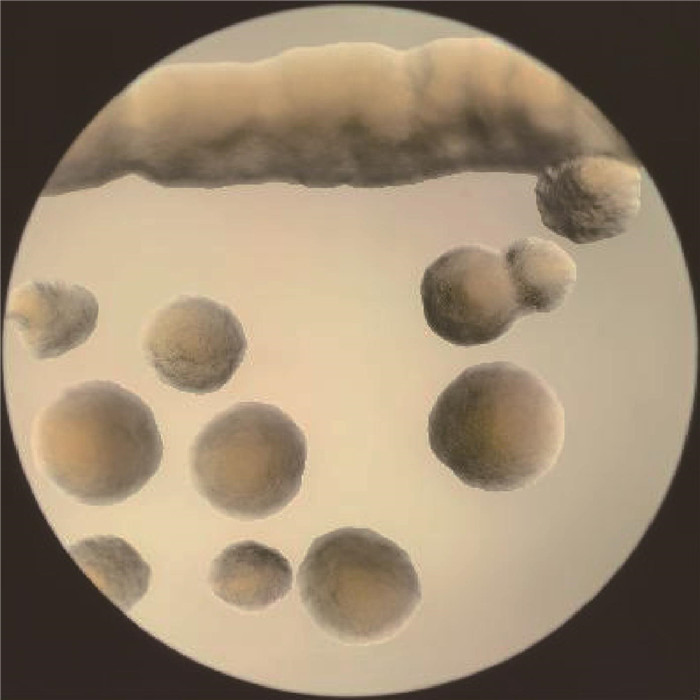
该菌可在肝、脾、肺、心脏器压印的亚硫酸钠琼脂培养基上生长良好,低倍镜下可观察到表面光滑、边缘整齐、湿润、淡灰色菌落。见图 3。
|
| 图 3 菌落形态(×40) Figure 3 Colony morphology (×40) |
| |
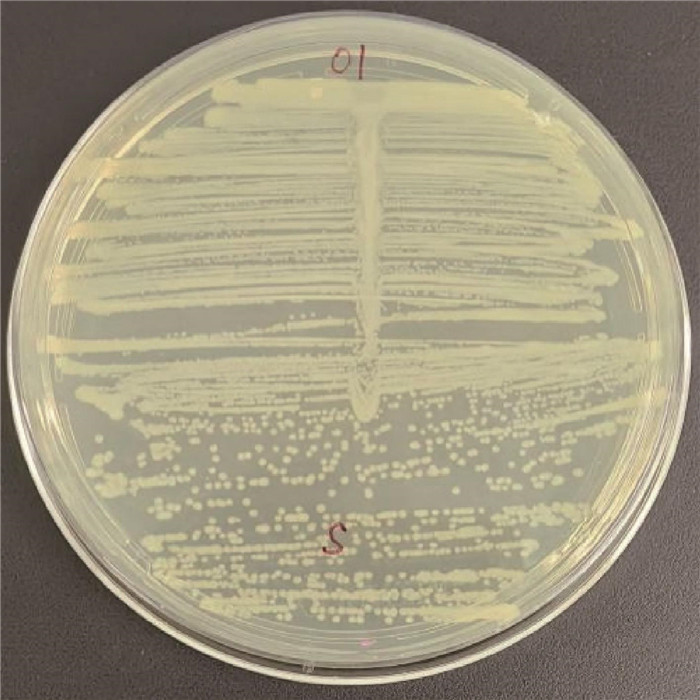
28 ℃培养24 h后,均未观察到“噬菌带”,鼠疫噬菌体裂解试验为阴性。见图 4。
|
| 图 4 鼠疫噬菌体裂解试验 Figure 4 Yersinia pestis bacteriophage lysis test |
| |
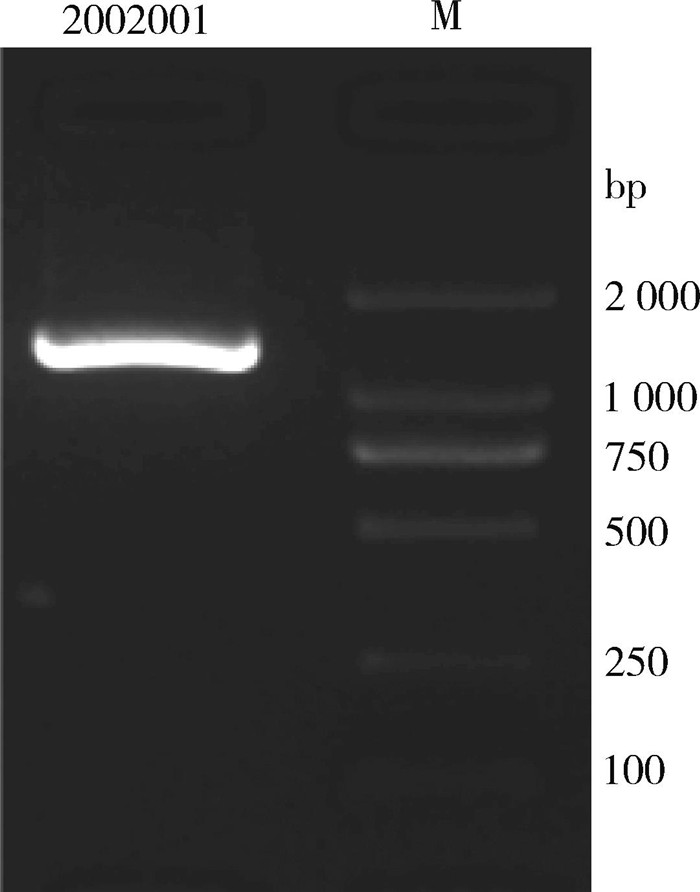
对202001号菌株的16S rDNA基因片段进行PCR扩增后,以1.5%琼脂糖凝胶电泳观察,在1 500 bp左右处得到1条明亮的目标条带,与预期的结果相符合。见图 5。
|
| 图 5 202001号菌16S rDNA PCR扩增产物的琼脂糖凝胶电泳图 Figure 5 Agarose gel electrophoresis of PCR amplification product of 16S rDNA gene of strain 202001 |
| |
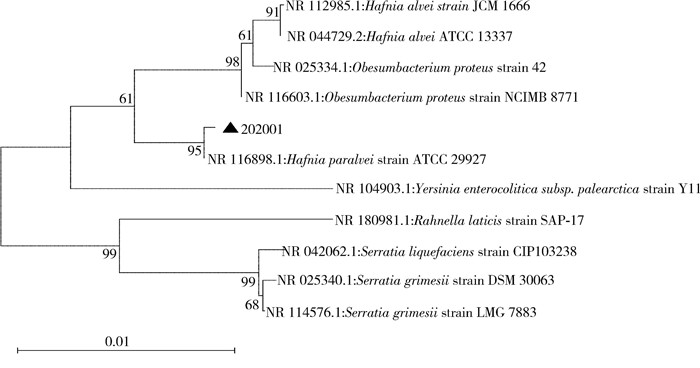
将202001号菌株的PCR扩增阳性条带纯化回收后进行序列测定,得到1条核苷酸长度为1 432 bp的16S rDNA序列,该序列已上传至NCBI数据库,注册号为OR911995。经BLAST比对分析,该菌的16S rDNA序列与GenBank中序列号为NR116898的基因同源性最高,为99.51%。系统发育树结果显示,202001号菌株与副蜂房哈夫尼亚菌(Hafnia paralvei)处于系统发育树同一进化分支上。见图 6。
|
| 注:▲为本研究分离到的菌株。 图 6 202001号菌基于邻接法构建的系统发育树 Figure 6 Phylogenetic tree of strain 202001 constructed using neighbor-joining method |
| |
河北省鼠疫自然疫源地位于张家口市康保县境内,地处冀蒙边境,疫源地面积约1 000 km2[7],属于内蒙古高原长爪沙鼠(Meriones unguiculatus)鼠疫自然疫源地的一部分,近年来这一区域动物间鼠疫疫情非常活跃,波及到人间的风险较大[8-11]。河北省自1971年12月26日检出第1株鼠疫菌以来,至今共发生过5次动物间鼠疫流行[12-14]。鼠疫常规监测中经常会发现不明原因自毙动物,自毙动物的发现是动物间鼠疫流行的早期迹象,检出鼠疫菌概率较高,白雪薇等[15]研究发现,河北省鼠疫自然疫源地内自毙鼠检出鼠疫菌构成比高达92.25%,对其鉴定主要依靠鼠疫细菌学一般检验程序,但是这些方法对于自毙动物携带的其他未知病原菌鉴定存在一定困难。鼠类和其他动物作为很多自然疫源性疾病的天然储存宿主,其携带病原菌数超过200种,其中70种可引起人类常见、新发及再发传染病[16-18],如鼠疫、恙虫病、肾综合征出血热等,极易造成鼠传疾病的流行与传播,严重威胁人类的身体健康和生命安全。
哈夫尼亚菌属仅有1个种,即蜂房哈夫尼亚菌(H. alvei),然而DNA-DNA杂交技术及16S rDNA测序结果显示蜂房哈夫尼亚菌存在遗传异质性,常由蜂房哈夫尼亚菌生物群Ⅰ和蜂房哈夫尼亚菌生物群Ⅱ组成。其中蜂房哈夫尼亚菌对应于蜂房哈夫尼亚菌生物群Ⅰ,而副蜂房哈夫尼亚菌对应于蜂房哈夫尼亚菌生物群Ⅱ。副蜂房哈夫尼亚菌为革兰阴性杆菌,致病机理及其在感染中的作用尚不明确,属条件致病菌。近年来,国内外有关副蜂房哈夫尼亚菌的研究少有报道,仅2011年Osuka等[19]在日本1名85岁菌血症男性患者血液中分离到该菌;2019年Zhang等[20]在我国野生太行山猕猴粪便中分离到该菌。基于16S rDNA基因序列的系统发育树中各菌种内各聚为一支,形成独立进化支,202001号菌株与副蜂房哈夫尼亚菌聚合在一起,置信度为95%,表明16S rDNA基因是一个可以有效进行鉴定的标准基因。通过鼠疫细菌学一般检验程序和16S rDNA测序技术对202001号菌株进行鉴定,不仅为未知病原菌菌种的准确鉴定和亲缘关系分析提供了技术支持,也为今后鼠疫自然疫源地内自毙动物的进一步研究奠定了基础。
本研究自河北省鼠疫自然疫源地自毙艾鼬体内成功分离到副蜂房哈夫尼亚菌尚属首次,对鼠类天敌艾鼬的物种保护性研究具有十分重要的生物学意义,对鼠疫自然疫源地内未知病原菌的鉴定有良好的应用前景。但本研究还存在一定的局限性,例如分离到副蜂房哈夫尼亚菌株的数量有限、对人类或动物的致病性还不清楚等。因此,在鼠疫常规监测中应加强对自毙动物的长期动态监测,进一步分离更多的副蜂房哈夫尼亚菌进行实验研究,对其表型特征、基因型特征进行深入研究,以期全面了解该菌在河北省鼠疫自然疫源地的分布特点和流行动态。
利益冲突 无
| [1] |
王美霞, 李宏, 李珏, 等. 不同16S rRNA片段长度在微生物鉴定中鉴定能力的比较研究[J]. 中国现代应用药学, 2022, 39(21): 2894-2900. Wang MX, Li H, Li J, et al. Comparative study on the identification ability of different length of 16S rRNA fragments in microbial identification[J]. Chin J Mod Appl Pharm, 2022, 39(21): 2894-2900. DOI:10.13748/j.cnki.issn1007-7693.2022.21.028 |
| [2] |
卫生部卫生应急办公室, 中国疾病预防控制中心. 鼠疫防控应急手册[M]. 北京: 北京大学医学出版社, 2009: 243-246. Health Emergency Office of the Ministry of Health, Chinese Center for Disease Control and Prevention. Emergency manual of prevention and control[M]. Beijing: Peking University Medical Press, 2009: 243-246. |
| [3] |
麻占军, 扎西, 陈自强, 等. 西藏自治区2014-2018年鼠疫监测结果分析[J]. 中国媒介生物学及控制杂志, 2020, 31(3): 345-349. Ma ZJ, Zha X, Chen ZQ, et al. An analysis of surveillance results of plague in Tibet Autonomous Region, China, 2014-2018[J]. Chin J Vector Biol Control, 2020, 31(3): 345-349. DOI:10.11853/j.issn.1003.8280.2020.03.020 |
| [4] |
冯娟, 达拉, 董周立, 等. 西藏口岸2017年蝇类携带病原体的检测分析[J]. 中国媒介生物学及控制杂志, 2019, 30(2): 194-196, 199. Feng J, Da L, Dong ZL, et al. Detection and analysis of pathogens carried by flies at Tibetan ports in 2017[J]. Chin J Vector Biol Control, 2019, 30(2): 194-196, 199. DOI:10.11853/j.issn.1003.8280.2019.02.018 |
| [5] |
杨志, 王康, 李冠宗, 等. 麂子源蜂房哈夫尼亚菌的分离鉴定及生物学特性[J]. 微生物学通报, 2022, 49(12): 5072-5082. Yang Z, Wang K, Li GZ, et al. Isolation, identification, and biological characterization of Hafnia alvei from a barking deer[J]. Microbiol China, 2022, 49(12): 5072-5082. DOI:10.13344/j.microbiol.china.220464 |
| [6] |
杨林狄, 贾新蕾, 黄增朝, 等. 银鼓鱼海豚链球菌的分离、鉴定及毒力基因检测[J]. 大连海洋大学学报, 2023, 38(2): 233-241. Yang LD, Jia XL, Huang ZC, et al. Isolation, identification and virulence gene detection of Streptococcus iniae in silver scat (Selenotoca multifasciata)[J]. J Dalian Ocean Univ, 2023, 38(2): 233-241. DOI:10.16535/j.cnki.dlhyxb.2022-207 |
| [7] |
杜国义, 闫东. 动物间鼠疫流行与主要宿主密度相关性研究[J]. 中国媒介生物学及控制杂志, 2019, 30(4): 442-443, 450. Du GY, Yan D. A study of the correlation between plague epidemics among animals and the density of their hosts[J]. Chin J Vector Biol Control, 2019, 30(4): 442-443, 450. DOI:10.11853/j.issn.1003.8280.2019.04.020 |
| [8] |
杜国义, 闫东, 王治宇, 等. 河北省及其周边地区鼠疫风险评估体系的构建[J]. 中国媒介生物学及控制杂志, 2019, 30(5): 574-577. Du GY, Yan D, Wang ZY, et al. Risk assessment system of plague in Hebei Province and surrounding areas[J]. Chin J Vector Biol Control, 2019, 30(5): 574-577. DOI:10.11853/j.issn.1003.8280.2019.05.023 |
| [9] |
解新霞, 南晓伟, 李月喜, 等. 内蒙古乌兰察布市四子王旗2009-2019年动物鼠疫流行特征分析[J]. 中国媒介生物学及控制杂志, 2020, 31(5): 602-606. Xie XX, Nan XW, Li YX, et al. An analysis of the epidemiological characteristics of animal plague in Siziwang Banner, Ulanqab, Inner Mongolia, China, 2009-2019[J]. Chin J Vector Biol Control, 2020, 31(5): 602-606. DOI:10.11853/j.issn.1003.8280.2020.05.020 |
| [10] |
侍文君, 万寒兵, 王肇军, 等. 内蒙古包头市2019-2020年鼠疫疫情及风险防控措施简析[J]. 中国媒介生物学及控制杂志, 2022, 33(6): 849-853. Shi WJ, Wan HB, Wang ZJ, et al. Plague epidemic and risk prevention and control measures in Baotou, Inner Mongolia, China, 2019-2020[J]. Chin J Vector Biol Control, 2022, 33(6): 849-853. DOI:10.11853/j.issn.1003.8280.2022.06.016 |
| [11] |
吴建华, 虎明明, 郑燕娟, 等. 银川市兴庆区2016-2020年鼠疫监测结果及风险分析[J]. 中国媒介生物学及控制杂志, 2022, 33(2): 258-261. Wu JH, Hu MM, Zheng YJ, et al. Plague surveillance results and risk analysis in Xingqing District, Yinchuan, China, 2016-2020[J]. Chin J Vector Biol Control, 2022, 33(2): 258-261. DOI:10.11853/j.issn.1003.8280.2022.02.017 |
| [12] |
牛艳芬, 刘合智, 张懿晖, 等. 河北省长爪沙鼠鼠疫疫源地鼠体蚤与气象因素关系分析[J]. 中国媒介生物学及控制杂志, 2021, 32(1): 41-44. Niu YF, Liu HZ, Zhang YH, et al. An analysis of the relationship between rodent fleas and meteorological factors in Meriones unguiculatus plague foci in Hebei Province, China[J]. Chin J Vector Biol Control, 2021, 32(1): 41-44. DOI:10.11853/j.issn.1003.8280.2021.01.008 |
| [13] |
兰晓宇, 鲁亮, 候芝林, 等. DNA条形码技术在河北省鼠疫疫源地常见蚤种鉴定中的应用[J]. 中国媒介生物学及控制杂志, 2020, 31(6): 662-666. Lan XY, Lu L, Hou ZL, et al. Application of DNA barcoding technique in identification of common flea species in plague foci of Hebei Province, China[J]. Chin J Vector Biol Control, 2020, 31(6): 662-666. DOI:10.11853/j.issn.1003.8280.2020.06.007 |
| [14] |
杜国义, 闫东, 史献明, 等. 河北省动物鼠疫疫情处理经验探讨[J]. 中国媒介生物学及控制杂志, 2019, 30(3): 324-326. Du GY, Yan D, Shi XM, et al. Discussion on the experience in dealing with animal plague epidemic in Hebei province, China[J]. Chin J Vector Biol Control, 2019, 30(3): 324-326. DOI:10.11853/j.issn.1003.8280.2019.03.022 |
| [15] |
白雪薇, 陈永明, 牛艳芬, 等. 河北省鼠疫自然疫源地动物鼠疫流行分布特征分析[J]. 中国媒介生物学及控制杂志, 2021, 32(3): 324-328. Bai XW, Chen YM, Niu YF, et al. Distribution characteristics of plague epidemics in animals in natural plague foci of Hebei Province, China[J]. Chin J Vector Biol Control, 2021, 32(3): 324-328. DOI:10.11853/j.issn.1003.8280.2021.03.013 |
| [16] |
刘戈, 张晖, 黄成, 等. 阿勒泰海关首次从林鼬中检出鼠疫菌F1抗体[J]. 中国国境卫生检疫杂志, 2021, 44(2): 94-96. Liu G, Zhang H, Huang C, et al. First detection of plague F1 antibody from Mustela putorius by Altay Customs[J]. Chin Frontier Health Quarantine, 2021, 44(2): 94-96. DOI:10.16408/j.1004-9770.2021.02.006 |
| [17] |
孙飞, 杨爱, 王医, 等. 河北省张家口市2011-2021年肾综合征出血热流行特征分析[J]. 中国媒介生物学及控制杂志, 2022, 33(3): 383-386. Sun F, Yang A, Wang Y, et al. Epidemiological characteristics of hemorrhagic fever with renal syndrome in Zhangjiakou, Hebei Province, China, 2011-2021[J]. Chin J Vector Biol Control, 2022, 33(3): 383-386. DOI:10.11853/j.issn.1003.8280.2022.03.013 |
| [18] |
李贵昌, 王玉姣, 母群征, 等. 北京市平谷区恙虫病自然疫源地宿主、媒介和病原体调查[J]. 中国媒介生物学及控制杂志, 2021, 32(3): 291-297. Li GC, Wang YJ, Mu QZ, et al. An investigation of the hosts, vectors, and pathogens of scrub typhus in Pinggu natural focus of Beijing, China[J]. Chin J Vector Biol Control, 2021, 32(3): 291-297. DOI:10.11853/j.issn.1003.8280.2021.03.007 |
| [19] |
Osuka H, Hitomi S, Koganemaru H, et al. A case of bacteremia caused by Hafnia paralvei[J]. J Infect Chemother, 2011, 17(6): 855-857. DOI:10.1007/s10156-011-0255-9 |
| [20] |
Zhang QX, Han SY, Liu KS, et al. Occurrence of selected zoonotic fecal pathogens and first molecular identification of Hafnia paralvei in wild Taihangshan macaques (Macaca mulatta tcheliensis) in China[J]. Biomed Res Int, 2019, 2019: 2494913. DOI:10.1155/2019/2494913 |
 2024, Vol. 35
2024, Vol. 35



