扩展功能
文章信息
- 李晋宇, 白雪峰, 闫文喆, 李轲, 汪子豪, 石圆, 鲁亮, 李贵昌, 温红玲, 赵宁, 刘起勇
- LI Jin-yu, BAI Xue-feng, YAN Wen-zhe, LI Ke, WANG Zi-hao, SHI Yuan, LU Liang, LI Gui-chang, WEN Hong-ling, ZHAO Ning, LIU Qi-yong
- 内蒙古自治区东部草原达乌尔黄鼠携带重要病原体的分布研究
- Distribution of major pathogens carried by Spermophilus dauricus in the eastern grassland of Inner Mongolia Autonomous Region, China
- 中国媒介生物学及控制杂志, 2024, 35(3): 374-380
- Chin J Vector Biol & Control, 2024, 35(3): 374-380
- 10.11853/j.issn.1003.8280.2024.03.021
-
文章历史
- 收稿日期: 2023-12-01
2 传染病溯源预警与智能决策全国重点实验室, 中国疾病预防控制中心传染病预防控制所媒介生物控制室, 世界卫生组织媒介生物监测与管理 合作中心, 北京 102206;
3 锡林郭勒盟疾病预防控制中心, 内蒙古 锡林浩特 026099;
4 南京医科大学公共卫生学院, 江苏 南京 211166
2 Department of Vector Biology and Control, National Key Laboratory of Intelligent Tracking and Forecasting for Infectious Diseases, National Institute for Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention, WHO Collaborating Centre for Vector Surveillance and Management, Beijing 102206, China;
3 Xilin Gol League Center for Disease Control and Prevention, Xilinhot, Inner Mongolia 026099, China;
4 School of Public Health, Nanjing Medical University, Nanjing, Jiangsu 211166, China
黄鼠属(Spermophilus)分为6个亚属[1],分别为:Callospermophilus、Ictidomys、Otospermophilus、Poliocitellus、Spermophilus和Xerospermophilus,但仅Spermophilus亚属[1-2]广泛分布于欧亚大陆。Spermophilus亚属在中国分布有6个种,达乌尔黄鼠(S. dauricus)是其中之一[1, 3],主要分布于包括内蒙古自治区(内蒙古)在内的中国北方、蒙古国和俄罗斯。达乌尔黄鼠是鼠疫耶尔森菌(Yersinia pestis,鼠疫菌)的重要宿主动物,在我国,达乌尔黄鼠鼠疫自然疫源地总体分为松辽平原区和察哈丘陵区[4]。此外,在中国北方的一系列啮齿动物病原体调查中,发现在不同地区以优势鼠种为主的多种啮齿动物均携带丰富的病原体[5],其中,达乌尔黄鼠可以携带巴尔通体(Bartonella)、埃立克体(Ehrlichia)和鼠疫菌等病原体[6-7],以及跳蚤等体表寄生虫[8-9]。内蒙古位于我国北部,与俄罗斯、蒙古国接壤,东部覆盖大量草原,是中国农畜产品的重要基地,而达乌尔黄鼠主要以农作物和牧草的根茎等为食,对草场破坏严重。因此,达乌尔黄鼠对人类健康和畜牧业经济均带来严重危害[10]。
为掌握中国北方草原生境下达乌尔黄鼠重要病原体自然感染情况,本研究对内蒙古东部多个样地捕获的达乌尔黄鼠样本进行病原体检测,并对其在不同月份(季节)、样地、宿主性别和宿主体表寄生虫携带状态间的差异进行分析,为当地鼠源疾病防控提供支持。
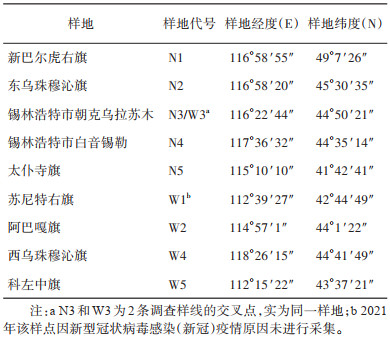
1 材料与方法 1.1 样地设置调查样地位于内蒙古7个县级行政区内,均为草原生境,属温带大陆性季风气候。由北向南(N1~N5)和由西向东(W1~W5)方向各设置5个样地。其中,N3和W3为两条调查样线的交叉点,为同一样地。见表 1。
|
分别于2021年5、7和9月在内蒙古对表 1所述样地进行3次现场调查(W1因新冠疫情未采样)。鼠夹法采用5 m夹线法,每个样地设置3条样线,样线间隔约为50 m。每条样线布放100个鼠夹(贵溪李氏鼠夹厂大号钢板鼠夹)。鼠笼法在每个样地选择较大洞群,鼠洞洞口布放50个鼠笼。鼠夹和鼠笼每次放置1天1夜,连续放置2 d。每日早、晚各检查1次鼠夹和鼠笼,记录捕鼠数。鼠夹和鼠笼的诱饵均为花生。捕获的死鼠放入鼠布袋防止寄生虫逃逸,活鼠将鼠笼一并放入鼠布袋,送回实验室麻醉后完成寄生虫收集、鼠体相关指标测量和解剖。所有样本均在当地疾病预防控制中心通过赫氏平板划线法判断为鼠疫菌阴性。
1.3 肝脏核酸提取和病原体检测 1.3.1 使用仪器RZ-Gr96高通量研磨仪(北京国科融智生物技术有限公司)、TIANLONG NP968核酸提取仪(西安天隆科技有限公司)、ND-1000分光光度计(美国Thermo NanoDrop)、Bio-Rad CFX96荧光定量PCR仪(美国伯乐)、10~1 000 μl移液器。
1.3.2 核酸提取取米粒大小黄鼠肝脏加入研磨管,加入200 µl磷酸盐缓冲液(PBS)。1 500 r/min研磨30 s暂停10 s,循环3次至匀浆状态后离心。取离心后上清液200 µl,使用病毒DNA/RNA提取试剂盒(4.0)(西安天隆科技有限公司)提取核酸用于病毒检测,QIAamp DNA纯化mini试剂盒(德国QIAGEN GmbH)提取核酸用于细菌检测。所有核酸测定浓度后于-80 ℃冰箱保存备用。
1.3.3 病原体检测使用《全国病媒生物病原学监测方案(试行)》(中疾控传发〔2020〕13号)中实时荧光定量PCR(qPCR)或反转录qPCR(RT-qPCR)法检测鼠肝脏组织中8种病原体,即莫氏立克次体(Rickettsia mooseri)、嗜吞噬细胞无形体(Anaplasma phagocytophilum)、恙虫病东方体(Orientia tsutsugamushi)、土拉弗朗西斯菌(Francisella tularensis,土拉菌)、巴尔通体(Bartonella)、致病性钩端螺旋体(Leptospira interrogans,致病性钩体)、汉坦病毒(Hantavirus)和大别班达病毒[Dabie bandavirus,DBV,曾称发热伴血小板减少综合征病毒(Severe fever with thrombocytopenia syndrome virus,SFTSV)、新布尼亚病毒(New Bunyavirus)]。引物和探针均使用《全国病媒生物病原学监测方案(试行)》中的引物和探针,由北京擎科生物科技股份有限公司合成。反应体系和反应条件参照文献[11]。
1.4 统计学分析使用Excel 2019与SPSS 26.0软件进行数据整理和统计分析。使用频数或百分比方式描述计数型资料。使用χ2检验比较不同组间达乌尔黄鼠携带各种病原体阳性率差异,P < 0.05为差异有统计学意义。
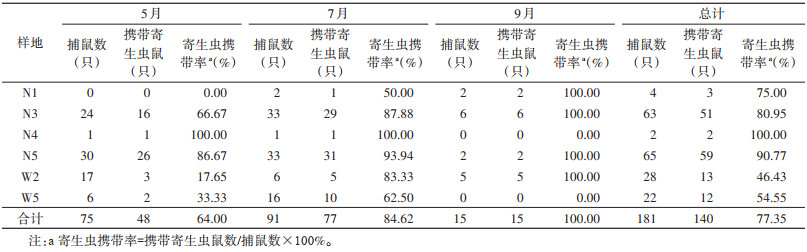
2 结果 2.1 达乌尔黄鼠捕获情况共布放12 600夹(笼)次,捕获达乌尔黄鼠181只,总捕获率为1.44%(181/12 600)。其中携带有体表寄生虫(蜱、螨、蚤)的达乌尔黄鼠140只,总寄生虫携带率为77.35%(140/181)。5(春季)、7(夏季)和9月(秋季)捕鼠数分别为75、91和15只,捕获率分别为1.79%、2.17%和0.36%;寄生虫携带率分别为64.00%、84.62%和100%。由北向南的温度样线上,N1、N3、N4和N5样地的捕鼠数分别为4、63、2和65只,携带寄生虫鼠数分别为3、51(80.95%)、2和59(90.77%)只。由西向东的降水样线上,W2、W3(N3)和W5样地的捕获数分别为28、63和22只,寄生虫携带率分别为46.43%(13/28)、80.95%(51/63)和54.55%(12/22)(表 2)。N2和W4样地未捕获达乌尔黄鼠。
|
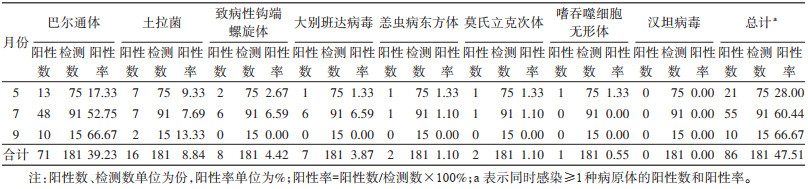
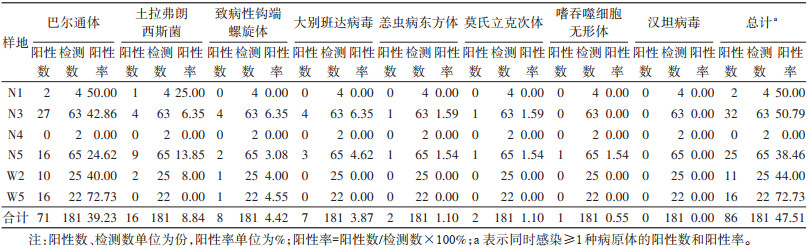
对2021年内蒙古东部草原采集的181只达乌尔黄鼠肝脏样本进行8种鼠传病原体检测。结果显示,检出病原体中巴尔通体的阳性率最高,为39.23%(71/181),其次是土拉菌,阳性率为8.84%(16/181),嗜吞噬细胞无形体的阳性率最低,为0.55%(1/181),未检出汉坦病毒(表 3)。总病原体(感染≥1种病原体)阳性率为47.51%(86/181),复合病原体(同时感染≥2种病原体)阳性率为8.84%(16/181),其中同时携带巴尔通体和土拉菌的阳性率为3.87%(7/181),同时携带DBV和巴尔通体的阳性率为1.66%(3/181),同时携带巴尔通体和致病性钩体的阳性率为1.11%(2/181),同时携带DBV和致病性钩体的阳性率为0.55%(1/181),同时携带土拉菌和致病性钩体的阳性率为0.55%(1/181),同时携带莫氏立克次体、嗜吞噬细胞无形体、恙虫病东方体和土拉菌的阳性率为0.55%(1/181),同时携带莫氏立克次体、嗜吞噬细胞无形体、恙虫病东方体、土拉菌、巴尔通体和致病性钩体的阳性率为0.55%(1/181)。
|
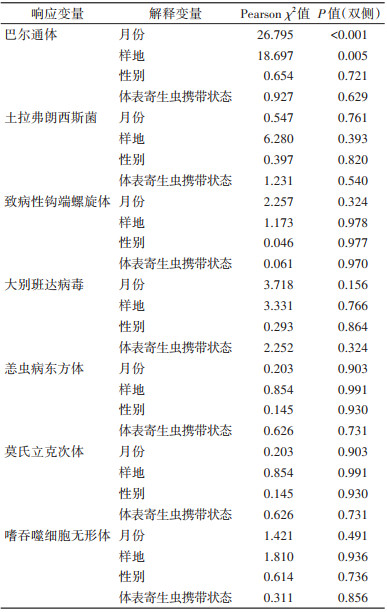
5、7和9月达乌尔黄鼠的巴尔通体阳性率分别为17.33%、52.75%和66.67%,且不同月份间差异有统计学意义(χ2=26.795,P < 0.001),其中,5月与7和9月的差异均有统计学意义(χ2=22.184,P < 0.001;χ2=15.991,P < 0.001),而7和9月阳性率差异无统计学意义(χ2=1.007,P=0.361)。土拉菌的阳性率在5、7和9月分别为9.33%、7.69%和13.33%,致病性钩体为2.67%、6.59%和0,DBV为1.33%、6.59%和0,恙虫病东方体为1.33%、1.10%和0,莫氏立克次体为1.33%、1.10%和0,嗜吞噬细胞无形体为1.33%、0和0,汉坦病毒未检出。除巴尔通体之外,其他所有病原体阳性率在月份(季节)间的差异均无统计学意义。见表 3、4。
|
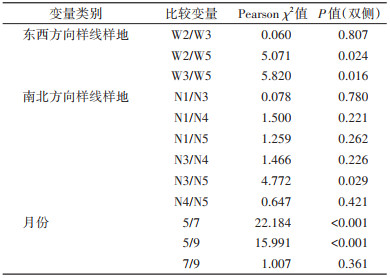
巴尔通体阳性率在样地间的差异有统计学意义(χ2=18.697,P=0.005),在南北走向样线上,巴尔通体阳性率在N1、N3和N5样地分别为50.00%、42.86%和24.62%,呈现由北向南(N1到N5),感染率逐渐降低,其中N3和N5样地间感染率差异有统计学意义(χ2=4.772,P=0.029);在东西方向样线上,巴尔通体阳性率在W2、W3和W5样地分别为40.00%、42.86%和72.73%,呈现由西向东(W2到W5)感染率逐渐上升,其中W2和W3与W5间感染率差异均有统计学意义(χ2=5.071,P=0.024;χ2=5.820,P=0.016);巴尔通体阳性率在宿主性别间、宿主体表寄生虫携带状态(携带与不携带)间差异均无统计学意义。除巴尔通体外的其他病原体在不同月份、样地、性别和体表寄生虫携带状态间的阳性率差异均无统计学意义。见表 4~6。
|
|
本次调查点全部位于内蒙古东部草原地区,共捕获达乌尔黄鼠181只。捕获的达乌尔黄鼠数量以7月(夏季)最多,5月(春季)次之,9月(秋季)最少,此现象体现出达乌尔黄鼠活动的显著季节效应,4月末达乌尔黄鼠冬眠结束开始活动,至夏季时数量达到峰值,而9月逐渐入蛰,数量减少[12]。不同样地的捕获差异可能是因为达乌尔黄鼠活动受气候影响,且对生境具有一定的选择偏好,较喜利于躲避的低矮灌木环境[13],一般来讲,栖息地植被状况会对啮齿动物的种群状况产生影响[14]。
本次调查发现达乌尔黄鼠不同季节的巴尔通体阳性率为17.33%~66.67%,2013年在锡林郭勒盟的研究发现达乌尔黄鼠的巴尔通体阳性率最高,与本研究结果均体现了内蒙古地区达乌尔黄鼠巴尔通体的高感染率[15]。另一项内蒙古西部口岸地区的鼠类及其携带病原体调查发现巴尔通体的总阳性率最高(43.16%),嗜吞噬细胞无形体次之(17.98%)[16]。这可能表明巴尔通体在这些地区的多种啮齿动物携带的病原体中均占有重要地位,应作为重点监测的病原体。土拉菌的重要宿主包括小型啮齿动物,可通过蜱、蚊和蚤等媒介生物或通过直接接触受感染的动物或饮用受污染的水传播。在甘肃省不同自然景观的动物宿主和媒介寄生虫的研究中发现啮齿类宿主的土拉菌总感染率为3.93%[17],且不同地区景观间差异有统计学意义。而本研究中达乌尔黄鼠的土拉菌阳性率为8.84%,表明鼠类宿主中土拉菌感染风险在内蒙古东部地区比甘肃省更高,但在内蒙古各样地间未观察到显著差异,可能原因为本次调查均为草原生境,而甘肃省的研究地区包括陇西、陇东、陇南、甘南、祁连山和河西走廊地区,自然景观差异巨大[17]。近年来的调查中,我国多地啮齿动物致病性钩体总体感染率为4.80%~9.50%[17-19]。本研究发现达乌尔黄鼠的致病性钩体阳性率为4.42%,略低于其他研究,本次调查点均位于草原牧场之上,人口密度显著低于城市,但需对重点人群(农牧业工作者)和牲畜群进行卫生健康管理。恙虫病东方体感染人类可引起恙虫病,有多项研究调查了恙虫病东方体的宿主[20-21],其经恙螨幼虫叮咬传播[17]。本次调查发现恙虫病东方体在达乌尔黄鼠中的阳性率为1.10%,检出于N3和N5两地,提示感染较为局限。汉坦病毒是布尼亚病毒科的一种单链RNA病毒,可经啮齿动物传播,引起汉坦病毒肺综合征和肾综合征出血热[22-23],虽然本次调查并未检测出汉坦病毒,但2009年8月满洲里口岸地区捕获的达乌尔黄鼠中检测出汉坦病毒抗体阳性[24],仍提示内蒙古部分地区的达乌尔黄鼠中可能存在着汉坦病毒。
达乌尔黄鼠栖息范围基本稳定,春季交配后即定居,并不轻易迁移[10]。有研究表明单只鼠可同时感染多种病原体[25],而本次调查也发现达乌尔黄鼠存在多种病原体复合感染(≥2种病原体),阳性率为8.84%(16/181)。本次达乌尔黄鼠检出的病原体中,除巴尔通体外,其他病原体阳性率在样地间的差异均无统计学意义,其可能原因为阳性率较低。2015年一项内蒙古乌拉特口岸地区的鼠类携带病原体调查显示,鼠类感染巴尔通体在4月的感染率高于5和6月,气温升高而鼠类巴尔通体感染率逐渐降低[26]。本研究检测到巴尔通体阳性率5、7和9月的病原体阳性率分别为17.33%、52.75%和66.67%,在捕获数量较多的5和7月,气温升高而巴尔通体感染率逐渐上升,与上述研究结果相反。推测可能的原因在于样本量和不同地区优势鼠种不同,上述调查的优势鼠种五趾跳鼠(Allactaga sibirica)属夜行性动物,而达乌尔黄鼠为日行性[27]。多项研究表明湿度、降水和气温等环境因素对媒介生物传染病的发生具有重要意义[28-29]。本研究中由北向南(N1-N3-N5)各样地的气温逐渐升高,巴尔通体阳性率逐渐降低,由西向东(W2-W3-W5)生境由半荒漠草原向草原过渡,各样地湿度逐渐增大,巴尔通体阳性率逐渐上升。在季节分布上,夏季达乌尔黄鼠病原体阳性率较高,应重点关注。
总之,本次调查发现内蒙古东部草原地区达乌尔黄鼠的病原谱较为丰富,监测方案所列8种病原体中,除汉坦病毒外,其他7种病原体均有检出,尤其以巴尔通体检出最多。提示了达乌尔黄鼠病原传播的高风险地区和关键时间段,将为当地鼠类控制和病原监测提供支持。
利益冲突 无
| [1] |
Thorington RW Jr, Hoffman RS. Family Sciuridae[M]//Wilson DE, Reeder DM. Mammal species of the world: A taxonomic and geographic reference. 3rd ed. Baltimore: Johns Hopkins University Press, 2005: 754-818.
|
| [2] |
Helgen KM, Cole FR, Helgen LE, et al. Generic revision in the Holarctic ground squirrel genus Spermophilus[J]. J Mammal, 2009, 90(2): 270-305. DOI:10.1644/07-MAMM-A-309.1 |
| [3] |
Hoffmann RS, Smith AT. Family Sciuridae: Squirrels[M]//Smith AT, Xie Y, Hoffmann RS, et al. A guide to the mammals of China. Princeton: Princeton University Press, 2008: 172-195. DOI: 10.1515/9781400834112.172b.
|
| [4] |
张芳, 鞠成. 达乌尔黄鼠疫源地及动物鼠疫时空分布[J]. 中国地方病防治杂志, 2019, 34(6): 642-643. Zhang F, Ju C. Spatial and temporal distribution of Spermophilus dauricus plague foci and animal plague[J]. Chin J Ctrl Endem Dis, 2019, 34(6): 642-643. |
| [5] |
魏怀波, 任星历, 邬婧, 等. 2019-2021年二连浩特口岸啮齿动物及其携带病原体调查[J]. 中国口岸科学技术, 2022, 4(10): 14-19. Wei HB, Ren XL, Wu J, et al. Investigation on rodents and rodent-borne pathogens at Erenhot port in 2019-2021[J]. China Port Sci Technol, 2022, 4(10): 14-19. DOI:10.3969/j.issn.1002-4689.2022.10.003 |
| [6] |
Li JY, Zhang CX, Lu M, et al. Infection by a previously uncharacterized Ehrlichia species in rodents from Inner Mongolia, Northern China[J]. Ticks Tick Borne Dis, 2023, 14(2): 102116. DOI:10.1016/j.ttbdis.2022.102116 |
| [7] |
He W, Ke L, Guo X, et al. A survey on parasites in wild rodents in Xiji County, a northwestern part of China[J]. Trop Biomed, 2017, 34(2): 449-452. |
| [8] |
康东梅, 牛艳芬, 闫东, 等. 河北省鼠疫自然疫源地康保牧场长爪沙鼠巢蚤季节性分布研究[J]. 中国媒介生物学及控制杂志, 2021, 32(3): 276-281. Kang DM, Niu YF, Yan D, et al. Seasonal distribution of Meriones unguiculatus nest fleas in Kangbao pasture, a natural plague focus of Hebei Province, China[J]. Chin J Vector Biol Control, 2021, 32(3): 276-281. DOI:10.11853/j.issn.1003.8280.2021.03.004 |
| [9] |
范蒙光, 李建云, 常子丽, 等. 内蒙古达乌尔黄鼠疫源地主要宿主寄生蚤调查结果分析[J]. 医学动物防制, 2015, 31(9): 945-948. Fan MG, Li JY, Chang ZL, et al. Spermophilus dauricus epidemic focus main hosts parasitical fleas investigation results analysis of Inner Mongolia[J]. J Med Pest Control, 2015, 31(9): 945-948. |
| [10] |
焦德庆. 达乌尔黄鼠的生活习性及防治措施[J]. 现代畜牧科技, 2021(6): 81-82. Jiao DQ. The habits of Spermophilus dauricus and their control measures[J]. Mod Anim Husb Sci Technol, 2021(6): 81-82. DOI:10.19369/j.cnki.2095-9737.2021.06.043 |
| [11] |
栗冬梅, 徐兆楠, 朱彩英, 等. 应用TaqMan探针实时荧光定量PCR法调查北京市部分城郊区鼠传病原体流行状况[J]. 中国媒介生物学及控制杂志, 2019, 30(1): 12-17. Li DM, Xu ZN, Zhu CY, et al. An epidemiologic investigation of rodent-borne pathogens in some suburban areas of Beijing, China[J]. Chin J Vector Biol Control, 2019, 30(1): 12-17. DOI:10.11853/j.issn.1003.8280.2019.01.003 |
| [12] |
王静, 纪维红, 苏军虎, 等. 达乌尔黄鼠(Spermophilus dauricus)生态学研究进展[J]. 中国农学通报, 2015, 31(8): 33-39. Wang J, Ji WH, Su JH, et al. The research status on Spermophilus dauricus[J]. Chin Agric Sci Bull, 2015, 31(8): 33-39. DOI:10.11924/j.issn.1000-6850.2014-2439 |
| [13] |
邓庆华, 金胜男. 海拉尔东山达乌尔黄鼠的生境选择特征[J]. 广东农业科学, 2013, 40(22): 97-100, 110. Deng QH, Jin SN. Habitat selection characteristics of Citellus dauricus in Dongshan, Hailar[J]. Guangdong Agric Sci, 2013, 40(22): 97-100, 110. DOI:10.16768/j.issn.1004-874x.2013.22.022 |
| [14] |
Chidodo DJ, Kimaro DN, Hieronimo P, et al. Application of normalized difference vegetation index (NDVI) to forecast rodent population abundance in smallholder agro-ecosystems in semi-arid areas in Tanzania[J]. Mammalia, 2020, 84(2): 136-143. DOI:10.1515/mammalia-2018-0175 |
| [15] |
宋秀平, 栗冬梅, 贾丽军, 等. 内蒙古小型兽类巴尔通体感染情况调查[J]. 中国媒介生物学及控制杂志, 2015, 26(3): 233-237. Song XP, Li DM, Jia LJ, et al. Investigation of Bartonella infection in small mammals in Inner Mongolia, China[J]. Chin J Vector Biol Control, 2015, 26(3): 233-237. DOI:10.11853/j.issn.1003.4692.2015.03.004 |
| [16] |
王宁, 靳木子, 蒋兰芬, 等. 内蒙古西部口岸地区鼠类及其携带病原体调查[J]. 中华疾病控制杂志, 2020, 24(6): 716-722. Wang N, Jin MZ, Jiang LF, et al. Pathogen investigation of rodents in the western ground crossings of Inner Mongolia[J]. Chin J Dis Control Prev, 2020, 24(6): 716-722. DOI:10.16462/j.cnki.zhjbkz.2020.06.019 |
| [17] |
Computational and Mathematical Methods in Medicine. Retracted: Detection and genotyping of Francisella tularensis in animal hosts and vectors from six different natural landscape areas, Gansu Province, China[J]. Comput Math Methods Med, 2023, 2023: 9869158. DOI:10.1155/2023/9869158 |
| [18] |
Shao JW, Wei YH, Yao XY, et al. Pathogenic Leptospira species are widely disseminated among wild rodents in urban areas of Guangzhou, Southern China[J]. Microorganisms, 2022, 10(5): 873. DOI:10.3390/microorganisms10050873 |
| [19] |
Xu JL, Chen JT, Xiong CR, et al. Pathogenic Leptospira infections in Hubei Province, central China[J]. Microorganisms, 2022, 11(1): 99. DOI:10.3390/microorganisms11010099 |
| [20] |
Liu YX, Jia N, Xing YB, et al. Consistency of the key genotypes of Orientia tsutsugamushi in scrub typhus patients, rodents, and chiggers from a new endemic focus of northern China[J]. Cell Biochem Biophys, 2013, 67(3): 1461-1466. DOI:10.1007/s12013-013-9646-0 |
| [21] |
Li F, Zhang ZT, Fang LZ, et al. Indoor and outdoor rodent hosts of Orientia tsutsugamushi, Shandong Province, China[J]. Emerg Infect Dis, 2021, 27(10): 2731-2734. DOI:10.3201/eid2710.210393 |
| [22] |
Khan AS, Khabbaz RF, Armstrong LR, et al. Hantavirus pulmonary syndrome: The first 100 US cases[J]. J Infect Dis, 1996, 173(6): 1297-1303. DOI:10.1093/infdis/173.6.1297 |
| [23] |
Simpson SQ, Spikes L, Patel S, et al. Hantavirus pulmonary syndrome[J]. Infect Dis Clin North Am, 2010, 24(1): 159-173. DOI:10.1016/j.idc.2009.10.011 |
| [24] |
孙肖红, 张晓龙, 胡孔新, 等. 2009年中俄满洲里-后贝加尔斯克口岸地区鼠类及其携带病原的调查研究[J]. 中国国境卫生检疫杂志, 2010, 33(5): 313-315, 319. Sun XH, Zhang XL, Hu KX, et al. Investigation on rats and pathogens in Sino-Russian Manzhouli-Zabaikalsk frontier regions[J]. Chin J Front Health Quar, 2010, 33(5): 313-315, 319. DOI:10.16408/j.1004-9770.2010.05.002 |
| [25] |
于波, 刘星媛, 王一平, 等. 黑龙江省漠河口岸地区2019-2022年鼠类及其携带病原监测结果分析[J]. 中国媒介生物学及控制杂志, 2023, 34(6): 728-732. Yu B, Liu XY, Wang YP, et al. Surveillance and analysis of rodents and pathogens carried by them at Mohe Port in Heilongjiang Province, China, in 2019-2022[J]. Chin J Vector Biol Control, 2023, 34(6): 728-732. DOI:10.11853/j.issn.1003.8280.2023.06.004 |
| [26] |
靳木子, 郝广福, 王静, 等. 内蒙古乌拉特口岸地区2015年鼠类携带病原体情况调查[J]. 中国媒介生物学及控制杂志, 2018, 29(3): 296-297. Jin MZ, Hao GF, Wang J, et al. Investigation on natural infection of rodent-borne pathogens in rodent populations in Urad port area, Inner Mongolia, China in 2015[J]. Chin J Vector Biol Control, 2018, 29(3): 296-297. DOI:10.11853/j.issn.1003.8280.2018.03.020 |
| [27] |
张贵, 孙启廷, 刘振才, 等. 吉林省鼠疫自然疫源地达乌尔黄鼠活动规律的研究[J]. 中国地方病防治杂志, 2009, 24(4): 273-274. Zhang G, Sun QT, Liu ZC, et al. A study on law of activity of S. dauricus in Jilin Province plague nature focus[J]. Chin J Ctrl Endem Dis, 2009, 24(4): 273-274. |
| [28] |
刘冠纯, 康东梅, 闫东, 等. 应用集中度法探讨鼠疫宿主动物达乌尔黄鼠密度变化规律[J]. 中国媒介生物学及控制杂志, 2021, 32(2): 158-160. Liu GC, Kang DM, Yan D, et al. A study of the density of plague host Spermophilus dauricus by concentration method[J]. Chin J Vector Biol Control, 2021, 32(2): 158-160. DOI:10.11853/j.issn.1003.8280.2021.02.007 |
| [29] |
Huang XB, Xie BB, Long JL, et al. Prediction of risk factors for scrub typhus from 2006 to 2019 based on random forest model in Guangzhou, China[J]. Trop Med Int Health, 2023, 28(7): 551-561. DOI:10.1111/tmi.13896 |
 2024, Vol. 35
2024, Vol. 35


