扩展功能
文章信息
- 胡伟超, 李晋宇, 赵宁, 刘起勇, 温红玲, 吴海霞
- HU Wei-chao, LI Jin-yu, ZHAO Ning, LIU Qi-yong, WEN Hong-ling, WU Hai-xia
- 3种蜱传细菌性病原体多重实时荧光定量PCR法的建立
- Establishment of a multiplex real-time fluorescence quantitative PCR method for three tick-borne bacterial pathogens
- 中国媒介生物学及控制杂志, 2024, 35(3): 334-338
- Chin J Vector Biol & Control, 2024, 35(3): 334-338
- 10.11853/j.issn.1003.8280.2024.03.014
-
文章历史
- 收稿日期: 2024-03-12
2 传染病溯源预警与智能决策全国重点实验室, 中国疾病预防控制中心传染病预防控制所媒介生物控制室, 世界卫生组织媒介生物监测与管理合作中心, 北京 102206
2 Department of Vector Biology and Control, National Key Laboratory of Intelligent Tracking and Forecasting for Infectious Diseases, National Institute for Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention, WHO Collaborating Centre for Vector Surveillance and Management, Beijing 102206, China
蜱隶属于节肢动物门(Arthropoda)蛛形纲(Arachnida)蜱螨亚纲(Acari)寄螨目(Parasitiformes)蜱总科(Ixodoidea),我国已发现2科9属124种[1]。蜱不仅可以通过叮咬吸血,引起皮肤损伤和瘙痒,严重时可引起皮炎和过敏反应;还可传播细菌、病毒和原虫等多种病原体[2],导致人类和家畜的多种疾病[3],是仅次于蚊虫的第二大病媒生物[4]。在我国分布的蜱中,60种蜱可以携带或传播1种或多种病原体,36种已在国内得到证实[5]。嗜吞噬细胞无形体(Anaplasma phagocytophilum)、伯氏疏螺旋体(Borrelia burgdorferi)及斑点热群立克次体(spotted fever group Rickettsia,SFGR)等病原体是我国常见的蜱传病原体,可引起人粒细胞无形体病、莱姆病、斑点热等多种疾病,且根据Luan等[6]对我国蜱传病原体的分布研究显示,超过30个省(自治区、直辖市)存在伯氏疏螺旋体的感染,与Zhao等[7]的研究结果一致,其中大部分还同时分布着嗜吞噬细胞无形体和SFGR,如广东、湖北、河南、吉林、新疆、青海、浙江等地都存在3种病原体的复合分布,对这3种病原体进行组合筛查能极大提高检测效率。目前已经存在多种检测单一病原体的方法,如分别利用gltA[8]、groEL[9]、ompA[10]等靶点进行实时荧光定量PCR(real-time fluorescence quantitative PCR,qPCR)检测嗜吞噬细胞无形体,或利用巢式PCR扩增伯氏疏螺旋体的16S-23S基因间隔区等[11],但同时对这3种蜱传细菌性病原体进行检测的方法还少有报道,除杨小娜[12]构建了3种病原体的多重qPCR法外,现有的多重方法多是与其他病原体进行组合检测,如Stańczak等[13]分别对嗜吞噬细胞无形体16S rRNA和巴贝虫(Babesia)18S rRNA基因的97和116 bp片段设计引物和探针,在篦子硬蜱(Ioxdes ricinus)中进行了感染率的检测,Reller和Dumler[14]设计了嗜吞噬细胞无形体及查菲埃立克体(Ehrlichia chaffeensis)感染的双重qPCR检测方法。本研究旨在建立能同时检测3种病原体的多重qPCR法,为这3种蜱传病原体的同时检测提供技术手段。
1 材料与方法 1.1 样本来源及核酸提取蜱样本是采自河北省保定市唐县的80只寄生蜱和70只游离蜱,经形态学和16S rRNA基因测序后,150只蜱均为长角血蜱(Haemaphysalis longicornis)若蜱。根据采集地点和采集方式,每5只分为一组,按动物组织基因组DNA提取试剂盒(西安天隆科技有限公司)说明书提取样本DNA,通过ND-1000分光光度计(美国Thermo NanoDrop)测定浓度后,-20 ℃保存备用。
1.2 引物和探针的设计与合成从美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)上分别获取20条基因序列进行对比分析,包括嗜吞噬细胞无形体msp2的不同分离株序列和伯氏疏螺旋体recA的标准B31菌株、MM1菌株序列等,SFGR ompA序列来自劳氏立克次体(Rickettsia raoultii)、黑龙江立克次体(R. heilongjiangensis)、康氏立克次体(R. conorii)、立氏立克次体(R. rickettsia)、西伯利亚立克次体(R. sibirica)等种类,分析其保守区域,设计正、反向引物和探针,在5′端和3′端分别标记荧光基团和淬灭基团;具体信息见表 1。引物和探针由生工生物工程(上海)股份有限公司合成,引物稀释混匀至20 μmol/L,探针稀释混匀至10 μmol/L,-20 ℃保存备用。

|
包含扩增片段的嗜吞噬细胞无形体msp2、伯氏疏螺旋体recA及SFGR ompA基因重组质粒由生工生物工程(上海)股份有限公司合成,并通过测序进行质粒验证,根据质粒浓度由公式计算得到原始拷贝数后,进行梯度稀释,分别获得1×100~1×105拷贝/μl的阳性标准品,-20 ℃保存备用。
1.4 多重qPCR检测体系建立 1.4.1 反应体系使用探针法qPCR专用预混液(Taq Pro U+ Multiple Probe qPCR Mix,南京诺唯赞,中国)体系进行多重qPCR反应。反应体系:2×Taq Pro U+ Multiple Probe qPCR Mix 10 μl,嗜吞噬细胞无形体和伯氏疏螺旋体正、反向引物各0.4 μl(20 μmol/L),SFGR正、反向引物各0.5 μl(20 μmol/L),探针(10 μmol/L)均为0.6 μl,混合模板DNA 3 μl,ddH2O补充反应体积为20 μl。反应仪器为CFX96全自动荧光定量PCR仪(Bio-Rad,美国),反应程序:37 ℃ 2 min,95 ℃ 30 s;95 ℃ 10 s和60 ℃ 30 s(采集荧光信号),共40个循环。
1.4.2 特异性试验使用建立的多重qPCR检测方法分别对问号钩端螺旋体(Leptospira interroans,问号钩体)、布鲁氏菌(Brucella sp.)、大肠埃希菌(Escherichia coli)进行检测,以3种蜱传病原体为阳性对照,验证其特异性。
1.4.3 灵敏度试验将拷贝数为1×100~1×105拷贝/μl的标准品用构建的多重qPCR方法进行检测,确定检测方法的灵敏度。在仪器上设定标准品的浓度,结合循环阈值(Ct)和扩增曲线在反应仪器上得到标准曲线。
1.4.4 重复性试验平行重复检测3次浓度为1×103~1×105拷贝/μl的标准品质粒,计算其平均值、标准差及其变异系数,用以评价该反应体系的稳定性。
1.5 样本检测利用建立的多重qPCR方法和文献中报道的单重qPCR方法[15-17]对30份野外采集的蜱样本进行病原体检测,对检测结果进行分析。
2 结果 2.1 多重qPCR方法的特异性多重qPCR检测方法对问号钩体、布鲁氏菌、大肠埃希菌检测结果显示,只有嗜吞噬细胞无形体、伯氏疏螺旋体及SFGR出现特异性曲线扩增,其余病原体无明显扩增曲线。见图 1。
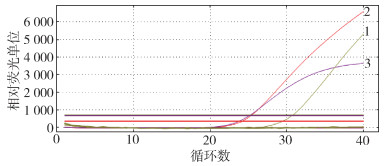
|
| 注:1嗜吞噬细胞无形体;2伯氏疏螺旋体;3斑点热群立克次体。 图 1 多重实时荧光定量PCR方法检测3种蜱传病原体特异性结果 Figure 1 Specificity of multiplex real-time fluorescence quantitative PCR for detection of three tick-borne bacterial pathogens |
| |
3种病原体混合阳性标准品6个浓度(1×100~1×105拷贝/μl)的多重qPCR检测方法显示,最低检测限均为102拷贝/μl,以不同浓度混合阳性标准品拷贝数(X)和qPCR Ct(Y)建立标准曲线方程,3个病原体的标准曲线方程分别为Y=-3.507 lg(X)+44.090,相关系数(R2)=0.986(嗜吞噬细胞无形体);Y=-3.541lg(X)+43.208,R2=0.975(伯氏疏螺旋体);Y=-3.536lg(X)+43.418,R2=0.983(SFGR)。见图 2。
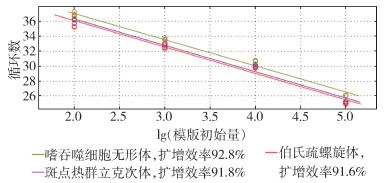
|
| 图 2 多重实时荧光定量PCR检测嗜吞噬细胞无形体、伯氏疏螺旋体及斑点热群立克次体标准曲线结果 Figure 2 Standard curve results for detection of Anaplasma phagocytophilum, Borrelia burgdorferi, and spotted fever group Rickettsia by multiplex real-time fluorescence quantitative PCR |
| |
多重qPCR检测方法对1×103~1×105拷贝/μl的嗜吞噬细胞无形体、伯氏疏螺旋体及SFGR混合阳性标准品平行重复检测3次,变异系数均 < 2.00%。见表 2。
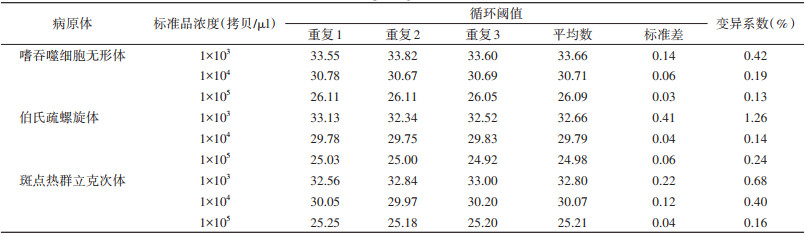
|
用建立的多重qPCR方法对30份野外采集的蜱样本进行3种病原体的检测。结果显示,30份样本中检测到1份SFGR阳性,阳性率为3.33%(1/30),未检测到嗜吞噬细胞无形体和伯氏疏螺旋体感染,经单重qPCR验证,2种检测方法的结果一致性为100%。
3 讨论在过去30年中,随着研究的深入和检测技术的发展,对蜱及蜱传病原体有了更深入的了解。由于气候变暖、土地利用改造等多种因素的影响,蜱地理分布范围扩大,为蜱传疾病的传播提供了更多可能[18],且不断有新的蜱传病原体出现,如2019年在内蒙古自治区和黑龙江地区发现阿龙山病毒(Alongshan virus)[19]、2023年在大别山地区发现皮疹埃立克体(Candidatus Ehrlichia erythraense)[20]等,蜱传病原体引起了巨大的公共卫生安全问题。在我国嗜吞噬细胞无形体、伯氏疏螺旋体及SFGR是常见的蜱传细菌性病原体,且在蜱中存在复合感染的情况,程成等[21]对黑龙江口岸蜱携带嗜吞噬细胞无形体和SFGR的研究发现,1 306份样本中,复合感染率为0.92%;潘玉平等[22]对黑龙江省全沟硬蜱的调查结果显示,嗜吞噬细胞无形体和伯氏疏螺旋体的复合感染率为20.0%。蜱传病原体的监测可以掌握蜱的感染现状,为蜱传疾病的风险评估和预测预警提供依据,具有重要公共卫生意义;同时蜱传病原体的快速、高效检测,也可为蜱传疾病的临床诊断提供技术支持。
多重qPCR检测方法能在同一PCR反应体系中同时检测出多种病原体,在减少初始模板用量的同时,有效减少了实验成本,提高了检测效率,已广泛应用于蜱传病原体的检测中。例如Tokarz等[23]构建了嗜吞噬细胞无形体、田鼠巴贝虫(Babesia microti)、伯氏疏螺旋体、宫本疏螺旋体(Bor. miyamotoi)的多重qPCR方法,检测了肩突硬蜱(I. scapularis)的感染情况;Stellrecht等[24]构建的方法可以同时检测嗜吞噬细胞无形体、查菲埃立克体和田鼠巴贝虫,并在血液样本中得到验证;Gaines等[25]构建的6重实时荧光定量PCR可以检测3种SFGR和3种埃立克体。但这些方法同时检测的病原体大多针对当地的感染情况,并不适合目前我国蜱传病原体的分布现状。因此,建立一种高效、灵敏、快速的核酸检测方法对于蜱传病原监测十分必要。本研究针对嗜吞噬细胞无形体msp2、伯氏疏螺旋体recA及SFGR ompA基因序列设计引物和探针,建立的多重qPCR检测方法特异性和灵敏度良好,3种病原体检测下限均达到102拷贝/μl,与杨小娜[12]构建的方法灵敏度一致,变异系数均 < 2.00%,重复性好;在检测的30份蜱样本中,发现1份样本SFGR阳性,与已有单重qPCR检测方法检测结果一致,对蜱样本的检测结果准确。但本研究的灵敏度与单重qPCR相比,受荧光信号相互干扰、靶基因扩增效率不同等影响,灵敏度下降了1个数量级,可能存在假阴性结果,后续将继续改进。
以上研究表明,本研究建立的嗜吞噬细胞无形体、伯氏疏螺旋体及SFGR的多重qPCR法特异性好、灵敏度高、重复性好,提高了检验效率,将对蜱媒病原体的监测提供技术支持。
志谢 感谢中国疾病预防控制中心传染病预防控制所媒介生物控制室栗冬梅老师对本研究的指导;布病室姜海、新病原室熊衍文、螺旋体室张翠彩老师提供特异性实验所需的布鲁氏菌、大肠埃希菌和问号钩端螺旋体DNA。利益冲突 无
| [1] |
陈泽, 杨晓军. 蜱的系统分类学[M]. 北京: 科学出版社, 2021: 126. Chen Z, Yang XJ. Systematics and taxonomy of Ixodida[M]. Beijing: Science Press, 2021: 126. |
| [2] |
Fang LQ, Liu K, Li XL, et al. Emerging tick-borne infections in Chinese mainland: An increasing public health threat[J]. Lancet Infect Dis, 2015, 15(12): 1467-1479. DOI:10.1016/S1473-3099(15)00177-2 |
| [3] |
Boulanger N, Boyer P, Talagrand-Reboul E, et al. Ticks and tick-borne diseases[J]. Med Mal Infect, 2019, 49(2): 87-97. DOI:10.1016/j.medmal.2019.01.007 |
| [4] |
Dantas-Torres F, Chomel BB, Otranto D. Ticks and tick-borne diseases: A one health perspective[J]. Trends Parasitol, 2012, 28(10): 437-446. DOI:10.1016/j.pt.2012.07.003 |
| [5] |
Yu ZJ, Wang H, Wang TH, et al. Tick-borne pathogens and the vector potential of ticks in China[J]. Parasit Vectors, 2015, 8: 24. DOI:10.1186/s13071-014-0628-x |
| [6] |
Luan YX, Gou JM, Zhong DJ, et al. The tick-borne pathogens: An overview of China's situation[J]. Acta Parasitol, 2023, 68(1): 1-20. DOI:10.1007/s11686-023-00658-1 |
| [7] |
Zhao GP, Wang YX, Fan ZW, et al. Mapping ticks and tick-borne pathogens in China[J]. Nat Commun, 2021, 12(1): 1075. DOI:10.1038/s41467-021-21375-1 |
| [8] |
Henningsson AJ, Hvidsten D, Kristiansen BE, et al. Detection of Anaplasma phagocytophilum in Ixodes ricinus ticks from Norway using a realtime PCR assay targeting the Anaplasma citrate synthase gene gltA[J]. BMC Microbiol, 2015, 15: 153. DOI:10.1186/s12866-015-0486-5 |
| [9] |
Chiappa G, Cafiso A, Monza E, et al. Development of a PCR for Borrelia burgdorferi sensu lato, targeted on the groEL gene[J]. Folia Parasitol, 2020, 67: 2020.026. DOI:10.14411/fp.2020.026 |
| [10] |
Reller ME, Dumler JS. Optimization and evaluation of a multiplex quantitative PCR assay for detection of nucleic acids in human blood samples from patients with spotted fever rickettsiosis, typhus rickettsiosis, scrub typhus, monocytic ehrlichiosis, and granulocytic anaplasmosis[J]. J Clin Microbiol, 2020, 58(9): e01802-19. DOI:10.1128/JCM.01802-19 |
| [11] |
Răileanu C, Tauchmann O, Vasić A, et al. Borrelia miyamotoi and Borrelia burgdorferi (sensu lato) identification and survey of tick-borne encephalitis virus in ticks from north-eastern Germany[J]. Parasit Vectors, 2020, 13(1): 106. DOI:10.1186/s13071-020-3969-7 |
| [12] |
杨小娜. 高通量测序和多重荧光定量PCR方法检测蜱传病原菌研究[D]. 北京: 中国疾病预防控制中心, 2021. DOI: 10.27511/d.cnki.gzyyy.2021.000087. Yang XN. High-throughput sequencing and multiplex real-time PCR methods for the detection of tick-borne pathogens[D]. Beijing: Chinese Center for Disease Control and Prevention, 2021. DOI: 10.27511/d.cnki.gzyyy.2021.000087.(inChinese) |
| [13] |
Stańczak J, Cieniuch S, Lass A, et al. Detection and quantification of Anaplasma phagocytophilum and Babesia spp. in Ixodes ricinus ticks from urban and rural environment, northern Poland, by real-time polymerase chain reaction[J]. Exp Appl Acarol, 2015, 66(1): 63-81. DOI:10.1007/s10493-015-9887-2 |
| [14] |
Reller ME, Dumler JS. Development and clinical validation of a multiplex real-time quantitative PCR assay for human infection by Anaplasma phagocytophilum and Ehrlichia chaffeensis[J]. Trop Med Infect Dis, 2018, 3(1): 14. DOI:10.3390/tropicalmed3010014 |
| [15] |
张晶波, 温博海, 陈梅玲, 等. 荧光定量PCR检测嗜吞噬细胞无形体[J]. 中国人兽共患病学报, 2006, 22(4): 289-293. Zhang JB, Wen BH, Chen ML, et al. Development of a quantitative real-time polymerase chain reaction assay specific for Anaplasma phagocytophila[J]. Chin J Zoonoses, 2006, 22(4): 289-293. DOI:10.3969/j.issn.1002-2694.2006.04.001 |
| [16] |
牛东升, 杨晓, 陈梅玲, 等. 实时荧光定量PCR检测斑点热立克次体的方法建立[J]. 解放军医学杂志, 2008, 33(11): 1297-1299. Niu DS, Yang X, Chen ML, et al. Rapid detection of spotted fever group rickettsiae with real-time quantitative PCR[J]. Med J Chin PLA, 2008, 33(11): 1297-1299. DOI:10.3321/j.issn:0577-7402.2008.11.006 |
| [17] |
耿震, 侯学霞, 张琳, 等. 一种莱姆病螺旋体real-time PCR方法的建立及其在鼠标本检测中的应用评价(英文)[J]. 中国人兽共患病学报, 2015, 31(9): 812-816. Geng Z, Hou XX, Zhang L, et al. Evaluation of a new real-time PCR assay for detection of Borrelia burgdorferi in rodents[J]. Chin J Zoonoses, 2015, 31(9): 812-816. DOI:10.3969/j.issn.1002-2694.2015.09.006 |
| [18] |
Madison-Antenucci S, Kramer LD, Gebhardt LL, et al. Emerging tick-borne diseases[J]. Clin Microbiol Rev, 2020, 33(2): e00083-18. DOI:10.1128/CMR.00083-18 |
| [19] |
Wang ZD, Wang B, Wei F, et al. A new segmented virus associated with human febrile illness in China[J]. N Engl J Med, 2019, 380(22): 2116-2125. DOI:10.1056/NEJMoa1805068 |
| [20] |
Lu M, Qin XC, Jiang YZ, et al. Emergence of ehrlichiosis by a new tick-borne Ehrlichia species in China[J]. Int J Infect Dis, 2023, 131: 32-39. DOI:10.1016/j.ijid.2023.03.038 |
| [21] |
程成, 鞠文东, 王艳梅, 等. 黑龙江口岸蜱携带斑点热群立克次体及嗜吞噬细胞无形体复合感染调查[J]. 口岸卫生控制, 2019, 24(2): 53-59. Cheng C, Ju WD, Wang YM, et al. Investigation of coinfection with Anaplasma phagocytophilum and tick-borne spotted fever group Rickettsia at Heilongjiang Port[J]. Port Health Control, 2019, 24(2): 53-59. DOI:10.3969/j.issn.1008-5777.2019.02.017 |
| [22] |
潘玉平, 杨吉飞, 牛庆丽, 等. 黑龙江省全沟硬蜱携带伯氏疏螺旋体广义种和斑点热群立克次体的研究[J]. 中国兽医科学, 2017, 47(1): 31-37. Pan YP, Yang JF, Niu QL, et al. Study on Borrelia burgdorferi sensu lato and spotted fever group Rickettsia in Ixodes persulcatus in Heilongjiang Province[J]. Chin Vet Sci, 2017, 47(1): 31-37. DOI:10.16656/j.issn.1673-4696.2017.01.005 |
| [23] |
Tokarz R, Tagliafierro T, Cucura DM, et al. Detection of Anaplasma phagocytophilum, Babesia microti, Borrelia burgdorferi, Borrelia miyamotoi, and Powassan virus in ticks by a multiplex real-time reverse transcription-PCR assay[J]. mSphere, 2017, 2(2): e00151-17. DOI:10.1128/mSphere.00151-17 |
| [24] |
Stellrecht KA, Wilson LI, Castro AJ, et al. Automated real-time PCR detection of tickborne diseases using the panther fusion open access system[J]. Microbiol Spectr, 2022, 10(6): e0280822. DOI:10.1128/spectrum.02808-22 |
| [25] |
Gaines DN, Operario DJ, Stroup S, et al. Ehrlichia and spotted fever group rickettsiae surveillance in Amblyomma americanum in Virginia through use of a novel six-plex real-time PCR assay[J]. Vector Borne Zoonotic Dis, 2014, 14(5): 307-316. DOI:10.1089/vbz.2013.1509 |
 2024, Vol. 35
2024, Vol. 35


