扩展功能
文章信息
- 孙静, 魏文宇, 詹尚, 李芳, 赵国玉, 王启果, 雒涛, 吴海燕, 张渝疆
- SUN Jing, WEI Wen-yu, ZHAN Shang, LI Fang, ZHAO Guo-yu, WANG Qi-guo, LUO Tao, WU Hai-yan, ZHANG Yu-jiang
- 降水对新疆维吾尔自治区北天山长尾黄鼠动物鼠疫影响的研究
- Effects of precipitation on epizootic plague among Spermophilus undulatus at the northern Tianshan Mountains of Xinjiang Uygur Autonomous Region, China
- 中国媒介生物学及控制杂志, 2024, 35(3): 323-328
- Chin J Vector Biol & Control, 2024, 35(3): 323-328
- 10.11853/j.issn.1003.8280.2024.03.012
-
文章历史
- 收稿日期: 2023-10-24
2 新疆维吾尔自治区疾病预防控制中心消毒与感染控制中心/应急鼠防所, 新疆 乌鲁木齐 830002;
3 新疆病媒传染病重点实验室, 新疆 乌鲁木齐 830002
2 Disinfection and Infection Control Center/Institute for Emergency Rodent Control, Xinjiang Center for Disease Control and Prevention, Urumqi, Xinjiang 830002, China;
3 Xinjiang Key Laboratory of Vector-borne Infectious Diseases, Urumqi, Xinjiang 830002, China
鼠疫的发生和流行是一个复杂的动态过程,已有大量研究表明气候的波动影响着鼠疫自然流行,且与鼠疫自然疫源地组成的3大要素——鼠疫耶尔森菌(Yersinia pestis,鼠疫菌)、传播媒介和宿主密不可分[1-2]。新疆维吾尔自治区(新疆)有着丰富的鼠疫自然疫源地,是我国动物间鼠疫流行较为活跃的地区之一,尤其是北天山灰旱獭(Marmota baibacina)-长尾黄鼠(Spermophilus undulatus)疫源地动物间鼠疫流行强度高,呈时间上的连续性[3-4]。同时,对该地区长期连续的大量鼠疫菌基因组分析研究发现,气候变化与鼠疫菌rpoZ基因突变有关,且这种突变与鼠疫菌在蚤前胃内生物膜的形成有关,进而推测此种气候变化所致突变影响着动物鼠疫流行[5]。本研究基于该地区长尾黄鼠鼠疫长期、系统的监测数据,进一步深入探讨降水量对长尾黄鼠鼠疫传播媒介及其动物鼠疫流行的影响,为丰富鼠疫基础理论和揭示鼠疫流行机制提供更多的基础资料,并探讨其在动物鼠疫监测和预警预测中的科学价值。
1 材料与方法 1.1 研究对象与资料来源研究对象为新疆北天山灰旱獭-长尾黄鼠鼠疫自然疫源地乌苏古尔图地区长尾黄鼠动物鼠疫,动物鼠疫监测数据来源于1986-2020年该地区公开发表的数据。气象数据采用距离鼠疫监测点最近的气象台站(51334)记录的数据。
1.2 监测方法与数据处理首先对1986-2020年该地区年降水量按四分位法分成4组(降水量≤25%、> 25%~50%、> 50%~75%和 > 75%)进行分组差异性检验。在此基础上对年降水量也按四分位法进行分组,统计不同分组的月份组成,以各年降水量中位数将各年的月份分成2组,统计2组月份组成的差异性,确定2组降水量分组的月份组成,并以此作为后续不同节气降水量对媒介蚤和鼠疫流行影响分析的分组。
动物鼠疫监测按照《全国鼠疫监测方案》执行。长尾黄鼠采用弓形夹法,计数并统计鼠密度,采集心脏血液用于血清学检测;单只梳检长尾黄鼠获媒介蚤,按同一时间、地点、种类进行分组送检,计算蚤指数和染蚤率。鼠疫血清学检测采用间接血凝试验检测鼠疫菌F1抗体。长尾黄鼠血清鼠疫菌抗体阳性率(PVt)、蚤指数(FBt)和染蚤率(FPt)按下列公式计算:

|
采用SPSS 25.0软件进行数据整理和统计分析。降水量的节气分组两组间差异性分析选择Wilcoxon秩和检验;多组间差异性分析选择Kruskal-Wallis H秩和检验。
降水量与媒介指标(染蚤率、蚤指数)和鼠疫血清阳性率单因素相关分析采用Spearman秩相关分析。
多因素相关分析采用R 4.2.1软件中的mgcv程序包构建广义可加模型(generalized additive model,GAM)。本研究中动物鼠疫血清阳性率为小概率事件,可认为近似服从泊松(Possion)分布。模型公式为:
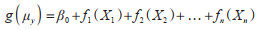
|
式中,f()代表各种描述解释变量的平滑样条函数,g(μy)代表响应变量Y条件均值的函数(泊松分布)。基于Spearman相关分析结果,确定纳入模型的变量,并且使用广义交叉验证(generalized cross validation,GCV)筛选模型参数构建模型,以及采用决定系数(R2)和方差解释率判定模型的拟合优度。
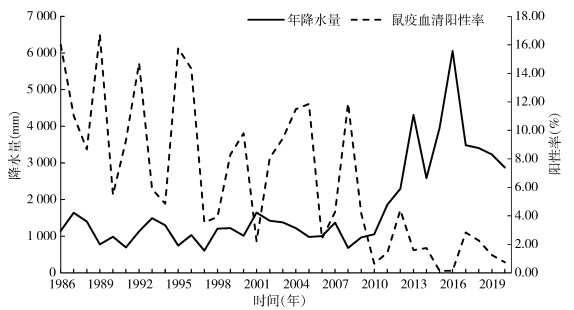
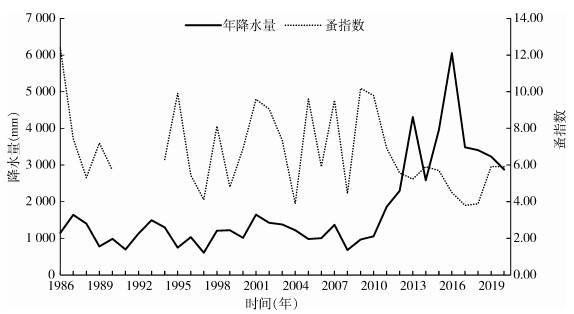
2 结果 2.1 降水分布 2.1.1 年降水分布北天山灰旱獭-长尾黄鼠鼠疫自然疫源地乌苏古尔图地区1986-2020年年降水量均值为1 776.54 mm,最大降水量为6 051 mm,最小为608 mm,中位数为1 300 mm(图 1、2)。年降水量按四分位法分组后检验,不同年份间降水量分布差异有统计学意义(F=31.886,P < 0.001)。
|
| 图 1 新疆维吾尔自治区北天山灰旱獭-长尾黄鼠鼠疫自然疫源地1986-2020年年降水量、鼠疫血清阳性率趋势 Figure 1 Trend of annual precipitation and plague seroprevalence rate in the natural plague focus of Marmota baibacina-Spermophilus undulatus at the northern Tianshan Mountains, Xinjiang Uygur Autonomous Region, 1986-2020 |
| |
|
| 图 2 新疆维吾尔自治区北天山灰旱獭-长尾黄鼠鼠疫自然疫源地1986-2020年年降水量、蚤指数趋势 Figure 2 Trend of annual precipitation and flea index in the natural plague focus of Marmota baibacina-Spermophilus undulatus at northern Tianshan Mountains, Xinjiang Uygur Autonomous Region, 1986-2020 |
| |
采用四分位分组法将每年的降水量按月进行分组后,1986-2020年月降水量大于年降水量中位数的月份以4-9月为主,共计有150个月,占总月数的71.42%,月降水量小于年降水量中位数的月份以10-12月和1-3月为主,共计有151个月,占总月数的71.90%,两组间降水量差异有统计学意义(F=-2.908,P=0.004)。据此在降水节气划分上将当年4-9月降水组命名为当年春末夏秋(MSt),将上年10-12月和次年1-3月降水组命名当年秋末冬春(MWt)。2个降水节气中,春末夏秋降水量均值为1 288.11 mm,最大降水量4 269 mm,最小392 mm,中位数922 mm;秋末冬春降水量均值为484.86 mm,最大降水量1 656 mm,最小191 mm,中位数384 mm。两组间降水量差异有统计学意义(Z=-5.515,P < 0.001)。
2.2 鼠疫流行病学指标1986-2020年,在该地区共捕获长尾黄鼠20 343只,染蚤鼠17 806只,梳检体蚤137 518匹,平均染蚤率87.53%,平均蚤指数6.76;检验宿主动物血清22 079份,鼠疫菌F1抗体血清阳性1 459份,平均阳性率6.61%。
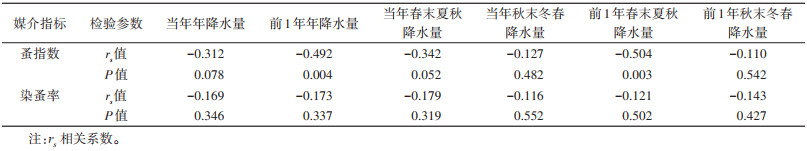
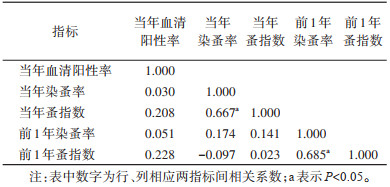
2.3 降水量与媒介和血清阳性率间的相关性 2.3.1 单因素分析 2.3.1.1 降水量与媒介指标的相关性经Spearman秩相关分析,年降水量和2个节气的降水量与蚤指数和染蚤率均存在负相关关系,其中,前1年降水量和前1年春末夏秋降水量与蚤指数间负相关关系有统计学意义(rs=-0.492,P=0.004;rs=-0.504,P=0.003)。见表 1。
|
经Spearman秩相关分析,年降水量和2个节气的降水量与血清阳性率存在负相关关系,其中,年降水量、前1年降水量、当年春末夏秋降水量、当年秋末冬春降水量和前1年春末夏秋降水量与血清阳性率间负相关关系有统计学意义(rs=-0.627,P < 0.001;rs=-0.339,P=0.046;rs=-0.579,P < 0.001;rs=-0.486,P=0.003;rs=-0.380,P=0.024),前1年春末夏秋降水量与F1抗体阳性率间相关关系无统计学意义(rs=-0.317,P=0.064)。
2.3.1.3 媒介指标与血清阳性率相关性经Spearman秩相关分析,宿主的蚤指数、染蚤率及血清阳性率间均存在相关性,其中蚤指数、染蚤率与血清阳性率存在正相关关系,当年蚤指数、前1年蚤指数分别与同期染蚤率间亦存在正相关关系,且均有统计学意义(rs=0.667,P=0.004;rs=0.685,P=0.003)。见表 2。
|
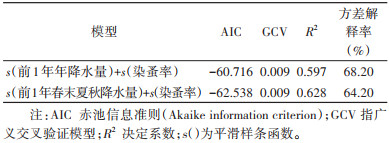
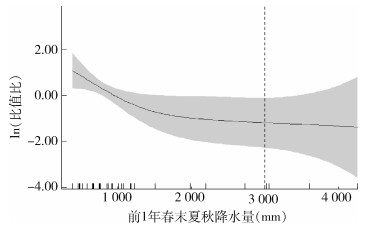
根据2.3.1.1的分析结果,将相关性具有统计学意义的当年染蚤率、前1年年降水量和前1年春末夏秋降水量纳入模型中。结果显示,前1年春末夏秋降水量和染蚤率与当年蚤指数相关性有统计学意义(F=4.289,P=0.019;F=10.950,P < 0.001),模型筛选结果见表 3。GAM模型拟合结果显示,当前1年春末夏秋降水量 < 3 000 mm时,随年降水量增加当年蚤指数呈明显下降的趋势;而≥3 000 mm,随降水量增加,蚤指数变化趋于平缓。见图 3。
|
|
| 图 3 新疆维吾尔自治区北天山灰旱獭-长尾黄鼠鼠疫自然疫源地1986-2020年蚤指数与降水量关联效应图 Figure 3 Relationship between flea index and precipitation in the natural plague focus of Marmota baibacina-Spermophilus undulatus at the northern Tianshan Mountains, Xinjiang Uygur Autonomous Region, 1986-2020 |
| |
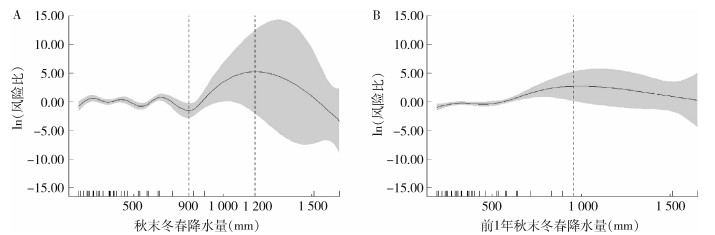
根据2.3.1.2的分析结果,将相关性具有统计学意义的年降水量、前1年降水量、当年春末夏秋降水量、当年秋末冬春降水量和前1年春末夏秋降水量纳入GAM中。结果显示,当年秋末冬春降水量和前1年秋末冬春降水量与鼠疫血清阳性率间关系有统计学意义(F=31.167,P < 0.001;F=21.389,P=0.001)。GAM拟合效应结果显示,当年秋末冬春降水量 < 900 mm时,鼠疫血清阳性率呈波浪式变化,900~ < 1 200 mm时随降水量增加鼠疫血清阳性率呈明显上升趋势,≥1 200 mm时随降水量增加鼠疫血清阳性率则呈明显下降趋势(图 4A);当前1年秋末冬春降水量 < 1 000 mm时,随降水量增加鼠疫血清阳性率呈缓慢上升趋势,≥1 000 mm时,随降水量增加呈下降趋势(图 4B)。
|
| A. 秋末冬春降水量对鼠疫血清阳性率的影响效应;B. 前1年秋末冬春降水量对鼠疫血清阳性率的影响效应 图 4 新疆维吾尔自治区北天山灰旱獭-长尾黄鼠鼠疫自然疫源地1986-2020年鼠疫血清阳性率与降水量关联的效应图 Figure 4 Relationship between plague seroprevalence rate and precipitation in the natural plague focus of Marmota baibacina-Spermophilus undulatus at the northern Tianshan Mountains, Xinjiang Uygur Autonomous Region, 1986-2020 |
| |
根据2.3.1.3的分析结果,将有相关性的当年蚤指数、当年染蚤率、前1年蚤指数和前1年染蚤率纳入模型中。结果显示,当年蚤指数和前1年蚤指数与血清阳性率有统计学意义(F=5.365,P=0.021;F=7.437,P=0.014)。GAM模型拟合结果显示,当年蚤指数与鼠疫血清阳性率存在线性正相关关系,鼠疫血清阳性率随蚤指数的增加而上升(图 5A)。前1年蚤指数与鼠疫血清阳性率存在正相关关系,鼠疫血清阳性率亦随前1年蚤指数的增加而上升(图 5B)。
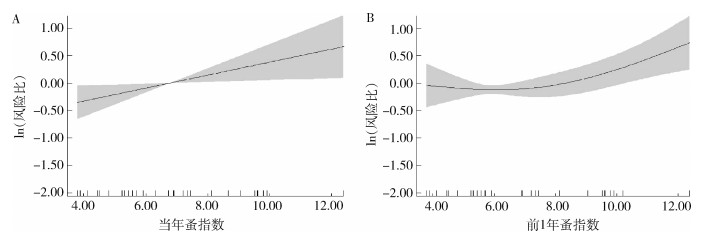
|
| A. 当年蚤指数对鼠疫血清阳性率的影响效应;B. 前1年蚤指数对鼠疫血清阳性率的影响效应 图 5 新疆维吾尔自治区北天山灰旱獭-长尾黄鼠鼠疫自然疫源地1986-2020年媒介蚤与鼠疫血清阳性率关联的效应图 Figure 5 Relationship between flea index and plague seroprevalence rate in the natural plague focus of Marmota baibacina-Spermophilus undulatus at the northern Tianshan Mountains, Xinjiang Uygur Autonomous Region, 1986-2020 |
| |
气象因素中,降水是反映气候变化较敏感的因子之一,同时也是影响一个生态群落生长、发育的重要因素,并对疾病传播媒介种类和丰度产生影响。本研究发现降水量对蚤指数的影响是一个复杂过程,前1年年降水量和前1年春末夏秋降水量都与蚤指数呈负相关,且前1年春末夏秋降水量对长尾黄鼠体蚤数量负性影响更大,存在滞后效应,即当年长尾黄鼠体蚤的蚤指数受前1年降水量比当年的降水量影响更大,具体到节气是前1年的春末夏秋降水量影响更大。同时,降水量对蚤指数的影响不是简单的线性关系,小于这一区域春末夏秋降水量均值[(1 288.11±983.09)mm]时,降水量抑制长尾黄鼠体蚤增长效应明显,而大于这一均值标准差的上限时,其抑制效果显著下降,而超过 > 3 000 mm(相当于2倍标准差)时,降水量的增加对蚤指数无影响。这一发现是非常有意义的,反应出气候-宿主-媒介复杂的相互作用关系,也进一步表明蚤的丰富度和鼠疫流行强度还受到宿主社会关系的影响[6-7],值得进一步深入研究。宿主社会关系可以影响宿主种群密度、空间分布、行为模式等因素,间接影响媒介的数量和传播效率,进而影响疾病的传播和流行情况。2017年Ezquiaga等[8]在开展犰狳(Priodontes maximus)种群的体蚤与宿主关系研究时亦有类似发现,其解释的原因可能是自然条件下如果降水减少,植被生产力下降,使食草宿主的身体状况下降,降低了宿主对蚤类的防御能力,因而导致蚤类丰度增加。
蚤类与其寄生宿主啮齿动物的关系对疾病的传播至关重要,有研究表明寄生蚤数量[9]和种类丰富度[10]的增加均会增加宿主感染疾病的概率。本研究结果显示当年的长尾黄鼠鼠疫血清阳性率,即动物鼠疫的流行强度与当年和前1年的蚤指数呈正相关,而当年蚤指数对鼠疫的影响更大,呈线性关系。值得注意的是,影响当年蚤指数的最大气象因素是前1年春末夏秋的降水量。因此,此现象不仅蕴含着未知科学问题,也展示了降水量在长期鼠疫预警监测中的价值。
正如前述中降水量与蚤的关系、蚤与鼠疫流行强度的关系,降水对动物鼠疫流行影响也是一个复杂的过程。哈萨克斯坦大沙鼠(Rhombomys opimus)鼠疫自然疫源地研究发现,温暖的春季会使媒介-宿主比率升高,从而导致沙鼠宿主种群的流行水平更高[11]。越南鼠疫病例研究则发现约63%的鼠疫病例发生在旱季,且当月降雨量下降时,鼠疫的风险会增加数倍[12]。美国西部鼠疫自然疫源地[13]的研究发现,太平洋十年涛动(PDO)增加降雨量导致的潮湿气候会增加鼠疫活动,从而增加人类病例数量,其解释的原因是Parmenter等[14]提出的营养级联假说,即冬春降水量增多提高了植被的生产力,使啮齿动物数量增多,进而促进了鼠疫流行的发生。而本研究则发现了一个更为复杂的降水对鼠疫流行影响的现象,降水量处于该地区秋末冬春降水量平均值的区间范围[(484.86±326.94)mm]内时,长尾黄鼠鼠疫血清抗体阳性率处于小幅波动状态,而在900~1 200 mm时,即大于均值标准差上限至2个标准差之间,则随降水量增加鼠疫流行强度明显上升,而高于1 200 mm时,又转为抑制作用。因此降水对宿主鼠疫流行强度的影响不能简单用营养级联假说去解释。前1年秋末冬春过高的降水量可能会伴随更低的冬季干冷气候和春季融雪型洪水,都可能对长尾黄鼠鼠种群产生负效应,从而导致大多数体外寄生虫物种和个体消亡[15],对动物鼠疫流行起到抑制作用。也可能相对湿度高时易导致跳蚤的卵、幼虫、蛹感染致病菌,影响跳蚤的存活,继而减少鼠疫发生风险[16]。
综上所述,通过对降水量影响长尾黄鼠鼠疫传播媒介及其动物鼠疫流行的研究,发现降水量对媒介和动物鼠疫流行的影响均是一个复杂的过程,长尾黄鼠体蚤受到降水增多的抑制后继而影响鼠疫流行的发生。但是,组成鼠疫自然疫源地的3大要素(鼠疫耶尔森菌、媒介和宿主)密不可分,宿主也是维持鼠疫流行的重要生物因素。因此,在后续研究中还应包括多种气象因素对鼠疫流行的共同影响,以及宿主与鼠疫流行间的效应关系等,更全面的掌握气候变化对鼠疫发生、发展及流行规律影响。
利益冲突 无
| [1] |
Ari TB, Neerinckx S, Gage KL, et al. Plague and climate: Scales matter[J]. PLoS Pathog, 2011, 7(9): e1002160. DOI:10.1371/journal.ppat.1002160 |
| [2] |
李海蓉, 王五一, 杨林生, 等. 气候变化与鼠疫流行的耦合分析[J]. 中国人兽共患病杂志, 2005, 21(10): 887-891. Li HR, Wang WY, Yang LS, et al. Coupling analysis of climate change with human plague prevalence[J]. Chin J Zoonoses, 2005, 21(10): 887-891. |
| [3] |
曹汉礼, 张渝疆. 2000-2009年新疆山地鼠疫自然疫源地动物鼠疫疫情形势分析[J]. 疾病预防控制通报, 2011, 26(1): 1-6. Cao HL, Zhang YJ. Analysis of epidemic situation of animal plague in mountainous plague natural foci in Xinjiang from 2000 to 2009[J]. Bull Dis Control Prev, 2011, 26(1): 1-6. DOI:10.13215/j.cnki.jbyfkztb.2011.01.033 |
| [4] |
杨波, 曹汉礼, 雒涛, 等. "十二五"新疆维吾尔自治区鼠疫防控现状分析[J]. 疾病预防控制通报, 2016, 31(3): 28-31. Yang B, Cao HL, Luo T, et al. Analysis of the current situation of plague prevention and control in Xinjiang Uygur Autonomous Region during the 12th Five-Year Plan period[J]. Bull Dis Control Prev, 2016, 31(3): 28-31. DOI:10.13215/j.cnki.jbyfkztb.1605010 |
| [5] |
Cui YJ, Schmid BV, Cao HL, et al. Evolutionary selection of biofilm-mediated extended phenotypes in Yersinia pestis in response to a fluctuating environment[J]. Nat Commun, 2020, 11(1): 281. DOI:10.1038/s41467-019-14099-w |
| [6] |
Bossard RL. Mammal and flea relationships in the Great Basin Desert: From H. J. Egoscue's collections[J]. J Parasitol, 2006, 92(2): 260-266. DOI:10.1645/GE-3545.1 |
| [7] |
Krasnov BR, Shenbrot GI, Khokhlova IS. Phylogenetic patterns in regional flea assemblages from 6 biogeographic realms: Strong links between flea and host phylogenetic turnovers and weak effects of phylogenetic originality on host specificity[J]. Parasitology, 2023, 150(5): 455-467. DOI:10.1017/S003118202300015X |
| [8] |
Ezquiaga MC, Abba AM, Cassini GH, et al. Prevalence and intensity of fleas parasitizing an isolated population of screaming hairy armadillo in Buenos Aires province, Argentina: Host-related factors and temporal dynamics[J]. Parasitol Res, 2017, 116(11): 2895-2900. DOI:10.1007/s00436-017-5595-7 |
| [9] |
Zhang YJ, Dai X, Wang QG, et al. Transmission efficiency of the plague pathogen (Y. pestis) by the flea, Xenopsylla skrjabini, to mice and great gerbils[J]. Parasit Vectors, 2015, 8: 256. DOI:10.1186/s13071-015-0852-z |
| [10] |
Friggens MM, Beier P. Anthropogenic disturbance and the risk of flea-borne disease transmission[J]. Oecologia, 2010, 164(3): 809-820. DOI:10.1007/s00442-010-1747-5 |
| [11] |
Stenseth NC, Samia NI, Viljugrein H, et al. Plague dynamics are driven by climate variation[J]. Proc Natl Acad Sci USA, 2006, 103(35): 13110-13115. DOI:10.1073/pnas.0602447103 |
| [12] |
Pham HV, Dang DT, Minh NNT, et al. Correlates of environmental factors and human plague: An ecological study in Vietnam[J]. Int J Epidemiol, 2009, 38(6): 1634-1641. DOI:10.1093/ije/dyp244 |
| [13] |
Ari TB, Gershunov A, Tristan R, et al. Interannual variability of human plague occurrence in the Western United States explained by tropical and North Pacific Ocean climate variability[J]. Am J Trop Med Hyg, 2010, 83(3): 624-632. DOI:10.4269/ajtmh.2010.09-0775 |
| [14] |
Parmenter RR, Yadav EP, Parmenter CA, et al. Incidence of plague associated with increased winter-spring precipitation in New Mexico[J]. Am J Trop Med Hyg, 1999, 61(5): 814-821. DOI:10.4269/ajtmh.1999.61.814 |
| [15] |
Linardi PM, Krasnov BR. Patterns of diversity and abundance of fleas and mites in the Neotropics: Host-related, parasite-related and environment-related factors[J]. Med Vet Entomol, 2013, 27(1): 49-58. DOI:10.1111/j.1365-2915.2012.01025.x |
| [16] |
Gage KL. Factors affecting the spread and maintenance of plague[J]. Adv Exp Med Biol, 2012, 954: 79-94. DOI:10.1007/978-1-4614-3561-7_11 |
 2024, Vol. 35
2024, Vol. 35


