扩展功能
文章信息
- 钱坤, 关晴晴, 覃盛锋, 王扬
- QIAN Kun, GUAN Qing-qing, QIN Sheng-feng, WANG Yang
- 蜕皮激素和保幼激素对淡色库蚊精氨酸激酶基因CpAK1和CpAK2表达的影响
- Effects of ecdysone and juvenile hormone on arginine kinase genes CpAK1 and CpAK2 in Culex pipiens pallens
- 中国媒介生物学及控制杂志, 2024, 35(3): 281-286, 297
- Chin J Vector Biol & Control, 2024, 35(3): 281-286, 297
- 10.11853/j.issn.1003.8280.2024.03.004
-
文章历史
- 收稿日期: 2023-11-29
精氨酸激酶(Arginine kinase,AK)是无脊椎动物体内唯一磷酸原激酶,通过催化精氨酸和三磷酸腺苷(adenosine triphosphate,ATP)的可逆反应,产生磷酸精氨酸和二磷酸腺苷镁(magnesium adenosine diphosphate,MgADP),是机体能量代谢的关键激酶[1]。昆虫中AK的表达水平会受到精确的调节,以确保ATP含量和细胞能量的平衡[2]。AK的表达水平与昆虫的发育阶段密切相关,而蜕皮激素和保幼激素是调控昆虫生长发育的重要因子[3]。蜕皮激素尤其是最具生物活性的20-羟基蜕皮酮(20-hydroxyecdysone,20E),在昆虫幼虫蜕皮和变态方面发挥着重要的作用[4]。20E的激活直接受2个核受体—蜕皮激素受体(ecdysone receptor,EcR)和超气门蛋白(ultraspiracle protein,USP)的共同调控,只有当EcR和USP形成异源二聚体后,20E方可与EcR结合形成20E-EcR/USP复合体,随后激活诱导Broad-complex(BR-C)等早期应答基因的表达,完成蜕皮反应过程。因此EcR和Br-C是蜕皮激素信号通路上的关键基因[5]。保幼激素(juvenile hormone,JH)是昆虫在发育过程中由咽侧体所分泌的一种激素,在幼虫期保持幼虫蜕皮后的形状与特征,在成虫期促进雌成虫的卵发育和雄成虫的性成熟,参与昆虫的各项生理功能,如蜕皮、化蛹、羽化、生殖等[6-7]。保幼激素受体(methoprene-tolerant,Met)和下游转录因子(kruppel homolog 1,Kr-h1)是保幼激素信号通路上的关键基因,在调控昆虫发育和生殖过程中发挥重要的作用[3]。目前,已在黑腹果蝇(Drosophila melanogaster)、烟夜蛾(Helicoverpa assulta)和中华蜜蜂(Apis cerana cerana)中发现不同发育阶段AK的活性与蜕皮激素滴度变化一致[8-10]。检测家蚕(Bombyx mori)AK基因(BmAK)在幼虫和蛹中的表达发现,BmAK基因的表达量变化趋势与蜕皮激素滴度变化趋势相一致[11]。棉铃虫(Helicoverpa armigera)的AK基因HaAK在多种组织和幼虫发育阶段均有特异性表达,在5龄幼虫的中肠中表达量最高,HaAK的沉默显著延缓了幼虫的发育[12]。本实验室在前期研究中发现CpAK1和CpAK2的表达具有发育阶段特异性,CpAK1和CpAK2在蛹期的表达量较高[13]。本研究在此基础上,利用外源激素处理和RNA干扰信号通路关键基因分析保幼激素和蜕皮激素对CpAK1和CpAK2表达的影响,研究结果阐明了保幼激素和蜕皮激素对淡色库蚊(Culex pipiens pallens)2种AK的调节作用,对深入了解2种AK的功能有重要的意义。
1 材料与方法 1.1 供试虫源淡色库蚊品系引自江苏省疾病预防控制中心,扬州大学植物保护学院养虫室连续多代饲养,饲养条件:温度(27±2)℃、湿度(70±5)%、光周期(L∶D)12 h∶12 h,幼虫期饲喂全营养鼠粮,成虫期饲喂5%~10%蔗糖水,用小白鼠给血繁殖。
1.2 主要试剂和仪器 1.2.1 主要试剂烯虫酯、20-羟基蜕皮酮(Sigma-Aldrich),TAE buffer、DNA Marker[生工生物工程(上海)股份有限公司],TEMED(上海阿拉丁生化科技股份有限公司),Tissue Protein Extraction Kit(康为世纪生物科技公司),HiScript® II Q RT SuperMix for qPCR (+gDNA wiper)试剂、ChamQ Universal SYBR qPCR Master Mix(南京诺唯赞生物科技股份有限公司),10%TGX FastCast Acrylamide Kit、过硫酸氨APS、HRP-coupled secondary anti-rabbit、anti-mouse antibodies、Tanon™ High-sig ECL Western Blotting Kit、TRIZol® reagent、RNase-free ddH2O、75%乙醇溶液、三氯甲烷、异丙醇(中国医药集团有限公司)。
一抗:CpAK1和CpAK2的抗体合成由金斯瑞生物科技股份有限公司完成。分别以CpAK1的C端CIYDISNKRRMGLTE氨基酸序列和CpAK2的C端MASREAFRKYLEGAC氨基酸序列合成肽段作为抗原注射进兔体内进行多克隆抗体制备。
二抗:Goat Anti-rabbit IgG/HRP antibody,购于上海索莱宝生物科技有限公司。
1.2.2 主要仪器微量注射器(Hamilton),显微镜(奥林巴斯有限公司),干式恒温零度金属浴[天根生化科技(北京)有限公司],ChemiDocTM Touch lmaging System(Bio-Rad)、CFX96TM real-time PCR Systems(Bio-Rad)、PCR扩增仪Mastercycler nexus GX2(Eppendorf)、5424R高速冷冻离心机(Eppendorf)、微量移液器(Eppendorf)、DYY-6C型电泳仪(北京六一生物科技有限公司)、DYCP-31CN电泳槽(北京六一生物科技有限公司)、捷达凝胶成像系统(江苏捷达科技发展有限公司)。
1.3 实验方法 1.3.1 20E和烯虫酯处理淡色库蚊蛹用食用色素溶液配制终浓度为2 000 ng/μl的蜕皮激素20E和5 000 ng/μl保幼激素类似物烯虫酯,使用10 μl注射器(Hamilton),在淡色库蚊蛹的腹下第二、三体节间隙注射200 nl激素混合液,对照组注射相同量的未加入激素的色素混合液,分别在注射后1、6、12和24 h收集样品,每个处理3个生物重复,每个重复10头蛹。
1.3.2 RNA干扰蜕皮激素和保幼激素相关基因根据淡色库蚊各基因序列设计dsEGFP、dsBR-C、dsECR、dsKrh-1和dsMet特异性引物进行PCR扩增(表 1)。使用Thermo Fisher Scientific公司的TranscriptAid™ T7 High Yield Transcription Kit试剂盒合成dsBR-C、dsECR、dsKrh-1、dsMet和dsEGFP体外双链。用显微注射法进行RNA干扰。对淡色库蚊蛹分别注射5 000 ng/μl dsBR-C、dsECR、dsKrh-1和dsMet 200 nl,阳性对照组注射5 000 ng/μl的dsEGFP溶液200 nl,同时设立空白对照组(WT组)。每个处理3个生物重复,每个重复10头蛹。
使用组织蛋白提取试剂盒提取蛋白,主要提取步骤如下:
(1) 试虫收集:分别注射20E和烯虫酯,在注射后6 h和12 h收集试虫,称取100 mg试虫,随后立即进行虫体蛋白提取。
(2) 配置1×工作液,取适量预冷的组织蛋白提取试剂,抽提蛋白2~3 min,按照1∶99比例加入蛋白酶抑制剂混合物。
(3) 按照0.1 g组织加入1 ml 1×工作液的比例加入足量的工作液,转移至灭菌后匀浆器中,在冰上匀浆处理,随后冰上孵育20 min。
(4) 10 000 ×g离心20 min,转移上清至新的离心管中,使用二喹琳甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒,进行蛋白浓度测定,稀释同浓度蛋白进行蛋白活性测定。
1.3.4 蛋白印迹法测定(western blot,WB)测定步骤如下:
(1) 制蛋白胶,按照10% TGX FastCast Acrylamide Kit(Bio-Rad)说明书操作。
(2) 纯化蛋白中加入十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)蛋白上样缓冲液,吹打混匀,沸水中煮沸变性10 min。
(3) 将变性后的蛋白上样SDS-PAGE电泳,定压200 V,20 min左右。
(4) 转膜:取出SDS-PAGE蛋白胶,根据蛋白条带的尺寸裁剪聚偏氟乙烯膜(polyvinylidene fluoride,PVDF),甲醇中浸泡1 min,按照3层滤纸、目的蛋白胶、PVDF膜、3层滤纸顺序安装转膜装置,注意对应电极方向;将装置放于冰上,加入电泳液1×Transing buffer没过蛋白胶,定流200 mA,90 min。
(5) 封闭:配置封闭液,配置含5%脱脂牛奶的洗膜缓冲液(tris buffered saline tween,TBST),将PVDF膜浸入封闭液中,置于摇床室温下60 r/min,封闭1 h,倒尽封闭液,用TBST清洗PVDF膜,置于摇床,每次5 min,重复3次。
(6) 孵育:TBST配置一抗混合液(1∶1 000),一抗混合液浸过PVDF膜,置于摇床室温下60 r/min,1 h或过夜;回收一抗混合液,置于摇床,用TBST清洗PVDF膜,每次5 min,重复3次;TBST配置二抗混合液(1∶8 000),二抗混合液浸过PVDF膜,置于摇床室温下60 r/min,1 h。
(7) 回收二抗混合液,置于摇床,用TBST清洗PVDF膜,每次5 min,重复3次;配置显色液:使用增强型化学发光(enhanced chemiLuminescence,ECL)底物试剂盒,其中A液与B液按照1∶1配置,滴在PVDF膜上,5 min后,观察并拍照。
1.3.5 RNA的提取和第1链cDNA合成采用Trizol法分别对不同试验组的淡色库蚊蛹进行RNA提取,将获得的RNA保存于-80 ℃超低温冰箱备用。参照cDNA合成试剂盒(TransScript®ⅡOne-Step gDNA Removal and cDNA Synthesis SuperMix)步骤,合成反转录实时荧光定量PCR(reverse transcription real-time fluorescence quantitative PCR,RT-qPCR)备用的第1链cDNA模板,产物保存于-20 ℃。
1.3.6 RT-qPCR注射20E、烯虫酯处理组,检测CpAK1和CpAK2的mRNA表达量。注射体外双链dsBR-C、dsECR、dsKrh-1和dsMet处理组分别检测CpBR-C、CpECR、CpKrh-1和CpMet的mRNA表达水平。在确认注射双链组有显著干扰效率情况下,再使用同一模板对CpAK1和CpAK2的mRNA表达量进行检测。根据已获得的CpAK1(MZ491206)和CpAK2(MZ491207)以及淡色库蚊CpBR-C、CpECR、CpKrh-1和CpMet基因序列设计特异性荧光定量引物,以淡色库蚊的肌动蛋白β-actin基因作为内参基因,合成特异性引物见表 2。

|
荧光定量10 μl的反应体系:2×SYBR Premix ExTaqⅠ5 μl、正反向引物各0.4 μl、cDNA 1 μl、ddH2O 3.2 μl。将配置好的溶液,短暂离心混匀。使用CFX96™荧光定量PCR仪(Bio-Rad),反应步骤如下:95 ℃预变性30 s;95 ℃变性5 s,58 ℃退火30 s,65 ℃延伸5 s,循环20次。扩增反应的特异性通过熔解曲线分析检测。
1.4 数据分析所有数据均以平均值±标准误表示,使用SPSS 13.0软件进行数据分析,采用One-Way方差分析和最小显著性差异(LSD)法对组间差异性进行比较,P < 0.05为差异有统计学意义。
2 结果 2.1 20E和烯虫酯对CpAK1和CpAK2的调控在淡色库蚊蛹期注射20E或烯虫酯后1、6、12和24 h收集样品,经过实时荧光定量和WB实验分析,发现注射蜕皮激素20E后,CpAK1的mRNA表达水平整体下降,24 h下调至19.77%(图 1A)。而CpAK2的mRNA表达水平上升,6 h和12 h分别上调5.70和2.77倍,24 h恢复正常表达水平(图 1B)。经WB分析发现,6 h CpAK1的蛋白表达水平显著下调,而CpAK2的蛋白表达水平在6 h和12 h均无显著变化。见图 1C、D。
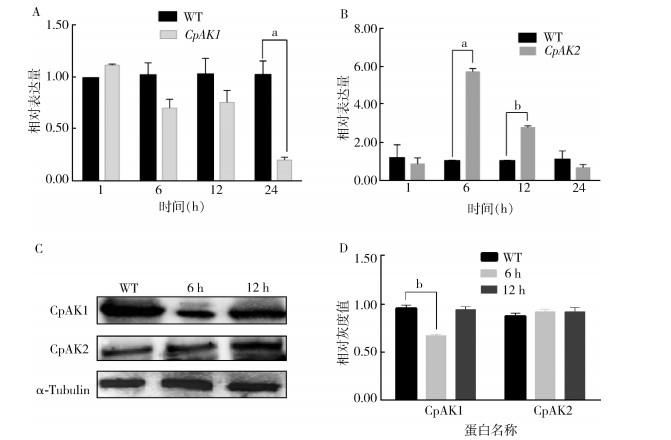
|
| 注:A 20E处理不同时间后CpAK1的相对表达量;B 20E处理不同时间后CpAK2的相对表达量;C 20E处理不同时间后CpAK1和CpAK2蛋白表达水平;D 20E处理不同时间后CpAK1和CpAK2蛋白表达对应的灰度值;α-Tubulin α微管蛋白;数据均以平均值±标准误表示;a P < 0.01;b P < 0.05。WT为对照组,仅注射相同量的未加入激素的色素混合液。 图 1 20E处理对CpAK1和CpAK2的mRNA和蛋白表达水平的影响 Figure 1 The effects of treatment with 20E on the mRNA and protein expression of CpAK1 and CpAK2 |
| |
注射烯虫酯后,CpAK1的mRNA表达水平在1~12 h变化不大,24 h明显上升,为对照组的3.36倍(图 2A)。而CpAK2的mRNA表达水平整体下降,其中在6 h和12 h均显著下降,在12 h达到最低值,仅为对照组的39.34%(图 2B)。在蛋白水平方面,处理6 h和12 h后CpAK1的蛋白水平显著上调,而CpAK2的蛋白水平显著下调。见图 2C、D。
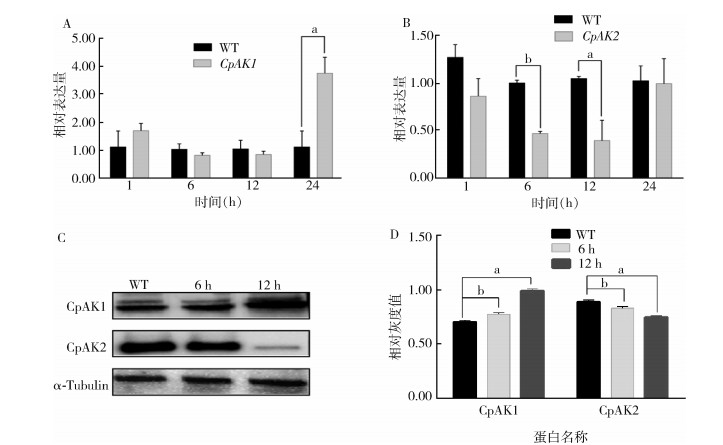
|
| 注:A烯虫酯处理不同时间后CpAK1的相对表达量;B烯虫酯处理不同时间后CpAK2的相对表达量;C烯虫酯处理不同时间后CpAK1和CpAK2蛋白表达水平;D烯虫酯处理不同时间后CpAK1和CpAK2蛋白表达对应的灰度值;α-Tubulin α微管蛋白;数据均以平均值±标准误表示;a P < 0.01;b P < 0.05。WT为对照组,仅注射相同量的未加入激素的色素混合液。 图 2 烯虫酯处理对CpAK1和CpAK2的mRNA和蛋白表达水平的影响 Figure 2 The effects of treatment with methoprene on the mRNA and protein expression of CpAK1 and CpAK2 |
| |
对收集的蛹分别注射dsBR-C和dsECR,通过RT-qPCR技术检测,注射dsBR-C后在12 h有干扰效率,CpBR-C的表达量下调至38.26%。CpBR-C表达量下调导致CpAK1表达水平上调2.35倍,而CpAK2表达水平下调,仅为对照的2.80%,几乎不表达(图 3A)。注射dsECR,在24 h检测干扰效率为47.89%,在CpECR基因表达水平下调情况下,CpAK1表达水平上调8.13倍,而CpAK2表达水平下调42.79%(图 3B)。沉默2种蜕皮激素信号通路相关基因CpBR-C和CpECR,发现对2种AK的调控结果相同,均对CpAK1负调控,而对CpAK2正调控。
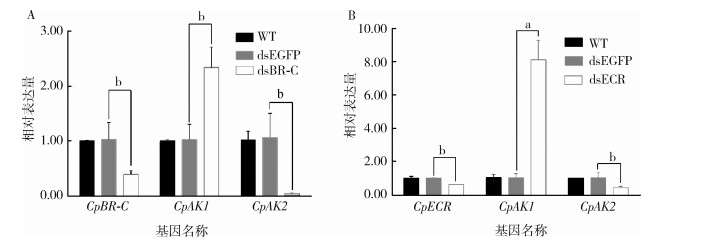
|
| 注:A敲减CpBR-C后CpAK1和CpAK2的相对表达量;B敲减CpECR后CpAK1和CpAK2的相对表达量;数据均以平均值±标准误表示;a P < 0.01;b P < 0.05。WT为空白对照组。 图 3 CpBR-C(A)、CpECR(B)敲减对CpAK1和CpAK2的mRNA表达水平的影响 Figure 3 The effects of knockdown of CpBR-C (A) and CpECR (B) on the mRNA expression of CpAK1 and CpAK2 |
| |
根据淡色库蚊CpMet和CpKr-h1的基因序列,合成设计特异性双链dsMet和dsKr-h1进行蛹期注射干扰,在24 h检测沉默效率分别为60.64%和81.00%,与对照dsEGFP相比,CpMet的沉默导致CpAK1表达水平下调至43.87%,而CpAK2表达水平上调3.05倍(图 4A)。干扰CpKr-h1基因导致CpAK1表达水平下调至13.59%,而CpAK2表达水平上调4.35倍(图 4B)。2种AK对2种保幼激素信号通路相关基因CpMet和CpKr-h1下调响应模式相同,即均对CpAK1正调控,对CpAK2负调控。
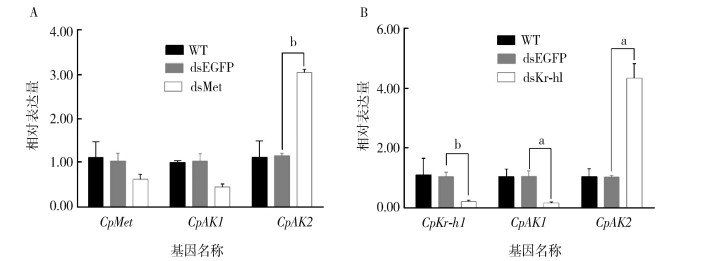
|
| 注:A敲减CpMet对CpAK1和CpAK2的相对表达量;B敲减CpKr-h1后CpAK1和CpAK2的相对表达量;数据均以平均值±标准误表示;a P < 0.01;b P < 0.05。WT为空白对照组。 图 4 CpMet(A)、CpKr-h1(B)敲减对CpAK1和CpAK2的mRNA表达水平的影响 Figure 4 The effects of knockdown of CpMet (A) and CpKr-h1 (B) on the mRNA expression of CpAK1 and CpAK2 |
| |
昆虫正常的生长发育进程是保幼激素和蜕皮激素相互调节的结果,有研究发现AK可能受蜕皮激素和保幼激素的调控,例如使用蜕皮激素处理中华蜜蜂后,观察到AK的表达显著上调[8]。昆虫的滞育阶段受多种激素的共同调控,其中保幼激素的缺乏是引起昆虫滞育的重要因素,分析红尾肉蝇(Sarcophaga crassipalpis)和棉铃虫(H. armigera)滞育阶段蛋白转录组,发现AK的表达下调[14-15]。Zhang等[16]在赤拟谷盗(Tribolium castaneum)中发现,在幼虫到蛹的变态过程中用20E、保幼激素直接处理和沉默20E、保幼激素调控信号通路的相关基因,对TcAK1和TcAK2调控方向相同,即20E负调控TcAK1的表达,正调控TcAK2的表达,而保幼激素对TcAK1的表达正调控,对TcAK2的表达负调控。本研究通过20E或烯虫酯直接注射淡色库蚊蛹也得到相同的结果,20E对CpAK1的表达负调控,对CpAK2正调控,而烯虫酯对CpAK1的表达正调控,对CpAK2负调控。干扰蜕皮激素受体基因CpECR及其转录因子CpBR-C后,CpAK1表达显著上调,CpAK2显著下调。干扰保幼激素受体基因CpMet及其下游转录因子CpKr-h1发现,CpAK1表达下调,CpAK2显著上调。这些结果进一步证实了CpAK1和CpAK2受保幼激素和蜕皮激素的调控,并且2种激素对这2种AK的调控机制完全相反。AK是能量代谢的关键激酶,与昆虫蜕皮、化蛹、羽化、生殖等能量需求高的生命活动密切相关[17]。本研究表明在蚊虫化蛹到羽化的阶段,2种AK的表达水平受到蜕皮激素和保幼激素的调节,总体保持相对恒定,这种调节机制对于维持ATP的稳态具有重要意义。
利益冲突 无
| [1] |
Uda K, Fujimoto N, Akiyama Y, et al. Evolution of the arginine kinase gene family[J]. Comp Biochem Physiol Part D Genomics Proteomics, 2006, 1(2): 209-218. DOI:10.1016/j.cbd.2005.10.007 |
| [2] |
黄丽娜, 刘宁, 赵洁, 等. 精氨酸激酶研究进展[J]. 生命科学研究, 2015, 19(5): 452-456. Huang LN, Liu N, Zhao J, et al. The research prospect of arginine kinase[J]. Life Sci Res, 2015, 19(5): 452-456. DOI:10.16605/j.cnki.1007-7847.2015.05.006 |
| [3] |
Roy S, Saha TT, Zou Z, et al. Regulatory pathways controlling female insect reproduction[J]. Annu Rev Entomol, 2018, 63: 489-511. DOI:10.1146/annurev-ento-020117-043258 |
| [4] |
Niwa R, Niwa YS. Enzymes for ecdysteroid biosynthesis: Their biological functions in insects and beyond[J]. Biosci Biotechnol Biochem, 2014, 78(8): 1283-1292. DOI:10.1080/09168451.2014.942250 |
| [5] |
梁永康, 陈洁, 张文庆. 昆虫蜕皮激素受体调控的基因及通路分析[EB/OL]. 中国科技论文在线, 2016. http://www.paper.edu.cn. Liang YK, Chen J, Zhang WQ. Analyses of the genes and pathways mediated by insect 20 ecdysone receptor[EB/OL]. Sciencepap Online, 2016. http://www.paper.edu.cn. (in Chinese) |
| [6] |
Nur Aliah NA, Ab-Rahim S, Moore HE, et al. Juvenile hormone: Production, regulation, current application in vector control and its future applications[J]. Trop Biomed, 2021, 38(3): 254-264. DOI:10.47665/tb.38.3.066 |
| [7] |
Santos CG, Humann FC, Hartfelder K. Juvenile hormone signaling in insect oogenesis[J]. Curr Opin Insect Sci, 2019, 31: 43-48. DOI:10.1016/j.cois.2018.07.010 |
| [8] |
Chen XB, Yao PB, Chu XQ, et al. Isolation of arginine kinase from Apis cerana cerana and its possible involvement in response to adverse stress[J]. Cell Stress Chaperon, 2015, 20(1): 169-183. DOI:10.1007/s12192-014-0535-2 |
| [9] |
James JM, Collier GE. Hormonally regulated expression of arginine kinase in Drosophila melanogaster[J]. Roux's Arch Dev Biol, 1990, 198(8): 474-478. DOI:10.1007/BF00399058 |
| [10] |
张元臣, 安世恒, 李为争, 等. 烟夜蛾精氨酸激酶基因的克隆及mRNA表达分析[J]. 昆虫学报, 2011, 54(7): 754-761. Zhang YC, An SH, Li WZ, et al. Cloning and mRNA expression analysis of arginine kinase gene from Helicoverpa assulta (Guenée) (Lepidoptera: Noctuidae)[J]. Acta Entomol Sin, 2011, 54(7): 754-761. DOI:10.16380/j.kcxb.2011.07.003 |
| [11] |
王华兵, 徐豫松. 家蚕精氨酸激酶基因的克隆、基因结构与表达分析[J]. 中国农业科学, 2006, 39(11): 2354-2361. Wang HB, Xu YS. cDNA cloning, genomic structure and expression of arginine kinase gene from Bombyx mori (L.)[J]. Sci Agric Sin, 2006, 39(11): 2354-2361. DOI:10.3321/j.issn:0578-1752.2006.11.028 |
| [12] |
Qi XL, Su XF, Lu GQ, et al. The effect of silencing arginine kinase by RNAi on the larval development of Helicoverpa armigera[J]. Bull Entomol Res, 2015, 105(5): 555-565. DOI:10.1017/S0007485315000450 |
| [13] |
Qian K, Guan QQ, Zhang HY, et al. RNAi-mediated knockdown of arginine kinase genes leads to high mortality and negatively affect reproduction and blood-feeding behavior of Culex pipiens pallens[J]. PLoS Negl Trop Dis, 2022, 16(11): e0010954. DOI:10.1371/journal.pntd.0010954 |
| [14] |
Pavlides SC, Pavlides SA, Tammariello SP. Proteomic and phosphoproteomic profiling during diapause entrance in the flesh fly, Sarcophaga crassipalpis[J]. J Insect Physiol, 2011, 57(5): 635-644. DOI:10.1016/j.jinsphys.2011.03.022 |
| [15] |
Lu YX, Xu WH. Proteomic and phosphoproteomic analysis at diapause initiation in the cotton bollworm, Helicoverpa armigera[J]. J Proteome Res, 2010, 9(10): 5053-5064. DOI:10.1021/pr100356t |
| [16] |
Zhang N, Jiang H, Meng XK, et al. Broad-complex transcription factor mediates opposing hormonal regulation of two phylogenetically distant arginine kinase genes in Tribolium castaneum[J]. Commun Biol, 2020, 3(1): 631. DOI:10.1038/s42003-020-01354-w |
| [17] |
张楠, 徐贝贝, 王建军. 精氨酸激酶基因研究进展[J]. 环境昆虫学报, 2017, 39(3): 730-734. Zhang N, Xu BB, Wang JJ. Advances in arginine kinase gene[J]. J Environ Entomol, 2017, 39(3): 730-734. DOI:10.3969/j.issn.1674-0858.2017.03.31 |
 2024, Vol. 35
2024, Vol. 35


