扩展功能
文章信息
- 杨罗菊, 岳巧云, 刘德星, 胡佳, 陈健, 邱德义
- YANG Luo-ju, YUE Qiao-yun, LIU De-xing, HU Jia, CHEN Jian, QIU De-yi
- 广东省中山市城区白纹伊蚊对拟除虫菊酯类杀虫剂的抗药性及其抗性基因突变分析
- Pyrethroid resistance and associated mutations in Aedes albopictus in urban area of Zhongshan, Guangdong Province, China
- 中国媒介生物学及控制杂志, 2024, 35(2): 237-243
- Chin J Vector Biol & Control, 2024, 35(2): 237-243
- 10.11853/j.issn.1003.8280.2024.02.019
-
文章历史
- 收稿日期: 2023-08-18
2 东坑镇社区卫生服务中心疾控办, 广东 东莞 523450;
3 中山火炬职业技术学院, 广东 中山 528436;
4 珠海国际旅行卫生保健中心(拱北海关口岸门诊部), 广东 珠海 519020;
5 广州海关技术中心, 广东 广州 510623
2 Department of Disease Prevention and Control, Community Health Center of Dongkeng Town, Dongguan, Guangdong 523450, China;
3 Zhongshan Torch Polytechnic, Zhongshan, Guangdong 528436, China;
4 Zhuhai International Travel Healthcare Center (Gongbei Customs Port Out-patient Department), Zhuhai, Guangdong 519020, China;
5 Guangzhou Customs District Technology Center, Guangzhou, Guangdong 510623, China
白纹伊蚊(Aedes albopictus), 是一种重要的疾病传播媒介, 可引起登革热、寨卡病毒病和基孔肯亚热等急性传染病的传播[1]。白纹伊蚊起源于东南亚, 是一种入侵性很强的病媒生物, 现已在全世界范围广泛分布[2]。我国大部分地区适合白纹伊蚊栖息, 其中主要分布在华北、华中、华南地区[3]。随着全球经济一体化进程不断发展, 世界旅游、贸易等活动日益增多, 社会和环境因素逐渐影响着病媒生物对疾病的传播, 使得蚊媒传染病的防控形势更加严峻。根据世界卫生组织(WHO)《全球病媒控制对策2017-2030》, 病媒传播疾病总共占全球传染病疾病负担的17%左右, 造成每年约70万人死亡, 全球一半以上人口处于2种或更多蚊媒传染病感染风险中[4]。
目前对于蚊媒传染病的防治手段主要是环境治理和化学防治, 化学防治则不可避免会导致蚊虫对杀虫剂产生抗药性[5]。一项近期对我国登革热流行地区的白纹伊蚊抗药性监测报告显示, 我国登革热流行省份的白纹伊蚊对拟除虫菊酯类杀虫剂已产生了较高抗性, 对氨基甲酸酯类和有机磷类杀虫剂也产生了一定的抗性[6]。广东省部分地区白纹伊蚊种群对常用菊酯类杀虫剂产生了不同程度的抗性[7-8]。蚊虫产生抗药性的机制主要有生化抗性、生理抗性、行为抗性3种, 其中生理抗性中的靶标抗性在蚊虫抗药性形成过程中起着重要作用。靶标抗性即蚊虫体内靶标部位对各类杀虫剂敏感性降低的现象[9]。滴滴涕(DDT)和拟除虫菊酯类杀虫剂的靶标部位是蚊虫体内的电压门控钠离子通道(voltage-gated sodium channel, VGSC), 长期大量使用此类杀虫剂会产生抗性, 称为击倒抗性(knock down resistance, kdr)[10-11]。近年来, 随着分子生物学技术在昆虫抗药性研究中的广泛应用, 也推动了蚊虫抗药性机制的研究, 多项研究已证明VGSC基因点突变与击倒抗性密切相关[12-13]。与击倒抗性有关的VGSC基因突变也称为kdr突变[14]。
中山市位于广东省中南部, 属于亚热带季风气候, 适宜蚊虫生长繁殖[15]。本研究基于生物测定的方法对中山市中心城区白纹伊蚊种群进行抗药性检测, 以了解中山市种群对常用杀虫剂的抗药性现状, 并在分子生物学水平上探索其抗药性产生的机制, 为中山市蚊媒传染病的科学防治提供参考依据。
1 材料与方法 1.1 实验蚊虫根据蚊虫孳生环境特点并结合监测工作开展情况, 2020年7-10月在中山市中心城区5个不同生境采集伊蚊成蚊和幼蚊, 带回实验室饲养, 经形态学鉴定为白纹伊蚊, 采用羽化后3~5 d的雌蚊进行测定。5个采样点分别为办公区(中山海关技术中心, HG)、城中村(三溪村, SX)、居民区(峰景花园, FJ)、城乡结合部(广东药科大学, GY)、公园(金字山森林公园, JZ)。敏感品系白纹伊蚊由广州海关技术中心提供。
1.2 主要试剂和耗材选用0.03%溴氰菊酯、0.4%高效氯氰菊酯、0.4%氯菊酯、0.07%高效氯氟氰菊酯、0.08%顺式氯氰菊酯等5种杀虫剂药膜, 以上药膜由中国疾病预防控制中心传染病预防控制所提供。基因组DNA提取试剂盒(型号:DP304-02)购自天根生化科技有限公司, dNTP、r-TaqDNA聚合酶等购自宝生物工程(大连)有限公司, 引物由赛默飞世尔科技有限公司广州分公司合成。接触筒购自河南智科弘润环保科技有限公司。
1.3 实验方法 1.3.1 成蚊接触筒法参照WHO推荐的成蚊接触筒法, 选择未吸血的白纹伊蚊雌性成蚊进行生物测定。测试条件同饲养条件:温度(25±1)℃, 光周期(L∶D)为14 h∶10 h, 相对湿度60%~80%。将药膜衬垫于接触筒内壁, 吸蚊器吸取25~30只蚊虫放于接触筒内, 1 h后记录击倒蚊虫数。随后抽开隔板, 将蚊虫吹入恢复筒, 关闭隔板直立放置24 h, 用10%葡萄糖溶液喂饲, 记录24 h蚊虫死亡数。每次实验重复3~4次, 并以白油与乙醚混合物作为对照。若5%≤对照组死亡率≤20%, 用Abbott公式进行校正, 若对照组死亡率 > 20%为无效测定, 试验重做。计算公式如下:

|
随机选取5个采样点的白纹伊蚊雌蚊和敏感品系作为基因检测的样本, 使用组织基因组DNA提取试剂盒(型号:DP304-02)提取单只蚊虫基因组DNA。
1.3.3 VGSC基因扩增和测序以白纹伊蚊基因组DNA为模板, PCR扩增VGSC基因第Ⅲ结构域部分片段, 主要检测该片段的1532和1534位点的突变情况。引物序列为:正向aegSCF7 5'-GAGAACTCGCCGATGAACTT-3', 反向aegSCR8 5'-TAGCTTTCAGCGGCTTCTTC-3'。反应体系:10×PCR buffer 5 μl, dNTP 2 μl, 正、反向引物(10 μmol/L)各1 μl, r-Taq酶0.5 μl, DNA模板3 μl, 加ddH2O补至50 μl。反应条件:94 ℃ 5 min;94 ℃ 60 s, 52 ℃ 60 s, 72 ℃ 60 s, 共35个循环;72 ℃ 5 min。PCR扩增产物经1%琼脂糖凝胶电泳检测后, 将目的条带清晰明亮的样品送至广州天一辉远基因科技有限公司进行测序, 测序引物同扩增引物。
1.3.4 抗性判定标准生物测定的结果用死亡率表述, 在诊断剂量下, 死亡率≥98%为敏感种群(S);80%≤死亡率 < 98%为可能抗性种群(M);死亡率 < 80%为抗性种群(R)。
1.3.5 序列比对与统计分析将测得序列在美国国立生物技术信息中心(National Center of Biotechnology Information, NCBI)网站上进行比对, 用Prier Premier 5.0和MEGA 6.0软件进行比对和峰图分析。用SPSS 25.0统计软件进行数据分析, 不同地理种群蚊虫抗药性比较采用R×C列联表χ2检验, 不同地理种群以及野外种群与敏感品系kdr突变率比较采用Fisher确切概率法, 组间多重比较采用Bonferroni法, P < 0.05为差异有统计学意义。
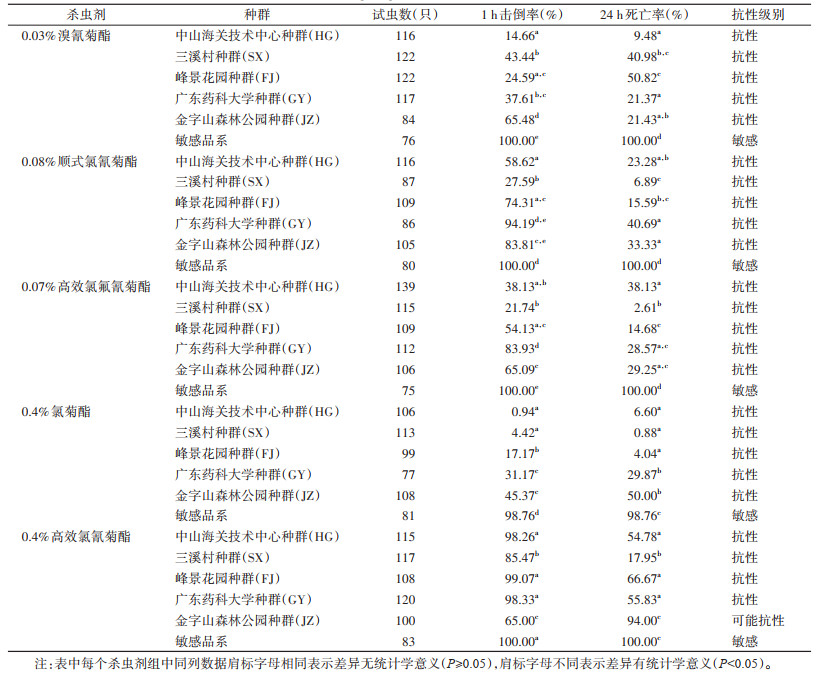
2 结果 2.1 成蚊生物测定结果本次共检测了中山市城区野外白纹伊蚊种群对5种拟除虫菊酯类杀虫剂的抗药性, 结果见表 1。HG、SX、FJ、GY、JZ种群对0.03%溴氰菊酯表现为抗性, 24 h死亡率为9.48%~50.82%;HG、SX、FJ、GY、JZ种群对0.08%顺式氯氰菊酯表现为抗性, 24 h死亡率为6.89%~40.69%;HG、SX、FJ、GY、JZ种群对0.07%高效氯氟氰菊酯表现为抗性, 24 h死亡率为2.61%~38.13%;HG、SX、FJ、GY、JZ种群对0.4%氯菊酯表现为抗性, 24 h死亡率为0.88%~50.00%;除JZ种群对0.4%高效氯氰菊酯表现为可能抗性, 24 h死亡率为94.00%, 其余4个种群均表现为抗性, 24 h死亡率为17.95%~66.67%。实验室敏感品系对5种杀虫剂均表现为敏感。每种杀虫剂中不同种群的1 h击倒率与敏感品系相比, 差异有统计学意义(均P < 0.05);每种杀虫剂中不同种群的24 h死亡率与敏感品系相比, 差异有统计学意义(均P < 0.05)。
|
共提取了318只白纹伊蚊野外种群和30只敏感品系基因组DNA, PCR扩增VGSC基因第Ⅲ结构域的部分片段, 将测序获得的目的片段在NCBI网站上进行比对, 与白纹伊蚊VGSC基因Domains Ⅲ编码区(KC152046.1)部分序列一致性达99.00%, 长度约为400 bp。
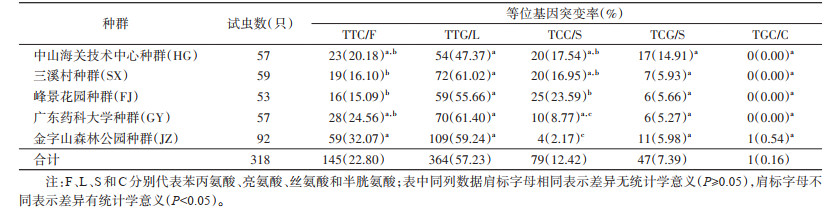
2.3 中山市城区白纹伊蚊VGSC基因的等位基因和基因型及频率分布序列比对结果显示, 1532位点未发现突变, 1534位点存在突变。1532位点只有1种等位基因, 即野生型ATC/I(异亮氨酸), 1种基因型, 即野生型纯合子ATC/ATC(I/I)。1534位点发生了突变, 共有5种等位基因, 即野生型TTC/F(苯丙氨酸), 突变型TTG/L(亮氨酸)、TCC/S(丝氨酸)、TCG/S(丝氨酸)和TGC/C(半胱氨酸)。野生型TTC/F在5个种群中的占比仅为22.80%, 其余均为突变型, 其中突变型TTG/L的占比最高, 为57.23%, 突变型TGC/C出现频率最少, 为0.16%。在5个种群中, 均以突变型TTG/L为主, TGC/C只存在于JZ种群, FJ种群的等位基因突变型占比最高(表 2)。Fisher精确检验结果显示, 5个种群的VGSC基因1534位点等位基因突变率差异有统计学意义(P < 0.05)。采用Bonferroni法多重比较各种群间差异, 结果见表 2。
|
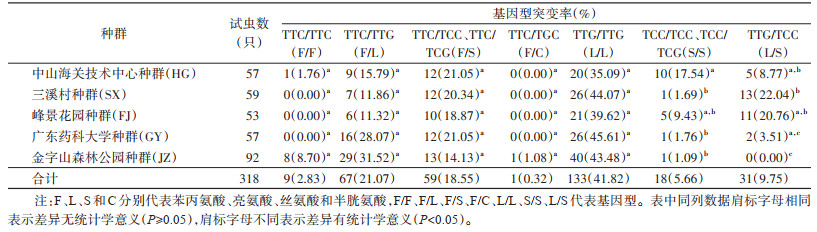
1534位点共有9种基因型, 分别为野生型纯合子TTC/TTC(F/F), 野生/突变型杂合子TTC/TCC(F/S)、TTC/TCG(F/S)、TTC/TTG(F/L)、TTC/TGC(F/C), 突变型纯合子TTG/TTG(L/L)、TCC/TCG(S/S)、TCC/TCC(S/S), 突变型杂合子TTG/TCC(L/S)。其中, 以突变型纯合子L/L占比最高, 为41.82%, 野生型纯合子F/F占比较低, 仅为2.83%。在5个种群中, 均以突变型纯合子L/L为主, 在SX、FJ、GY种群中未见野生型纯合子F/F, 野生型杂合子F/C只存在于JZ种群中(表 3)。Fisher精确检验结果显示, 5个种群的VGSC基因1534位点基因型突变率分布差异有统计学意义(P < 0.05)。采用Bonferroni法多重比较各种群间差异, 结果见表 2。
|
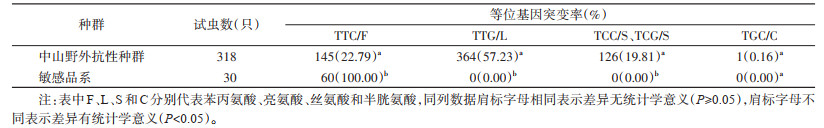
将中山市野外种群和敏感品系的VGSC基因1534位点等位基因突变率进行比较, 经Fisher精确检验, 差异有统计学意义(P < 0.05)。经多重比较结果显示, 野生型TTC/F、突变型TTG/L、TCC/S和TCG/S在两组间的差异均有统计学意义(P < 0.05);突变型TGC/C在两组间的差异无统计学意义(P > 0.05)。见表 4。
|
本次调查显示, 中山市中心城区5个不同生境的白纹伊蚊种群对拟除虫菊酯类杀虫剂均产生了不同程度的抗药性。其中, 只有金字山森林公园种群对0.4%高效氯氰菊酯杀虫剂表现为可能抗药性, 其余种群对5种拟除虫菊酯均产生了抗性。根据对中山市2006-2019年各区、乡镇(街道)媒介蚊虫监测报告显示, 中山市优势蚊种为白纹伊蚊[15-17]。自20世纪80年代以来, 中山市曾发生过多次登革热流行, 流行趋势多数呈散发, 且流行间隔渐趋频繁[17-19]。拟除虫菊酯类杀虫剂因其高效、低毒、低残留、易降解的特点, 在登革热、寨卡病毒病等虫媒传染病的疫情防控工作中被广泛应用。在一项对中国媒介伊蚊抗药性监测研究中, 发现我国白纹伊蚊对拟除虫菊酯类有较高抗性, 且广东省地区抗药性较高[20]。据了解, 中山市每年都会开展防蚊灭蚊专项环境整治活动, 包括统一使用药物喷洒、清理积水、向居民派发灭蚊烟雾片等方式。仅2021年中山市用于灭蚊的药物共5 390.6 kg, 控制面积达943万m2[21]。由于长期大量的使用, 加之居民对杀虫剂使用知识欠缺, 导致媒介昆虫抗药性的问题逐渐凸显。齐亚蒙[22]2015年的监测结果显示, 中山市致倦库蚊(Culex pipiens quinquefasciatus)对四氟甲醚菊酯和氯氟醚菊酯均产生了一定抗性。2020年在一项对中山市城区白纹伊蚊抗药性的检测中, 发现中山市城区白纹伊蚊对溴氰菊酯、DDT和双硫磷产生了一定程度抗性, 对
不同生境的白纹伊蚊种群对5种杀虫剂的抗性程度存在差异。其中, 城中村种群对5种杀虫剂的抗性程度普遍较高, 而森林公园种群的抗性程度相对较低, 可能由于城中村人群居住条件较为密集、环境卫生较差, 使用杀虫剂的年限相对于其他种群较长, 导致蚊虫抗药性加强;森林公园为非居民区, 即使自然地理条件适宜伊蚊生长繁殖, 但杀虫剂使用时间和频数较少, 抗药性程度较低;办公区、居民小区、城乡结合部定期进行消杀行动, 人口流动大, 导致蚊虫抗药性水平较高, 给登革热疫情防控增加了难度。
击倒抗性是蚊虫产生抗性的一种重要机制, 可影响DDT和拟除虫菊酯类杀虫剂对蚊虫的毒杀作用[24]。自Hirata等[25]首次在新加坡白纹伊蚊野外种群中发现kdr突变与抗性形成密切相关后, 在我国, 陆续也有相关研究报道出现。例如, 徐家宝[26]通过建立白纹伊蚊kdr突变与抗性表型的相关性模型, 证明了VGSC基因1534位点突变与蚊虫对溴氰菊酯产生抗性之间存在显著相关。用氯菊酯和高效氯氟氰菊酯对云南省登革热重点地区埃及伊蚊(Ae.aegypti)进行抗药性检测, 发现其抗性表型和敏感表型的V1016G和F1534C突变率差异均存在统计学意义[27]。本研究分析了中山市种群的VGSC基因第Ⅲ结构域部分片段的突变情况, 结果显示1532位点未发生突变, 1534位点发生了较高频率的突变。此外, 通过分析中山市白纹伊蚊种群kdr突变与抗性的关系, 进一步提示kdr突变在蚊虫抗性形成中发挥了一定作用。近年来, 白纹伊蚊VGSC基因突变数据资料不断丰富, 本研究仅分析VGSC基因第Ⅲ结构域部分片段, 关于白纹伊蚊的抗药性机制还有待进一步研究[28-29]。
志谢 感谢广州海关技术中心为本实验提供敏感品系试虫利益冲突 无
| [1] |
Palaniyandi M, Sharmila T, Manivel P, et al. Mapping the geographical distribution and seasonal variation of dengue and chikungunya vector mosquitoes (Aedes aegypti and Aedes albopictus) in the epidemic hotspot regions of India: A step towards the vector control and sustainable health[J]. Appl Ecol Environ Sci, 2020, 8(6): 428-440. DOI:10.12691/aees-8-6-15 |
| [2] |
Kraemer MUG, Sinka ME, Duda KA, et al. The global distribution of the arbovirus vectors Aedes
aegypti and Ae. albopictus
[J]. eLife, 2015, 4. DOI:10.7554/eLife.08347 |
| [3] |
闫冬明, 高源, 吴海霞, 等. 全国21个省2016年白纹伊蚊监测数据分析[J]. 中国媒介生物学及控制杂志, 2019, 30(4): 391-394. Yan DM, Gao Y, Wu HX, et al. An analysis of surveillance data of Aedes albopictus in 21 provinces, China, 2016[J]. Chin J Vector Biol Control, 2019, 30(4): 391-394. DOI:10.11853/j.issn.1003.8280.2019.04.008 |
| [4] |
World Health Organization. Global vector control response 2017-2030[R]. Geneva: WHO, 2017.
|
| [5] |
Jones RT, Ant TH, Cameron MM, et al. Novel control strategies for mosquito-borne diseases[J]. Philos Trans R Soc Lond B Biol Sci, 2021, 376(1818): 20190802. DOI:10.1098/rstb.2019.0802 |
| [6] |
赵春春, 周欣欣, 李文玉, 等. 2020年中国13省份登革热媒介白纹伊蚊抗药性监测及分析研究[J]. 中国媒介生物学及控制杂志, 2022, 33(1): 30-37. Zhao CC, Zhou XX, Li WY, et al. Insecticide resistance surveillance and characteristic analysis of dengue vector Aedes albopictus in 13 provinces of China in 2020[J]. Chin J Vector Biol Control, 2022, 33(1): 30-37. DOI:10.11853/j.issn.1003.8280.2022.01.006 |
| [7] |
段金花, 蔡松武, 吴军, 等. 2014年广东省登革热疫情应急控制后期白纹伊蚊抗药性水平调查[J]. 中国媒介生物学及控制杂志, 2017, 28(2): 141-143. Duan JH, Cai SW, Wu J, et al. Resistance of Aedes albopictus to insecticides in the late stage of emergency control of dengue fever of Guangdong Province in 2014[J]. Chin J Vector Biol Control, 2017, 28(2): 141-143. DOI:10.11853/j.issn.1003.8280.2017.02.011 |
| [8] |
Wei Y, Zheng XL, He S, et al. Insecticide susceptibility status and knockdown resistance (kdr) mutation in Aedes
albopictus in China[J]. Parasit Vectors, 2021, 14(1): 609. DOI:10.1186/s13071-021-05095-5 |
| [9] |
昆虫学名词审定委员会. 昆虫学名词[M]. 北京: 科学出版社, 2001: 69-103. Chinese Committee for Terminology in Entomology. Chinese terms in entomology[M]. Beijing: Science Press, 2001: 69-103. |
| [10] |
唐振华, 吴士雄. 昆虫抗药性的遗传与进化[M]. 上海: 上海科学技术文献出版社, 2000: 218-248. Tang ZH, Wu SX. Heredity and evolution of insect resistance to pesticides[M]. Shanghai: Shanghai Scientific and Technical Literature Press, 2000: 218-248. |
| [11] |
Liu NN. Insecticide resistance in mosquitoes: Impact, mechanisms, and research directions[J]. Annu Rev Entomol, 2015, 60: 537-559. DOI:10.1146/annurev-ento-010814-020828 |
| [12] |
王晓花, 陈辉莹, 杨新艳, 等. 海口市白纹伊蚊对菊酯类杀虫剂的抗药性及击倒抗性基因突变分析[J]. 第二军医大学学报, 2015, 36(8): 832-838. Wang XH, Chen HY, Yang XY, et al. Resistance to pyrethroid insecticides and analysis of knockdown resistance (kdr) gene mutations in Aedes albopictus from Haikou City[J]. Acad J Second Mil Med Univ, 2015, 36(8): 832-838. DOI:10.3724/SP.J.1008.2015.00832 |
| [13] |
谭伟龙, 朱长强, 艾乐乐, 等. 中华按蚊对菊酯类杀虫剂的抗性及kdr突变[J]. 中华卫生杀虫药械, 2015, 21(4): 334-337. Tan WL, Zhu CQ, Ai LL, et al. Pyrethroid resistance and kdr mutations in Anopheles sinensis [J]. Chin J Hyg Insectic Equip, 2015, 21(4): 334-337. DOI:10.19821/j.1671-2781.2015.04.003 |
| [14] |
陈翰明. 我国白纹伊蚊群体遗传结构和击倒抗性突变检测研究[D]. 上海: 海军军医大学, 2019. Chen HM. Detection of genetic structure and knockdown resistance mutations in Aedes albopictus (Diptera: Culicidae) populations from China[D]. Shanghai: Naval Medical University, 2019. (in Chinese) |
| [15] |
刁雅欣. 中山地区蚊类及蚊媒病毒的调查研究[D]. 广州: 广东药科大学, 2018. Diao YX. An investigation of mosquitoes and mosquito-borne viruses in Zhongshan area[D]. Guangzhou: Guangdong Pharmaceutical University, 2018. (in Chinese) |
| [16] |
叶雅芳. 中山市蠓类分布特征及蚊、蠓携带病毒的现状研究[D]. 广州: 广东药科大学, 2020. DOI: 10.27690/d.cnki.ggdyk.2020.000147. Ye YF. Investigation on the distribution of midges and arbovirus of mosquitoes and midges collected in Zhongshan[D]. Guangzhou: Guangdong Pharmaceutical University, 2020. DOI: 10.27690/d.cnki.ggdyk.2020.000147.(inChinese) |
| [17] |
岑永庄, 王曼, 汪涛, 等. 2006-2011年中山市登革热监测结果分析[J]. 华南预防医学, 2013, 39(2): 57-59. Cen YZ, Wang M, Wang T, et al. Analysis of dengue fever surveillance results in Zhongshan City from 2006 to 2011[J]. South China J Prev Med, 2013, 39(2): 57-59. |
| [18] |
任仲强, 李彩琴, 李春玫. 2017-2019年中山地区登革热流行病学调查与分析[J]. 智慧健康, 2021, 7(24): 70-72. Ren ZQ, Li CQ, Li CM. Epidemiological investigation analysis of dengue fever in Zhongshan area from 2017 to 2019[J]. Smart Healthcare, 2021, 7(24): 70-72. DOI:10.19335/j.cnki.2096-1219.2021.24.024 |
| [19] |
李桂娇, 古有婵, 吴宝燕, 等. 中山市登革热的流行特征分析[J]. 疾病控制杂志, 2004, 8(5): 396-398. Li GJ, Gu YC, Wu BY, et al. An analyse of epidemic of dengue fever in Zhongshan City[J]. Chin J Dis Control Prev, 2004, 8(5): 396-398. DOI:10.3969/j.issn.1674-3679.2004.05.004 |
| [20] |
王义冠. 我国登革热媒介伊蚊抗药性监测及抗性数据分析[D]. 北京: 中国疾病预防控制中心, 2016. Wang YG. Insecticides resistance surveillance for dengue vector Aedes in China and data analyses[D]. Beijing: Chinese Center for Disease Control and Prevention, 2016. (in Chinese) |
| [21] |
中山广播电视台. 登革热又杀到!中山开展灭蚊工作的情况如何?[EB/OL]. (2021-05-20) [2023-08-18]. http://www.zsbtv.com.cn/a/bdxw/content_163401.shtml. Zhongshan Radio and Television Station. Dengue fever is here again! What is the status of mosquito control work in Zhongshan City? [EB/OL]. (2021-05-20)[2023-08-18]. http://www.zsbtv.com.cn/a/bdxw/content_163401.shtml. (in Chinese) |
| [22] |
齐亚蒙. 广东中山致倦库蚊代谢抗性机理及增效作用研究[D]. 广州: 华南农业大学, 2017. Qi YM. Metabolic resistance mechanism and synergistic effect of Culex quinquefasciatus in Zhongshan, Guangdong Province[D]. Guangzhou: South China Agricultural University, 2017. (in Chinese) |
| [23] |
古灵满, 郭建宇, 杨雪琴, 等. 2020年中山市区白纹伊蚊抗药性调查[J]. 现代预防医学, 2021, 48(17): 3097-3100. Gu LM, Guo JY, Yang XQ, et al. Investigation on insecticide resistance of Aedes albopictus in Zhongshan City, 2020[J]. Mod Prev Med, 2021, 48(17): 3097-3100. |
| [24] |
唐振华. 昆虫抗药性及其治理[M]. 北京: 农业出版社, 1993: 302-332. Tang ZH. Insect resistance and its management[M]. Beijing: China Agriculture Press, 1993: 302-332. |
| [25] |
Hirata K, Komagata O, Itokawa K, et al. A single crossing-over event in voltage-sensitive Na+ channel genes may cause critical failure of dengue mosquito control by insecticides[J]. PLoS Negl Trop Dis, 2014, 8(8). DOI:10.1371/journal.pntd.0003085 |
| [26] |
徐家宝. 白纹伊蚊拟除虫菊酯类杀虫剂抗性机理研究[D]. 广州: 南方医科大学, 2016. Xu JB. Mechanism study of pyrethroid resistance in Aedes albopictus[D]. Guangzhou: Southern Medical University, 2016. (in Chinese) |
| [27] |
兰学梅, 杨明东, 杨锐, 等. 云南省埃及伊蚊对拟除虫菊酯类抗性群体的击倒抗性基因突变分析[J]. 中国人兽共患病学报, 2020, 36(12): 993-999. Lan XM, Yang MD, Yang R, et al. Analysis of knockdown resistance gene mutations in pyrethroid insecticide resistant populations of Aedes aegypti in Yunnan Province[J]. Chin J Zoonoses, 2020, 36(12): 993-999. DOI:10.3969/j.issn.1002-2694.2020.00.163 |
| [28] |
Zhao CC, Zhou XX, Xue CZ, et al. Knockdown resistance mutations distribution and characteristics of Aedes
albopictus field populations within eleven dengue local epidemic provinces in China[J]. Front Cell Infect Microbiol, 2023, 12: 981702. DOI:10.3389/fcimb.2022.981702 |
| [29] |
Pichler V, Caputo B, Valadas V, et al. Geographic distribution of the V1016G knockdown resistance mutation in Aedes
albopictus: A warning bell for Europe[J]. Parasit Vectors, 2022, 15(1): 280. DOI:10.1186/s13071-022-05407-3 |
 2024, Vol. 35
2024, Vol. 35


