扩展功能
文章信息
- 李轲, 王振旭, 张璐, 伦辛畅, 尚猛, 许磊, 赵宁, 刘起勇
- LI Ke, WANG Zhen-xu, ZHANG Lu, LUN Xin-chang, SHANG Meng, XU Lei, ZHAO Ning, LIU Qi-yong
- 内蒙古自治区锡林郭勒盟2012-2021年气象因素和鼠体蚤指数对长爪沙鼠种群密度的影响
- The impact of meteorological factors and flea index on the density of Meriones unguiculatus in Xilingol League, Inner Mongolia Autonomous Region, China, 2012-2021
- 中国媒介生物学及控制杂志, 2024, 35(2): 212-217
- Chin J Vector Biol & Control, 2024, 35(2): 212-217
- 10.11853/j.issn.1003.8280.2024.02.015
-
文章历史
- 收稿日期: 2023-10-16
2 山东大学公共卫生学院媒介生物控制学系, 山东 济南 250102;
3 清华大学, 北京 100084
2 Department of Vector Control, School of Public Health, Shandong University, Jinan, Shandong 250102, China;
3 Tsinghua University, Beijing 100084, China
长爪沙鼠(Meriones unguiculatus)又称蒙古沙鼠, 属啮齿目鼠科沙鼠亚科沙鼠属, 广泛分布于中国内蒙古自治区(内蒙古)、河北和辽宁省西部等地的干旱和半干旱地区, 是荒漠草原的代表性动物, 尤其偏好栖息在沙质土壤地带。长爪沙鼠可携带多种细菌, 通过蚤类传播鼠疫等疾病, 对公共卫生构成潜在威胁。研究显示, 长爪沙鼠体内检测出了多种微生物和寄生虫, 例如淋巴细胞脉络丛脑膜炎病毒(Lymphocytic choriomeningitis virus)、螺杆菌(Helicobacter spp.)和鼠三毛滴虫(Tritrichomonas muris)等[1]。近年来, 在全国范围内, 大多数鼠疫确诊病例发生在长爪沙鼠鼠疫自然疫源地内[2]。
鼠类种群密度对鼠疫的流行具有至关重要的作用, 高密度的鼠类种群可以为蚤类提供更多的宿主, 从而增加了鼠疫耶尔森菌(Yersinia pestis, 鼠疫菌)的传播机会[3]。研究表明, 长爪沙鼠寄生蚤的感染水平与其种群密度密切相关[4]。与此同时, 气象因素也对长爪沙鼠密度产生显著影响[4-5], 如降水量、气温和相对湿度等, 可以直接对鼠类的种群动态产生影响[6];此外, 气象因素还可通过间接影响草原生态系统的状态, 进而影响鼠类的生存和繁殖[7]。综合考虑鼠类体蚤指数水平和气象因素的影响, 可以更好地理解长爪沙鼠密度的波动以及鼠疫的流行模式, 有助于制定更有效的预防和控制措施, 以减少鼠疫的传播和危害。广义可加模型(generalized additive models, GAMs)是一种由广义线性模型和可加模型发展而来的统计方法, 具备处理响应变量与多个解释变量之间的非线性关系的能力[8]。GAMs可探究不同影响因素的单独作用、多个影响因素同时作用以及影响因素间交互作用对响应变量的影响。
本研究基于2012-2021年锡林郭勒盟长爪沙鼠及其鼠体蚤监测数据, 同时收集同期和滞后0~3个月的气温、降水量和相对湿度等重要气象数据以及归一化植被指数(normalized difference vegetation index, NDVI)等, 采用GAMs深入探究蚤指数、NDVI以及气象因素对长爪沙鼠种群密度的单因素、多因素及交互影响效应, 揭示影响长爪沙鼠密度的关键因素, 为长爪沙鼠种群密度预测、防制以及相关风险管理提供科学依据。
1 材料与方法 1.1 资料来源2012-2021年长爪沙鼠密度、长爪沙鼠体蚤指数等数据来源于中国疾病预防控制信息系统鼠疫防治管理信息系统, 覆盖锡林郭勒盟11个旗(县、市、区)。气象数据来源于中国科学院资源环境科学与数据中心(https://www.resdc.cn/Default.aspx), 主要包括月平均气温、月平均最高气温、月平均最低气温、月累计降水量、月平均相对湿度、月平均地温、月平均气压、月平均风速、月平均蒸发量、月平均日照时数等。NDVI来源于美国航空航天局(National Aeronautics and Space Administration, NASA)(https://search.earthdata.nasa.gov/search)定期发布的中分辨率成像光谱仪(moderate-resolution imaging spectroradiometer, MODIS)数据集下的MOD13A3数据。NDVI是反映植被生长状态及其覆盖度的一种遥感指标, 目前在植被变化监测的研究中得到了广泛应用。长爪沙鼠密度、鼠体蚤指数按照各个旗(县、市、区)整理为月平均鼠密度和月平均鼠体蚤指数, 同期的气象数据和NDVI以月为单位进行整理。考虑到气象因素存在滞后效应, 本研究对气象因素进行0~3个月的滞后。
1.2 研究方法利用R 4.2.2 “mgcv”程序包中的“gam”函数GAMs建模。以长爪沙鼠密度作为响应变量, 同期以及滞后0~3个月的气象数据、NDVI、蚤指数等为解释变量建立广义可加模型, 将单因素分析有意义的变量纳入广义可加模型进行多因素分析。同时将多因素分析有意义的变量进行共线性诊断, 并带入交互作用模型进行分析。通过计算各解释变量的方差膨胀因子(variance inflation factor, VIF)来进行共线性诊断。采用GAMs分析各影响因素对长爪沙鼠密度的影响效应, 其模型方程如下:
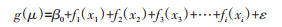
|
式中, g(μ)为连接函数, 本研究中使用类泊松(quasi-Poisson)分布作为连接函数;μ为监测点长爪沙鼠密度的期望值;x1, x2, x3, …, xi为解释变量, 本研究的解释变量主要为对应监测点的长爪沙鼠体蚤指数、NDVI以及各种气象因素等;f1()+ f2()+ f3()+…+ fi()代表各种平滑函数, 本研究使用样条平滑函数;β0表示截距, ε为误差项。根据模型的校正后决定系数(R2)、偏差解释百分比和广义交叉验证指数(generalized cross validation, GCV)选择最优模型[9]。R2和偏差解释百分比最大, GCV最小的模型为最优模型。
将多因素分析有意义的变量带入交互作用模型, 其模型方程如下:
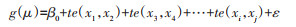
|
式中, g(μ)为连接函数;x1, x2, x3, x4…, xi, xj为解释变量;te()为张量积平滑函数;β0表示截距, ε为误差项。
2 结果 2.1 单因素分析以长爪沙鼠密度作为响应变量, 滞后0~3个月气象数据以及NDVI等41个变量作为解释变量, 连接函数选取类泊松分布, 采用自然立方样条平滑函数, 进行单因素分析。通过GAMs模型给出的F值、P值、偏差解释百分比来判断不同解释变量对长爪沙鼠密度变化的影响显著性及模型的拟合优度。共14个解释变量在P < 0.05水平下对长爪沙鼠密度变化影响显著, 其中仅有滞后1个月的月平均相对湿度和滞后1个月的月平均日照时数的自由度为1。偏差解释百分比的高低代表单一解释变量对长爪沙鼠密度变化的影响程度, 对长爪沙鼠密度影响程度最高的变量为滞后3个月的月平均最低气温(9.63%), 最低的为滞后2个月的月平均日照时数(3.54%)。见表 1。
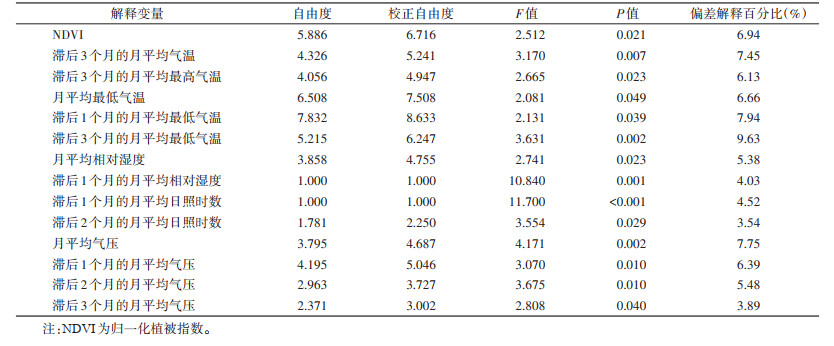
|
将上述单因素分析中通过显著性检验的变量纳入广义可加模型进行多因素分析, 同时根据研究目的加入蚤指数和时间趋势。根据R2和偏差解释百分比最大、GCV最小的准则进行模型择优, 最终纳入模型的变量为体蚤指数、时间(年)、滞后3个月的月平均最低气温、月平均相对湿度、滞后1个月的月平均日照时数以及滞后2个月的月平均气压, 最优模型的R2为0.26, 偏差解释百分比和GCV分别为32.70%和1.14。进一步进行共线性检验, 纳入变量间VIF均 < 2, 变量间不存在共线性, 见表 2。
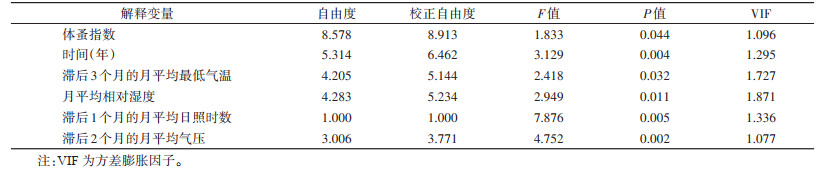
|
除滞后1个月的月平均日照时数与长爪沙鼠密度呈线性关系以外, 其他解释变量与长爪沙鼠密度均呈非线性关系。长爪沙鼠鼠体蚤指数与鼠密度呈非线性关系, 随着体蚤指数的升高, 鼠密度总体呈现下降趋势(图 1A)。此外, 锡林郭勒盟长爪沙鼠密度在2014和2019年出现了2个小高峰, 呈现出明显的时间趋势(图 1B)。气象因素方面, 滞后3个月的月平均最低气温与长爪沙鼠密度存在非线性的正相关, 具体表现为, 鼠密度随着月平均最低气温的升高, 呈现出先升高再降低再升高的趋势(图 1C)。月平均相对湿度与长爪沙鼠密度存在线性负相关, 随着月平均相对湿度的升高, 长爪沙鼠密度总体呈现出下降趋势(图 1D);滞后1个月的月平均日照时数与长爪沙鼠密度呈线性正相关(图 1E);鼠密度与滞后2个月的月平均气压呈现出倒“U”形的关系, 鼠密度随着气压的升高先上升再下降, 约在880 hPa时达到高峰(图 1E)。
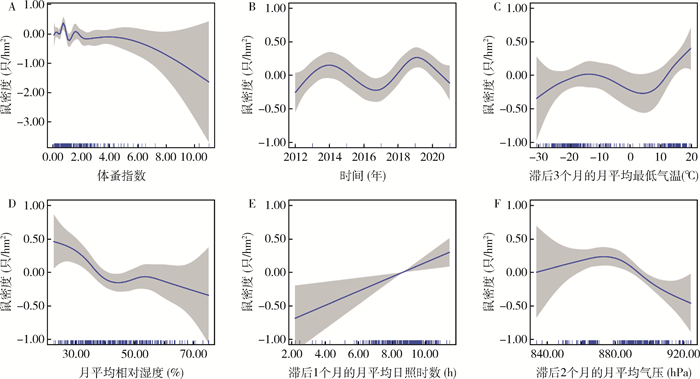
|
| 图 1 广义可加模型对长爪沙鼠种群密度的多因素分析结果 Figure 1 Generalized additive model-based multivariable analysis results of Meriones unguiculatus density |
| |
体蚤指数-滞后3个月的月平均最低气温和体蚤指数-月平均相对湿度2个交互项对鼠密度的影响有统计学意义, 即存在交互作用(F=2.689, P=0.009;F=2.644, P=0.017)。长爪沙鼠密度在鼠体蚤指数与其他气象因素交互效应下各有不同, 具体表现为:体蚤指数处于较低水平时, 鼠密度随着滞后3个月的月平均最低气温的升高, 呈现出波动上升趋势;而在体蚤指数较高时, 鼠密度随着月平均最低气温的升高呈现出钟型变化, 约在-2 ℃出现峰值(图 2A)。随着体蚤指数的升高, 无论月平均相对湿度处于较高还是较低水平, 鼠密度均降低;在体蚤指数较低时, 鼠密度随着月平均相对湿度的升高呈下降趋势;而在体蚤指数较高时, 鼠密度随着月平均相对湿度的增加先升后降, 在约48.00%时达到峰值(图 2B)。
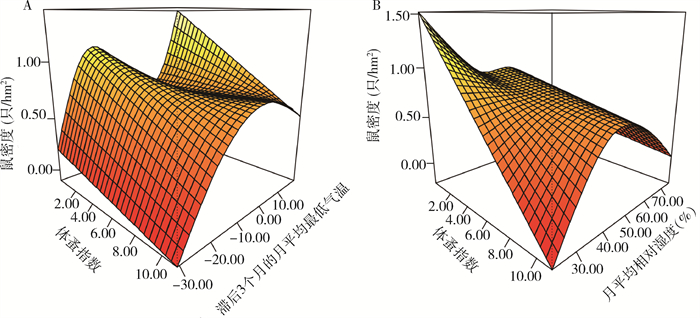
|
| 图 2 滞后3个月的月平均最低气温和月平均相对湿度与蚤指数的交互作用对长爪沙鼠密度影响的三维空间图 Figure 2 Three-dimensional graphs illustrating the interaction effects of lag-3-month average monthly minimum temperature and average monthly relative humidity with the flea index on Meriones unguiculatus density |
| |
本研究基于锡林郭勒盟11个旗(县、市、区)2012-2021年的鼠疫监测数据, 利用GAMs分析了气象因素、NDVI以及体蚤指数对长爪沙鼠密度的影响, 探讨了气象因素和体蚤指数对长爪沙鼠密度影响的交互作用, 揭示了长爪沙鼠、鼠体蚤指数及气象因素之间存在着显著的非线性关系、且各气象因素对长爪沙鼠密度的影响存在滞后效应, 鼠体蚤指数与气象因素及气象因素之间对长爪沙鼠密度的影响存在交互作用。
研究表明, 长爪沙鼠密度与其体蚤指数呈非线性负相关关系。这一现象可用蚤感染能通过扰乱鼠类的免疫、行为、繁殖以及传播疾病等多种方式来影响鼠密度的研究进行解释[10]。具体而言, 一方面, 蚤感染可能会影响宿主的生育和繁殖, 导致其生育能力下降或产仔率减少;另一方面, 蚤类还是许多病原体的传播媒介, 较高的体蚤指数有利于病原体在动物宿主之间传播, 从而导致鼠类种群密度的降低[11]。
大量研究显示, 气温对鼠类密度影响显著, 且存在滞后效应[12-13]。本研究锡林郭勒盟长爪沙鼠密度与3月前月平均最低气温呈波动上升趋势, 提示低温可能对长爪沙鼠种群的生存造成不利影响。锡林郭勒盟位于中国内蒙古东北部, 属温带大陆性气候, 自10月开始月平均气温已经降至0 ℃以下, 并持续至次年4月。极端的低温环境强迫长爪沙鼠消耗更多的能量来维持基础代谢[14], 通过影响鼠类代谢、繁殖、活动、存活率以及食物获取等方式影响鼠类密度。长爪沙鼠的繁殖期主要在5-8月, 随着气温的下降, 进入繁殖休止-贮食期[14], 此时的沙鼠需要耗费更多的能量和时间进行觅食和储存食物而非繁殖活动[15], 从而导致鼠类种群密度的下降;同时, 气温的变化还会直接影响植物的生长, 尤其在极端低温环境下导致鼠类种群获取食物困难[16]。
本研究结果显示, 月平均相对湿度与长爪沙鼠密度呈非线性负相关, 与之前月平均相对湿度与鼠密度之间存在显著的正相关研究结果存在不同[17]。这可能是由于相比于其他鼠类, 长爪沙鼠栖息的荒漠草原生境降水少, 相对湿度低。目前关于相对湿度对鼠类直接作用的研究相对较少, 主要是通过影响其寄生蚤或者植物生长间接调控鼠类种群密度。Krasnov等[18]发现, 相对湿度可以通过降低蚤的雌性比例来调控其繁殖。除此之外, 相对湿度还能影响蚤的发育速度和生命周期。Kreppel等[19]的研究指出, 低湿度能够延缓蚤的发育时间, 加速其死亡, 相反, 高湿度环境能增高蚤类丰度以及孳生相关细菌和利于某些疾病的传播, 更易对鼠类造成负担, 从而导致鼠密度的下降。
随着滞后1个月月平均日照时数的增加, 长爪沙鼠密度呈线性上升。日照时数的季节性变化通常与长爪沙鼠的繁殖季节相关, 更长的日照时间可以促进繁殖行为。较长日照时间可能会触发雌鼠释放雌二醇, 从而促进雌性鼠类的卵子成熟[20]。同样, 雄鼠在长日照时数的夏季睾丸质量和雄激素水平达到峰值[21-22], 导致鼠类种群密度增加。
国内有学者指出, 滞后1个月的月平均气压对当月的鼠密度有影响[13], 这与本研究结果基本一致。长爪沙鼠密度随着滞后2个月的月平均气压的升高, 呈现出先升后降的趋势。目前关于气压如何影响鼠类种群密度方面的研究还存在空白, 本研究所得到的结果仅表明气压与鼠密度之间存在着统计学关联, 是否存在实际生物学意义还需进一步研究。
体蚤指数对长爪沙鼠密度的影响随着滞后3个月的月平均最低气温和月平均相对湿度的变化而变化。月平均最低气温较高, 而蚤指数较低时, 此时鼠密度最高。这一现象可能是由于较高的最低气温能给长爪沙鼠提供良好的生存条件, 使其更容易寻找食物和进行繁殖。而较低的体蚤指数降低了蚤对长爪沙鼠的寄生压力, 有利于鼠密度的增加。同样, 相对湿度较低且体蚤指数也低时, 鼠密度最高。这可能是较低的相对湿度不利于蚤的存活以及繁殖, 从而降低了寄生蚤对长爪沙鼠的影响, 此时鼠密度最高。这一复杂的交互作用现象凸显了在不同体蚤指数水平下, 气温以及相对湿度对长爪沙鼠密度影响的差异性, 但还需要深入的生态学研究来解析这些交互作用的机制, 以便更全面地理解长爪沙鼠密度的动态变化。
综上所述, 本研究基于锡林郭勒盟长爪沙鼠和鼠体蚤监测数据, 以及与气象条件相关的多种因素, 探究了蚤指数和相关气象因素对长爪沙鼠密度影响的复杂关系。这一发现有助于深入理解长爪沙鼠种群密度的动态变化, 为应对鼠害和鼠传疾病提供理论指导。未来研究可深入探讨其他生态因素如食物资源、天敌对长爪沙鼠密度的影响, 以更全面地了解其种群动态驱动机制, 为管理和控制鼠类种群提供针对性的策略, 从而减少鼠传疾病的公共卫生风险。
利益冲突 无
| [1] |
戴方伟, 杜江涛, 周莎桑, 等. 普通环境长爪沙鼠种群中病原体携带情况普查[J]. 中国比较医学杂志, 2017, 27(11): 15-18, 31. Dai FW, Du JT, Zhou SS, et al. Investigation of pathogen infections in Mongolian gerbils raised in a conventional facility[J]. Chin J Comp Med, 2017, 27(11): 15-18, 31. DOI:10.3969/j.issn.1671-7856.2017.11.004 |
| [2] |
汤德铭, 吕东月, 阿塞提·布开, 等. 2000-2020年中国人间鼠疫分布特征分析[J]. 中国校医, 2022, 36(4): 260-264, 282. Tang DM, Lyu DY, Asaiti BK, et al. Distribution characteristics of human plague in China, 2000-2020[J]. Chin J School Doctor, 2022, 36(4): 260-264, 282. |
| [3] |
Sun Z, Xu L, Schmid BV, et al. Human plague system associated with rodent diversity and other environmental factors[J]. R Soc Open Sci, 2019, 6(6): 190216. DOI:10.1098/rsos.190216 |
| [4] |
牛艳芬, 张懿晖, 康东梅, 等. 河北省长爪沙鼠及其巢蚤密度与气象因素关系[J]. 中国媒介生物学及控制杂志, 2022, 33(5): 684-688. Niu YF, Zhang YH, Kang DM, et al. Relationship between population densities of Meriones unguiculatus and its nest fleas and meteorological factors in M. unguiculatus plague foci of Hebei Province, China[J]. Chin J Vector Biol Control, 2022, 33(5): 684-688. DOI:10.11853/j.issn.1003.8280.2022.05.013 |
| [5] |
刘伟, 钟文勤, 王德华. 内蒙古农牧交错带长爪沙鼠种群存活的季节格局及其动态机制[J]. 兽类学报, 2020, 40(6): 571-584. Liu W, Zhong WQ, Wang DH. Seasonal dynamic of population survival and its mechanism in Mongolian gerbils (Meriones unguiculatus) in the Inner Mongolia agro-pastoral ecotone[J]. Acta Theriol Sin, 2020, 40(6): 571-584. DOI:10.16829/j.slxb.150431 |
| [6] |
Biggins DE, Eads DA. Prairie dogs, persistent plague, flocking fleas, and pernicious positive feedback[J]. Front Vet Sci, 2019, 6: 75. DOI:10.3389/fvets.2019.00075 |
| [7] |
Xu L, Schmid BV, Liu J, et al. The trophic responses of two different rodent-vector-plague systems to climate change[J]. Proc Biol Sci, 2015, 282(1800): 20141846. DOI:10.1098/rspb.2014.1846 |
| [8] |
Ravindra K, Rattan P, Mor S, et al. Generalized additive models: Building evidence of air pollution, climate change and human health[J]. Environ Int, 2019, 132: 104987. DOI:10.1016/j.envint.2019.104987 |
| [9] |
Pedersen EJ, Miller DL, Simpson GL, et al. Hierarchical generalized additive models in ecology: An introduction with mgcv[J]. PeerJ, 2019, 7. DOI:10.7717/peerj.6876 |
| [10] |
Hawlena H, Krasnov BR, Abramsky Z, et al. Effects of food abundance, age, and flea infestation on the body condition and immunological variables of a rodent host, and their consequences for flea survival[J]. Comp Biochem Physiol A Mol Integr Physiol, 2008, 150(1): 66-74. DOI:10.1016/j.cbpa.2008.03.004 |
| [11] |
Bron GM, Malavé CM, Boulerice JT, et al. Plague-positive mouse fleas on mice before plague induced die-offs in black-tailed and white-tailed prairie dogs[J]. Vector Borne Zoonotic Dis, 2019, 19(7): 486-493. DOI:10.1089/vbz.2018.2322 |
| [12] |
侯祥, 韩宁, 封托, 等. 气候因素对黑线姬鼠种群动态影响的非线性效应[J]. 生态学报, 2020, 40(14): 4836-4841. Hou X, Han N, Feng T, et al. Nonlinear effects of climate on population dynamics of Apodemus agrarius [J]. Acta Ecol Sin, 2020, 40(14): 4836-4841. DOI:10.5846/stxb201904240836 |
| [13] |
王金娜, 劳家辉, 侯娟, 等. 气象因素对鼠密度的影响研究[J]. 预防医学, 2018, 30(9): 870-873, 878. Wang JN, Lao JH, Hou J, et al. Effect of meteorological factors on rodent density[J]. Prev Med, 2018, 30(9): 870-873, 878. DOI:10.19485/j.cnki.issn2096-5087.2018.09.002 |
| [14] |
张学英, 迟庆生, 刘伟, 等. 长爪沙鼠的行为和生理生态学研究进展[J]. 中国科学: 生命科学, 2016, 46(1): 120-128. Zhang XY, Chi QS, Liu W, et al. Studies of behavioral and physiological ecology in Mongolian gerbils (Meriones unguiculatus)[J]. Sci Sin Vitae, 2016, 46(1): 120-128. DOI:10.1360/N052015-00223 |
| [15] |
刘伟, 宛新荣, 钟文勤, 等. 长爪沙鼠种群繁殖的季节性特征[J]. 兽类学报, 2013, 33(1): 35-46. Liu W, Wan XR, Zhong WQ, et al. Characteristics of seasonal reproduction in Mongolian gerbils (Meriones unguiculatus)[J]. Acta Theriol Sin, 2013, 33(1): 35-46. DOI:10.16829/j.slxb.2013.01.005 |
| [16] |
郭强, 王玉琴, 鲍根生, 等. 气象因子对高原鼢鼠种群数量的影响[J]. 草业学报, 2020, 29(8): 188-194. Guo Q, Wang YQ, Bao GS, et al. Effect of meteorological factors on the population of plateau zokor[J]. Acta Pratacult Sin, 2020, 29(8): 188-194. DOI:10.11686/cyxb2019474 |
| [17] |
费蕾, 汪祖国, 姚瑶, 等. 上海奉贤区农田鼠类种群数量变动以及气候和耕作因素的影响[J]. 应用生态学报, 2015, 26(2): 579-587. Fei L, Wang ZG, Yao Y, et al. Population change of farmland rodent and the influences of climate and cultivation factors in Fengxian District of Shanghai, China[J]. Chin J Appl Ecol, 2015, 26(2): 579-587. DOI:10.13287/j.1001-9332.2015.0005 |
| [18] |
Krasnov BR, Khokhlova IS, Fielden LJ, et al. Effect of air temperature and humidity on the survival of pre-imaginal stages of two flea species (Siphonaptera: Pulicidae)[J]. J Med Entomol, 2001, 38(5): 629-637. DOI:10.1603/0022-2585-38.5.629 |
| [19] |
Kreppel KS, Telfer S, Rajerison M, et al. Effect of temperature and relative humidity on the development times and survival of Synopsyllus fonquerniei and Xenopsylla cheopis, the flea vectors of plague in Madagascar[J]. Parasit Vectors, 2016, 9: 82. DOI:10.1186/s13071-016-1366-z |
| [20] |
田晓康, 仲蕊, 钱冰, 等. 光照强度和光照时间对性未成熟小鼠雌二醇的影响[J]. 中国儿童保健杂志, 2015, 23(2): 150-152. Tian XK, Zhong R, Qian B, et al. Effect of illumination intensity and time on estradiol of immature mouse[J]. CJCHC FEB, 2015, 23(2): 150-152. DOI:10.11852/zgetbjzz2015-23-02-12 |
| [21] |
Stevenson KT, Van Tets IG, LAI Nay. The seasonality of reproduction in photoperiod responsive and nonresponsive northern red-backed voles (Myodes rutilus) in Alaska[J]. Can J Zool, 2009, 87(2): 152-164. |
| [22] |
Velez S, Sassi PL, Borghi CE, et al. Effect of climatic variables on seasonal morphological changes in the testis and epididymis in the wild rodent Microcavia australis from the Andes Mountains, Argentina[J]. J Exp Zool A Ecol Genet Physiol, 2010, 313(8): 474-483. DOI:10.1002/jez.619 |
 2024, Vol. 35
2024, Vol. 35


