扩展功能
文章信息
- 王淼, 简藓懿, 刘庆, 梁国锐, 谢静文, 王明, 姜玉庭, 赵彤言, 郭晓霞
- WANG Miao, JIAN Xian-yi, LIU Qing, LIANG Guo-rui, XIE Jing-wen, WANG Ming, JIANG Yu-ting, ZHAO Tong-yan, GUO Xiao-xia
- 低温和短日照诱导白纹伊蚊滞育的代谢适应研究
- Metabolic adaptation associated with diapause in Aedes albopictus induced by low temperature and short sunshine duration
- 中国媒介生物学及控制杂志, 2024, 35(2): 145-149
- Chin J Vector Biol & Control, 2024, 35(2): 145-149
- 10.11853/j.issn.1003.8280.2024.02.003
-
文章历史
- 收稿日期: 2023-11-29
2 军事科学院军事医学研究院微生物流行病研究所, 病原微生物生物安全全国重点实验室, 北京 100071
2 State Key Laboratory of Pathogen and Biosecurity, Institute of Microbiology and Epidemiology, AMMS, Beijing 100071, China
白纹伊蚊(Aedes albopictus)是登革、寨卡等病毒的重要传播媒介[1],同时也是最具生物入侵能力的蚊虫之一[2],其在全球的快速播散和定殖增加了虫媒传染病的暴发风险。白纹伊蚊广泛分布于我国的温带和亚热带地区,滞育卵是白纹伊蚊越冬的主要形式。滞育是由昆虫个体内在的、中央的调节指令发出,使原来的直接发育转变为选择性的发育停滞的系列程序性生理学过程[3],是昆虫为度过极寒或极干燥环境所进化出的一种保护性机制。滞育赋予白纹伊蚊较强的抗寒冷、抗干燥等抗逆性,是其种群实现快速扩张、定殖的重要生物学基础之一,亦为相关虫媒传染病的广泛蔓延提供了有利条件[4]。影响白纹伊蚊滞育的外界环境因子主要包括光周期、温度和湿度,其中光周期和温度被认为是对白纹伊蚊滞育最重要的环境因子。
位于不同气候区的白纹伊蚊地理株对滞育诱导因素的反应以及滞育发生的强度不同,其代谢活动和卵内发生的生化反应也受到不同程度的抑制[3]。滞育期间,白纹伊蚊体内生化物质的变化是决定其能否成功度过不利环境的因素之一。蚊虫体内耐寒物质的积累是一个复杂的生理生化过程,多种生化物质在酶的作用下相互转化,相互影响,综合作用[5-6]。在越冬的不同时期,蚊虫体内各种耐寒性物质含量有不同的变化规律。淡色库蚊(Culex pipiens pallens)以成虫滞育越冬,在此期间体内发生变化的生化物质主要有蛋白质、脂肪、氨基酸、糖原(glycogen,Gn)以及含水量等[7-8],脂肪在滞育期间进行大量的累积[9],海藻糖(trehalose)含量在越冬期先增加后减少[10]。白纹伊蚊以卵滞育,与非滞育卵相比,滞育卵抵抗寒冷[11]、抗干燥[12]的能力强,并且体积较大,脂质储存量更大[13]。有关白纹伊蚊及其滞育卵中海藻糖、山梨醇(sorbitol)等生化物质含量的差异鲜有报道。
本实验针对滞育诱导条件下的白纹伊蚊成蚊及滞育维持期蚊卵的生化物质进行测定,比较其代谢变化,为更加深入地了解白纹伊蚊滞育的生理特点,揭示白纹伊蚊滞育机制提供基础数据,为寻找新的蚊媒防制靶点提供思路。
1 材料与方法 1.1 白纹伊蚊实验室养殖实验所用白纹伊蚊为2023年4月在广州市野外采集(地理坐标:N23°8',E113°17'),在实验室传至第5代。养殖室标准饲养条件为(27±1)℃,(70±10)%相对湿度,光照周期(L∶D)为14 h∶10 h。成蚊饲养在25 cm×25 cm×25 cm定制蚊笼中,使用8%的葡萄糖溶液饲喂。
1.2 实验设计在养殖室标准条件下将蚊虫饲养至Ⅳ龄后转入光照培养箱,开始低温短日照诱导白纹伊蚊产滞育卵,诱导条件:光周期(L∶D)为8 h∶16 h,温度为21 ℃。对照组蚊虫在标准条件下养殖。
1.3 卵的保存实验组及对照组成蚊羽化7~10 d后供给SPF(specific pathogen free)级小鼠血,2 d后浸湿滤纸放入卵杯供蚊虫产卵。4 d后取出卵纸,放入盛有饱和硝酸钾的卵缸内,保存于对应光周期的光照培养箱内,使胚胎发育完全。产卵后30 d,滞育卵处于滞育期的维持阶段,将蚊卵及产卵后成蚊从光照培养箱中取出进行指标检测。
1.4 白纹伊蚊滞育卵的判断及滞育率计算在500 ml水中加入500 mg幼虫饲料在养虫室内静置24 h制作去氯孵化水,将蚊卵进行第1次孵化,24 h后取出晾干放回对应培养箱中,发育7 d后的卵纸取出进行第2次孵化,24 h后取出晾干。未孵化的完整卵用漂白液(配方为次氯酸120 ml,冰醋酸80 ml加入去离子水定容至1 L,常温避光储存)进行漂白,在显微镜下观察、拍摄,记录滞育卵数。滞育卵的判断标准:漂白后,滞育卵在反射光下通体呈现乳白色,卵胚发育完整,腹节分明,头部有红色眼点,头部孵化刺骨化呈黄褐色。滞育率按照以下公式计算:
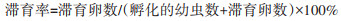
|
人工气候箱(Bluepard,上海一恒)、冷冻离心机(5430R,德国Eppendorf)、制冰机、恒温水浴锅(HW.SY21-KP4,北京长风)、酶标仪(Spectra Max M5,美国Molecular Devices)、研磨仪(N9524R,北京赫德)、电子天平(CP225D,德国Sartorius)
1.6 化学试剂浓硫酸、异丙醇、正庚烷,总糖(total sugar,tga)、糖原、总胆固醇(total cholesterol,Tc)、山梨醇、海藻糖(alfa)和甘油三酯(triglyceride,TG)检测试剂盒均为北京Boxbio生物公司产品。
1.7 生化物质提取及检测产卵后的成蚊以及产后30 d的卵用于生化物质提取及检测,成蚊每组30只,蚊卵每组3个重复,每个重复0.1 g。分别按照试剂盒说明书进行总糖、糖原、海藻糖、甘油三酯、总胆固醇和山梨醇的提取。使用酶标仪对所提取生化物质进行检测不同波长处的吸光度(A),总糖采用DNS水解法在540 nm处、糖原采用酸水解-蒽酮比色法在620 nm处、海藻糖采用蒽酮比色法在620 nm处、甘油三酯采用乙酰丙酮法在420 nm处、山梨醇使用铜离子比色法在655 nm处分别检测A值。根据标准曲线计算不同生化指标含量。检测时设置标准品、样本及空白对照。
1.8 统计学分析所有数据使用GraphPad 8.0软件对2组检测的实验数据进行正态性检验,均符合正态分布,采用非配对t检验方法进行统计分析。P < 0.05为差异有统计学意义。
2 结果 2.1 成蚊及滞育卵的总糖含量白纹伊蚊成蚊在滞育诱导条件下总糖含量为(21.60±2.21)mg/g,在正常发育条件下,成蚊总糖含量为(16.07±0.83)mg/g;滞育卵内总糖含量为(103.94±8.06)mg/g,非滞育卵内总糖含量为(11.03±0.11)mg/g。滞育(诱导)条件下卵及成蚊体内总糖含量较正常发育条件下均显著升高,差异有统计学意义(成蚊:t=3.210,P=0.0326;蚊卵:t=26.24,P < 0.001)。见图 1。
|
| 注:a表示P < 0.05;b表示P < 0.0001。 图 1 正常发育、滞育条件下成蚊(A)及滞育卵(B)的总糖含量 Figure 1 Total sugar content of mosquito adults (A) and eggs (B) under normal development and diapause conditions |
| |
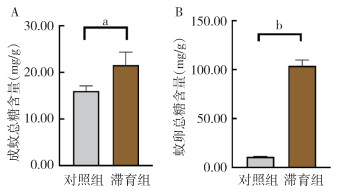
白纹伊蚊成蚊在滞育诱导条件下糖原含量为(28.23±0.16)mg/g,在正常发育条件下,成蚊糖原含量为(19.69±0.91)mg/g;滞育卵内糖原含量为(8.61±1.54)mg/g,非滞育卵内糖原含量为(3.24±0.11)mg/g。滞育(诱导)条件下卵及成蚊体内糖原含量较正常发育条件下均显著升高,差异有统计学意义(成蚊:t=15.26,P < 0.001;蚊卵:t=6.034,P=0.004)。见图 2。
|
| 注:a表示P < 0.001;b表示P < 0.01。 图 2 正常发育、滞育条件下成蚊(A)及滞育卵(B)的糖原含量 Figure 2 Glycogen content of mosquito adults (A) and eggs (B) under normal development and diapause conditions |
| |
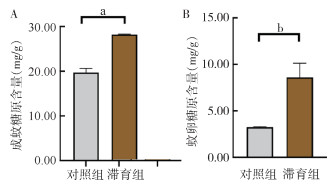
白纹伊蚊成蚊在滞育诱导条件和正常发育条件下糖原含量分别为(6.89±0.28)和(6.81±0.15)mg/g;滞育卵内海藻糖含量为(1.35±0.07)mg/g,非滞育卵内糖原含量为(0.96±0.03)mg/g。滞育诱导条件下成蚊体内海藻糖含量与正常发育条件下差异无统计学意义(t=1.036,P=0.359),滞育卵内海藻糖含量较非滞育卵显著升高,差异有统计学意义(t=12.650,P < 0.001)。见图 3。
|
| 注:a表示P > 0.05;b表示P < 0.001。 图 3 正常发育、滞育条件下成蚊(A)及滞育卵(B)的海藻糖含量 Figure 3 Trehalose content of mosquito adults (A) and eggs (B) under normal development and diapause conditions |
| |
白纹伊蚊成蚊在滞育诱导条件下,总胆固醇含量为(19.08±1.68)μmol/g,在正常发育条件下,总胆固醇含量为(19.01±1.34)μmol/g;滞育卵总胆固醇含量为(13.58±0.28)μmol/g,非滞育卵内总胆固醇含量为(8.42±1.96)μmol/g。滞育诱导条件下成蚊体内总胆固醇含量与正常发育条件下差异无统计学意义(t=0.062,P=0.954),滞育卵内总胆固醇含量较非滞育卵显著升高,差异有统计学意义(t=5.475,P=0.005)。见图 4。
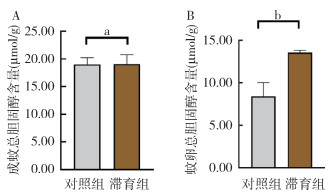
|
| 注:a表示P > 0.05;b表示P < 0.01。 图 4 正常发育、滞育条件下成蚊(A)及滞育卵(B)的总胆固醇含量 Figure 4 Total cholesterol content of mosquito adults (A) and eggs (B) under normal development and diapause conditions |
| |
在滞育诱导条件下,白纹伊蚊成蚊山梨醇含量为(21.71±3.89)mg/g,在正常发育条件下,山梨醇含量为(3.73±0.06)mg/g。在滞育诱导条件下白纹伊蚊成蚊甘油三酯含量为(52.54±4.98)mg/g,在正常发育条件下,甘油三酯含量为(54.45±3.67)mg/g。滞育诱导条件下成蚊体内山梨醇含量高于正常发育条件下含量,差异有统计学意义(t=6.990,P=0.002),甘油三酯含量与正常发育条件下含量差异无统计学意义(t=0.595,P=0.584)。见图 5。
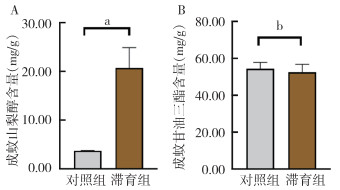
|
| 注:a表示P < 0.01;b表示P > 0.05。 图 5 正常发育、滞育条件下成蚊的山梨醇(A)及甘油三酯(B)含量 Figure 5 Sorbitol (A) and triglyceride (B) content of adult mosquitoes under normal development and diapause conditions |
| |
本研究实验结果显示,滞育诱导条件下白纹伊蚊成蚊总糖、糖原、山梨醇含量显著升高(均P < 0.05),而海藻糖、总胆固醇、甘油三酯含量与非滞育诱导条件下含量差异无统计学意义。滞育诱导条件下滞育卵中总糖、糖原、海藻糖、总胆固醇含量较正常发育条件下的蚊卵高,且差异有统计学意义(均P < 0.01)。
糖类为昆虫滞育期间重要产能物质,可以增强昆虫耐寒性[14],通常在白纹伊蚊滞育前期进行积累。海藻糖是昆虫体内主要的血糖成分,同时,海藻糖具有保护细胞膜和蛋白结构稳定性的功能,也能作为一种抗冻剂增强昆虫的抗逆能力。在昆虫处于高温、高寒、高渗透压及干燥失水等恶劣环境条件时,海藻糖能在细胞表面形成独特的保护膜,避免蛋白质分子变性失活,从而起到维持昆虫的生命过程和生物特征的作用。因此海藻糖的积累与昆虫抗逆性的增强具有密切联系,对昆虫的能量代谢和抗逆等过程具有重要作用。一些昆虫如大斑芫菁(Mylabris phalerata)[15]、梨小食心虫(Grapholitha molesta)[16]等,在滞育期间海藻糖的含量高于非滞育个体,这提高了昆虫体液的血糖浓度,进而增强了昆虫的抗逆能力,而不仅仅是营养物质的储存方式[17]。根据本实验结果,在滞育诱导条件下,白纹伊蚊成蚊海藻糖含量与正常发育条件下相比差异无统计学意义,而蚊卵中差异有统计学意义,因此推测以卵越冬的白纹伊蚊需要在卵中存储更多的海藻糖以增强抗逆能力,从而应对寒冷的冬季。糖原是主要的能量物质,是滞育昆虫越冬前期的储能物质,糖原代谢为昆虫顺利越冬提供了能量保证,也是糖、醇类冷冻保护剂的主要来源之一。对二化螟(Chilo suppressalis)幼虫、烟蚜茧蜂(Aphidius gifuensis)和东亚小花蝽(Orius sauteri)的实验研究结果均表明,滞育个体的总糖含量高于非滞育个体,例如,滞育烟蚜茧蜂的糖原含量是非滞育个体的1.44倍[18-20]。本研究的实验结果表明,滞育诱导组的成蚊和卵内糖原含量均高于正常发育组,这种差异在蚊卵内表现更明显。
除了糖类的积累,许多昆虫在进入滞育诱导期和滞育期也会积累脂肪和醇类等生化物质,以满足其在滞育期间的能量代谢和滞育解除后个体发育的需求[21-22]。在寒冷的冬季,昆虫体内山梨醇分子结构中的亲水基团能够与水分子结合,使自由水含量减少从而降低昆虫体液的结冰概率,提高昆虫抗寒性。此外,山梨醇还可通过与自由水的结合,使新陈代谢速率降低,促进胚胎的滞育[23],对家蚕的研究结果也表明,山梨醇是家蚕在滞育期间的主要积累物质,本研究也发现,在滞育诱导组的白纹伊蚊成蚊体内,山梨醇的含量显著高于正常发育组。脂肪是昆虫主要营养物质的储存形式之一[24],一种斑蛾(Zygaena trifolii)在滞育期间储存大量糖原和脂肪,并可在滞育期间逐渐被利用[25]。白纹伊蚊成蚊在滞育诱导条件下总胆固醇、甘油三酯含量差异无统计学意义,有可能是作为前体物质为糖原的合成提供原料;而蚊卵总胆固醇的含量显著高于正常发育组,推测滞育卵内总胆固醇的积累是为白纹伊蚊滞育期存活及滞育卵的发育提供能量。
滞育为白纹伊蚊的种群扩张及其传播病原体提供了重要的生物学基础,对滞育的深入研究有助于利用打破蚊虫体内滞育平衡,探索新型防控途径。本研究针对滞育诱导条件下的白纹伊蚊成蚊及滞育后期蚊卵的生化物质进行测定,发现成蚊及卵内糖原等营养物质的含量在滞育诱导组和正常发育组均表现出差异。这些发现对于了解白纹伊蚊滞育的生理特点具有重要意义,也为白纹伊蚊的防控提供了新思路。
利益冲突 无
| [1] |
Paupy C, Delatte H, Bagny L, et al. Aedes albopictus, an arbovirus vector: From the darkness to the light[J]. Microbes Infect, 2009, 11(14/15): 1177-1185. DOI:10.1016/j.micinf.2009.05.005 |
| [2] |
Bonizzoni M, Gasperi G, Chen XG, et al. The invasive mosquito species Aedes albopictus: Current knowledge and future perspectives[J]. Trends Parasitol, 2013, 29(9): 460-468. DOI:10.1016/j.pt.2013.07.003 |
| [3] |
Denlinger DL, Armbruster PA. Mosquito diapause[J]. Annu Rev Entomol, 2014, 59: 73-93. DOI:10.1146/annurev-ento-011613-162023 |
| [4] |
夏丹. 白纹伊蚊滞育及其光周期调控机制[D]. 广州: 南方医科大学, 2022. DOI: 10.27003/d.cnki.gojyu.2018.000148. Xia D. Aedes albopictus diapause and its photoperiodic regulation mechanism[D]. Guangzhou: Southern Medical University, 2022. DOI: 10.27003/d.cnki.gojyu.2018.000148.(inChinese) |
| [5] |
陈珍珍, 赵楠, 印象初, 等. 中华通草蛉自然越冬成虫在两种光周期下滞育解除过程中的生理生化变化[J]. 昆虫学报, 2013, 56(2): 120-130. Chen ZZ, Zhao N, Yin XC, et al. Physiological and biochemical changes in naturally overwintering adults of Chrysoperla sinica (Neuroptera: Chrysopidae) during diapause termination under two different photoperiods[J]. Acta Entomol Sin, 2013, 56(2): 120-130. DOI:10.16380/j.kcxb.2013.02.002 |
| [6] |
黄娜娜, 代鹏, 符悦冠, 等. 瓜实蝇耐低温相关生理指标的测定[J]. 应用昆虫学报, 2015, 52(3): 694-701. Huang NN, Dai P, Fu YG, et al. Measurement of physiological indices of cold tolerance in Bactrocera cucurbitae (Coquillett)[J]. Chin J Appl Entomol, 2015, 52(3): 694-701. DOI:10.7679/j.issn.2095-1353.2015.081 |
| [7] |
苏天运, 王梅英, 王仲文, 等. 淡色库蚊越冬过程中体重、含水量及脂、蛋白质、碳水化合物含量的动态变化[J]. 中国媒介生物学及控制杂志, 1992, 3(6): 337-341. Su TY, Wang MY, Wang ZW, et al. Dynamic variations of body weight, water component, lipids, proteins, and carbohydrates of Cluex pipiens pallens (Diptera: Culicidae) during hibernation[J]. Chin J Vector Biol Control, 1992, 3(6): 337-341. |
| [8] |
Benoit JB, Denlinger DL. Suppression of water loss during adult diapause in the northern house mosquito, Culex pipiens[J]. J Exp Biol, 2007, 210(Pt 2): 217-226. DOI:10.1242/jeb.02630 |
| [9] |
Hahn DA, Denlinger DL. Energetics of insect diapause[J]. Annu Rev Entomol, 2011, 56: 103-121. DOI:10.1146/annurev-ento-112408-085436 |
| [10] |
张本光, 臧爱梅, 王利磊, 等. 淡色库蚊越冬蚊体内海藻糖和海藻糖酶含量的变化[J]. 中国病原生物学杂志, 2018, 13(12): 1335-1337, 1343. Zhang BG, Zang AM, Wang LL, et al. Dynamic changes in trehalose and trehalase levels in overwintering adults of Culex pipiens pallens Coquillett (Diptera: Culicidae)[J]. J Pathog Biol, 2018, 13(12): 1335-1337, 1343. DOI:10.13350/j.cjpb.181208 |
| [11] |
Hanson SM, Craig GB Jr. Cold acclimation, diapause, and geographic origin affect cold hardiness in eggs of Aedes albopictus (Diptera: Culicidae)[J]. J Med Entomol, 1994, 31(2): 192-201. DOI:10.1093/jmedent/31.2.192 |
| [12] |
Urbanski JM, Benoit JB, Michaud MR, et al. The molecular physiology of increased egg desiccation resistance during diapause in the invasive mosquito, Aedes albopictus[J]. Proc Biol Sci, 2010, 277(1694): 2683-2692. DOI:10.1098/rspb.2010.0362 |
| [13] |
Reynolds JA, Poelchau MF, Rahman Z, et al. Transcript profiling reveals mechanisms for lipid conservation during diapause in the mosquito, Aedes albopictus[J]. J Insect Physiol, 2012, 58(7): 966-973. DOI:10.1016/j.jinsphys.2012.04.013 |
| [14] |
于彩虹, 卢丹, 林荣华, 等. 海藻糖: 昆虫的血糖[J]. 昆虫知识, 2008, 45(5): 832-837. Yu CH, Lu D, Lin RH, et al. Trehalose: The blood sugar in insects[J]. Chin Bull Entomol, 2008, 45(5): 832-837. DOI:10.3969/j.issn.0452-8255.2008.05.035 |
| [15] |
朱芬, 李红, 王永, 等. 大斑芫菁滞育幼虫在滞育不同阶段体内糖类和醇类含量的变化[J]. 昆虫学报, 2008, 51(1): 9-13. Zhu F, Li H, Wang Y, et al. Change of trehalose glycogen and polyol contents of the diapausing larvae of Mylabris phalerata (Pallas) (Coleoptera: Meloidae) at different diapausing stages[J]. Acta Entomol Sin, 2008, 51(1): 9-13. DOI:10.16380/j.kcxb.2008.01.004 |
| [16] |
郭婷婷, 凌飞, 张顺益, 等. 梨小食心虫滞育与非滞育幼虫过冷却能力与体内主要生化物质含量[J]. 应用昆虫学报, 2013, 50(6): 1514-1518. Guo TT, Ling F, Zhang SY, et al. The super-cooling ability and biochemical substances in diapausing and non-diapausing larvae of Grapholitha molesta (Busck) (Lepidoptera: Tortricidae)[J]. Chin J Appl Entomol, 2013, 50(6): 1514-1518. DOI:10.7679/j.issn.2095-1353.2013.208 |
| [17] |
Hahn DA, Denlinger DL. Meeting the energetic demands of insect diapause: Nutrient storage and utilization[J]. J Insect Physiol, 2007, 53(8): 760-773. DOI:10.1016/j.jinsphys.2007.03.018 |
| [18] |
张拥军. 二化螟越冬幼虫耐寒性及其机理研究[D]. 武汉: 华中农业大学, 2008. DOI: 10.7666/d.Y1198219. Zhang YJ. Studies on the cold hardiness of over wintering larva of Chilo supperssalis (Walker) and its mechanism [D]. Wuhan: Huazhong Agricultural University, 2008. DOI: 10.7666/d.Y1198219.(inChinese) |
| [19] |
李玉艳, 张礼生, 陈红印, 等. 烟蚜茧蜂Aphidius gifuensis Ashmead滞育诱导的温光周期反应[J]. 应用昆虫学报, 2013, 50(3): 718-726. Li YY, Zhang LS, Chen HY, et al. Temperature and photoperiodic response of diapause induction in Aphidius gifuensis Ashmead[J]. Chin J Appl Entomol, 2013, 50(3): 718-726. |
| [20] |
吕兵, 孙猛, 翟一凡, 等. 东亚小花蝽滞育前后耐寒能力及体内生化物质变化[J]. 中国生物防治学报, 2020, 36(6): 885-890. Lyu B, Sun M, Zhai YF, et al. Changes of cold tolerance and biochemical substances in diapause and post-diapause Orius sauteri[J]. Chin J Biol Control, 2020, 36(6): 885-890. DOI:10.16409/j.cnki.2095-039x.2020.06.022 |
| [21] |
任小云, 齐晓阳, 安涛, 等. 滞育昆虫营养物质的积累、转化与调控[J]. 应用昆虫学报, 2016, 53(4): 685-695. Ren XY, Qi XY, An T, et al. Research on the accumulation, transformation and regulation of nutrients in diapause insects[J]. Chin J Appl Entomol, 2016, 53(4): 685-695. DOI:10.7679/j.issn.20951353.2016.086 |
| [22] |
Zhang B, Peng Y, Zhao XJ, et al. Emergence of the overwintering generation of peach fruit moth (Carposina sasakii) depends on diapause and spring soil temperatures[J]. J Insect Physiol, 2016, 86: 32-39. DOI:10.1016/j.jinsphys.2015.12.007 |
| [23] |
吴大洋. 家蚕滞育的生理学研究: 滞育激素对家蚕卵脂质、碳水化合物代谢的影响与滞育卵长期保存[D]. 重庆: 西南农业大学, 2002. Wu DY. Study on the physiology of diapause in silkworm, Bombyx mori: Studies of the effects of diapause hormone on lipid and carbohydrate metabolism in silkworm eggs and of long-term storage of diapause silkworm eggs[D]. Chongqing: Southwest Agricultural University, 2002. (in Chinese) |
| [24] |
Arrese EL, Soulages JL. Insect fat body: Energy, metabolism, and regulation[J]. Annu Rev Entomol, 2010, 55: 207-225. DOI:10.1146/annurev-ento-112408-085356 |
| [25] |
Wipking W, Viebahn M, Neumann D. Oxygen consumption, water, lipid and glycogen content of early and late diapause and non-diapause larvae of the burnet moth Zygaena trifolii[J]. J Insect Physiol, 1995, 41(1): 47-56. DOI:10.1016/0022-1910(94)00079-V |
 2024, Vol. 35
2024, Vol. 35


