扩展功能
文章信息
- 张铭洧, 段金花, 邓惠, 芦瑞鹏, 陈宗晶, 林立丰
- ZHANG Ming-wei, DUAN Jin-hua, DENG Hui, LU Rui-peng, CHEN Zong-jing, LIN Li-feng
- 聚二甲基硅氧烷水膜对3种蚊虫的实验室控制效果研究
- Laboratory efficacy of polydimethylsiloxane liquid film against three mosquito species
- 中国媒介生物学及控制杂志, 2024, 35(2): 133-137
- Chin J Vector Biol & Control, 2024, 35(2): 133-137
- 10.11853/j.issn.1003.8280.2024.02.001
-
文章历史
- 收稿日期: 2023-09-21
2 广东省疾病预防控制中心消毒与病媒生物预防控制所, 广东 广州 511430
2 Institute of Disinfection and Vector Control, Guangdong Provincial Center for Disease Control and Prevention, Guangzhou, Guangdong 511430, China
蚊虫可携带登革病毒等病原体,通过叮咬人类传播疾病。现阶段媒介蚊虫防控过度依赖化学杀虫剂[1],蚊虫抗药性和环境污染等问题日益突出,研发和应用安全环保型产品成为未来灭蚊制剂发展的趋势。近年来单分子表面膜(monomolecular surface films,MMF)等产品被研发用于蚊虫孳生地治理,通过在水面上形成薄膜影响幼蚊呼吸,致其窒息死亡[2-5]。蚊陷防蚊水膜在我国是一款新型的单分子表面膜产品,以聚二甲基硅氧烷(polydimethylsiloxane,PDMS)为主要成分。目前国内有关PDMS水膜的防控效果研究主要集中在致倦库蚊(Culex pipiens quinquefasciatus)和白纹伊蚊(Aedes albopictus)[6-8],而不同蚊种对水膜的敏感性存在差异,水膜对我国的埃及伊蚊(Ae. aegypti)防控效果如何尚缺少相关数据;此外上述研究均是在单一温度下进行实验,而蚊虫活跃季节的温度往往高于实验温度,较高的环境温度下水膜功效是否发生改变尚不清楚。为了解PDMS水膜对多种蚊虫的防控效果,本研究以致倦库蚊、白纹伊蚊和埃及伊蚊为实验对象,评估1 ml/m2水膜对3种蚊虫不同龄期幼虫和蛹的防治效果及对低龄幼虫发育的抑制作用,同时观察不同温度下水膜功效的变化,为防蚊水膜的推广应用提供数据支持。
1 材料与方法 1.1 材料药剂:蚊陷防蚊水膜(主要成分为89% PDMS)购自一扫清环境科技有限公司,脱氯水(实验室过夜自来水)。
试虫:在广东省湛江雷州市乌石镇采集的致倦库蚊、白纹伊蚊和埃及伊蚊成蚊,带回实验室饲养并繁殖,取幼虫和蛹进行试验。
器械:可调移液枪(Eppendorf)、吸管、透明塑料盆(13 cm×12 cm×12 cm)、人工气候箱(广东泰宏君科学仪器股份有限公司)、SteREO Discovery V20体视显微镜(德国Zeiss)。
1.2 水膜对幼虫的杀灭效果试验容器长×宽×高为13 cm×12 cm×12 cm的透明塑料盆,加入1 L脱氯自来水,分别对各个蚊种的Ⅰ~Ⅱ龄或Ⅲ~Ⅳ龄期幼虫进行测试,每个容器内放入幼虫30条,按1 ml/m2剂量滴入水膜,置于(25±1)℃,相对湿度为60%~80%,光周期(L∶D)为14 h∶10 h的环境下正常饲养,于4、8、12和24 h及之后每隔24 h,记录幼虫死亡数直至第14天,每天补充适量酵母片作为饲料,存活幼虫继续观察其化蛹及羽化情况。用脱氯自来水作为空白对照,设置3组重复。
1.3 水膜对蛹的杀灭效果分别在装有1 L脱氯自来水的透明塑料盆中放入各个蚊种的蛹30只,按1 ml/m2剂量滴入水膜,蚊蛹饲养条件与上述方法相同,每隔30 min记录蚊蛹的死亡数,直到处理组蛹全部死亡。用脱氯自来水作为空白对照,设置3组重复。
1.4 水膜对幼虫发育的抑制作用在进行水膜对幼虫杀灭效果实验过程发现水膜组幼虫的生长速度比对照组缓慢,为了进一步了解水膜对幼虫生长发育的抑制作用,分别选取各个蚊种刚孵化1 d的Ⅰ龄幼虫30条,放入盛有1 L水的透明塑料盆中,按1 ml/m2剂量滴入水膜,幼虫饲养条件与上述方法相同,第7天从存活幼虫中随机收集10条,通过体视显微镜对虫体长度(从头部到呼吸管末端)进行测量,剩余幼虫继续观察,直到幼虫全部死亡或化蛹,统计最终的化蛹率。用脱氯自来水作为空白对照,设置3组重复。
1.5 不同温度对水膜功效的影响实验在人工气候箱中进行,温度分别设置为20、25、30和35 ℃,相对湿度为65%,光周期(L∶D)为14 h∶10 h。挑选各个蚊种的Ⅲ~Ⅳ龄期幼虫各30条,放入装有1 L脱氯自来水的塑料盆中,按1 ml/m2的剂量滴入水膜,每天记录幼虫死亡数,持续5 d。用脱氯自来水作为空白对照,设置3组重复。
1.6 死亡判断标准及死亡率的计算用细针触碰蚊蛹或幼虫头部和尾部呼吸管,若蛹或幼虫反应迟钝或呈麻痹痉挛状态,则判定为死亡。若对照组幼虫死亡率 < 5%,处理组死亡率无需校正,对照组死亡率为5%~20%,用Abbott公式进行处理组死亡率的校正,对照组死亡率 > 20%为无效测定,重新开展试验。

|
应用Excel 2016和SPSS 27.0软件对数据进行整理和分析,计算各组幼蚊和蛹的半数致死时间(LT50)及95%置信区间(CI),通过Kaplan-Meier分析的log-rank检验比较各组幼虫或蛹接触水膜后的生存曲线,采用独立样本t检验比较不同组的幼虫长度,P < 0.05表示差异有统计学意义。
2 结果 2.1 水膜对幼虫的杀灭效果PDMS水膜对3种蚊幼虫的实验室控制效果如表 1所示,接触水膜后,致倦库蚊、白纹伊蚊、埃及伊蚊Ⅰ~Ⅱ龄幼虫的10 d累计死亡率分别是100%、67.78%和70.00%,Ⅲ~Ⅳ龄幼虫的2 d累计死亡率分别是100%、72.22%和65.56%,各对照组幼虫均无死亡。致倦库蚊、白纹伊蚊、埃及伊蚊Ⅰ~Ⅱ龄幼虫组的LT50分别为2.67、7.04和6.45 d,Ⅲ~Ⅳ龄幼虫组分别为0.53、1.64和1.71 d。Log-rank检验结果显示,在Ⅰ~Ⅱ龄组中,致倦库蚊与白纹伊蚊和埃及伊蚊生存曲线的差异均有统计学意义(χ2=69.843,P < 0.001;χ2=49.189,P < 0.001),而白纹伊蚊与埃及伊蚊两组的生存曲线差异则无统计学意义(χ2=2.659,P=0.103),Ⅲ~Ⅳ龄组的种间比较结果与Ⅰ~Ⅱ龄组一致;在同一蚊种内的不同龄期比较中,致倦库蚊、白纹伊蚊、埃及伊蚊的Ⅰ~Ⅱ龄组和Ⅲ~Ⅳ龄组的生存曲线比较差异均有统计学意义(χ2=121.863,P < 0.05;χ2=112.131,P < 0.05;χ2=89.409,P < 0.05)。结合LT50和log-rank检验结果,发现水膜环境下致倦库蚊幼虫的死亡速度快于相应龄期的白纹伊蚊和埃及伊蚊,高龄幼虫的死亡速度快于相应蚊种的低龄幼虫。

|
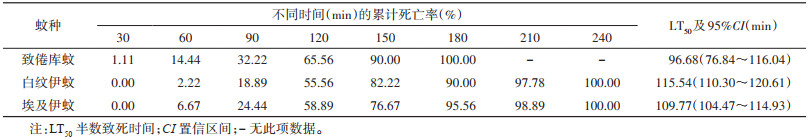
各水膜组蚊蛹均在240 min内全部死亡(表 2),各对照组蚊蛹均无死亡,致倦库蚊、白纹伊蚊、埃及伊蚊的蛹暴露于1 ml/m2水膜环境下的LT50分别是96.68、115.54和109.77 min。Log-rank检验不同蚊种的蛹在暴露于水膜环境下生存曲线的差异无统计学意义(χ2=1.371,P=0.504),即水膜对于蚊蛹的杀灭效率种间无差别。
|
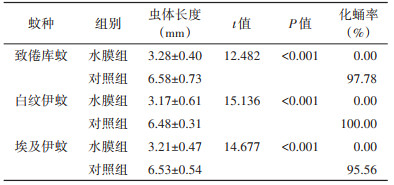
各蚊种Ⅰ龄幼虫在水膜环境和空白对照环境下饲养7 d后对其虫体长度进行测量,对照组中,致倦库蚊、白纹伊蚊、埃及伊蚊的平均虫体长度分别是(6.58±0.73)、(6.48±0.31)和(6.53±0.54)mm,化蛹率分别为97.78%、100%和95.56%;而水膜组的平均虫体长度分别为(3.28±0.40)、(3.17±0.61)和(3.21±0.47)mm,水膜组幼虫的虫体长度明显小于相应的对照组,差异均有统计学意义(致倦库蚊:t=12.482,P < 0.001;白纹伊蚊:t=15.136,P < 0.001;埃及伊蚊:t=14.677,P < 0.001);幼虫化蛹率均为0。见表 3。
|
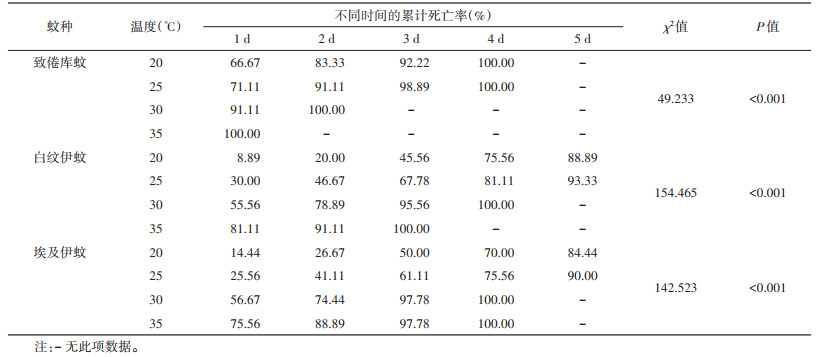
在20、25、30和35 ℃下,水膜组致倦库蚊幼虫在第1天的死亡率分别为66.67%、71.11%、91.11%和100%,白纹伊蚊分别为8.89%、30.00%、55.56%和81.11%,埃及伊蚊分别为14.44%、25.56%、56.67%和75.56%,水膜环境下各组幼虫的死亡率随温度的上升而增加,log-rank检验结果显示,各水膜组幼虫在不同温度下的生存曲线差异均有统计学意义(致倦库蚊:χ2
|
大多数情况下蚊幼虫和蛹主要利用呼吸管或呼吸角透过水面进行呼吸来获取氧气,此外也可吸取水中溶解氧[9-10]。当空气呼吸途径受到阻碍时,幼虫需要依靠水中溶解氧来维持生存,若水体溶解氧浓度过低幼虫则会死亡[11]。PDMS水膜能够在水体表面自发扩散形成一层均匀的液态薄膜,通过降低水面张力,堵塞幼虫呼吸管或蛹的呼吸角[12],影响其呼吸,同时阻碍氧气溶解到水中[13],随着幼虫和蛹的消耗,水中溶解氧浓度逐渐降低,最终导致幼虫和蛹缺氧窒息死亡。由此可见,PDMS水膜依靠其优良的疏水性从物理层面上实现对幼虫的杀灭作用,产生抗药性的风险较低,同时PDMS多年来一直广泛应用于医疗、化妆、食品等领域,环境毒性低,对人体和水生生物危害小[14],具有较高的安全性,将其作为灭蚊幼制剂的原材料,能够缓解化学杀虫剂引起的蚊虫抗药性、环境污染及危害非靶标生物等问题,有利于实现媒介蚊虫的可持续控制。
本研究针对PDMS水膜在实验室环境下对致倦库蚊、白纹伊蚊、埃及伊蚊幼虫和蛹的防治效果进行测试。研究结果表明,水膜能有效杀灭这3种蚊虫的幼蚊和蛹,在同一龄期中,致倦库蚊的LT50要明显短于白纹伊蚊和埃及伊蚊,在同一蚊种中,各蚊种高龄幼虫的LT50均明显短于低龄幼虫,说明致倦库蚊幼虫对水膜敏感性较高,白纹伊蚊幼虫和埃及伊蚊幼虫次之,同时随着幼虫的生长,其对氧气的需求越高[15],水膜产生的致死效果越强,尤其是蛹,在水膜环境下仅能存活数小时,对于高龄幼虫,水膜则需数天时间即可将其全部杀灭。研究发现水膜组幼虫的虫体长度明显小于相应的对照组,且所有幼虫均不能化蛹,因此低龄幼虫在水膜环境下虽能短时间存活,但是由于氧气供应不足,其蜕皮发育过程受到影响,生长迟缓,无法化蛹最终死亡。此外,随着实验温度的上升,对照组幼虫的死亡率均在5%以下,表明实验设置的4个温度对幼虫的生存无不良影响,而水膜组幼虫由于代谢速度加快导致需氧量增加,对于低氧环境更为敏感,使得水膜对幼虫的控制效果显著提高,因此在实际应用中,尤其是蚊虫活跃季节的高温环境下,水膜能发挥出良好的灭蚊幼效果。
目前,广谱高效的化学杀虫剂仍然是媒介蚊虫防控的首要选择,但大量使用化学杀虫剂带来的诸多隐患,使得蚊虫防控工作受到了一定程度的阻碍。为了保证蚊虫治理工作持续推进,需树立媒介蚊虫绿色治理理念,注重人与环境协调发展,采用生态友好的控制技术手段。PDMS水膜能够有效防治多种蚊虫的幼蚊和蛹,其杀灭效率随着环境温度的上升而提高,同时对非靶标生物和生态环境的影响较小,适合应用于蚊虫孳生地的控制。应进一步对水膜在现场应用的效果和环境安全性进行验证和评价,并逐步总结PDMS水膜的应用范围和场所,为我国蚊虫防控提供更多选择。
利益冲突 无
| [1] |
林立丰. 新发与再发病媒传染病流行现状与病媒生物防控对策[J]. 中华卫生杀虫药械, 2020, 26(3): 193-196. Lin LF. The current situation of emerging and re-emerging vector-borne infectious diseases and the prevention and control measures of vectors[J]. Chin J Hyg Insect Equip, 2020, 26(3): 193-196. DOI:10.19821/j.1671-2781.2020.03.001 |
| [2] |
Antonio-Nkondjio C, Sandjo NN, Awono-Ambene P, et al. Implementing a larviciding efficacy or effectiveness control intervention against malaria vectors: Key parameters for success[J]. Parasit Vectors, 2018, 11(1): 57. DOI:10.1186/s13071-018-2627-9 |
| [3] |
Ngrenngarmlert W, Sukkanon C, Yaicharoen R, et al. Physical influence on larvicidal and pupicidal activity of the silicone-based monomolecular film[J]. Acta Trop, 2016, 162: 239-244. DOI:10.1016/j.actatropica.2016.07.012 |
| [4] |
Mbare O, Lindsay SW, Fillinger U. Aquatain® mosquito formulation (AMF) for the control of immature Anopheles gambiae sensu stricto and Anopheles arabiensis: Dose-responses, persistence and sub-lethal effects[J]. Parasit Vectors, 2014, 7: 438. DOI:10.1186/1756-3305-7-438 |
| [5] |
Webb CE, Russell RC. A laboratory investigation of the mosquito control potential of the monomolecular film Aquatain® mosquito formula against immature stages of Aedes aegypti and Culex quinquefasciatus[J]. J Am Mosq Control Assoc, 2009, 25(1): 106-109. DOI:10.2987/08-5750.1 |
| [6] |
张振东, 金姝青, 温和毅, 等. 聚二甲基硅氧烷液态防蚊膜在实验室条件下对白纹伊蚊幼虫防治效果的研究[J]. 中华卫生杀虫药械, 2022, 28(1): 1-5. Zhang ZD, Jin SQ, Wen HY, et al. Control efficacy of polydimethylsiloxane liquid film on Aedes albopictus larvae under laboratory conditions[J]. Chin J Hyg Insect Equip, 2022, 28(1): 1-5. DOI:10.19821/j.1671-2781.2022.01.001 |
| [7] |
杜雪. 防蚊水膜对淡色库蚊和白纹伊蚊幼虫的实验室防治效果观察[J]. 中华卫生杀虫药械, 2020, 26(5): 417-422. Du X. Efficacy of anti-mosquito film against Culex pipiens pallens and Aedes albopictus larvae in laboratory[J]. Chin J Hyg Insect Equip, 2020, 26(5): 417-422. DOI:10.19821/j.1671-2781.2020.05.005 |
| [8] |
王唐, 宋灿磊, 许峰, 等. 一种新型灭蚊膜对白纹伊蚊控制效果的研究[J]. 中国媒介生物学及控制杂志, 2020, 31(5): 555-558. Wang T, Song CL, Xu F, et al. A study of the control effect of a new mosquito control film on Aedes albopictus[J]. Chin J Vector Biol Control, 2020, 31(5): 555-558. DOI:10.11853/j.issn.1003.8280.2020.05.011 |
| [9] |
Yamada H, Maiga H, Bimbile-Somda NS, et al. The role of oxygen depletion and subsequent radioprotective effects during irradiation of mosquito pupae in water[J]. Parasit Vectors, 2020, 13(1): 198. DOI:10.1186/s13071-020-04069-3 |
| [10] |
Wigglesworth VB. The function of the anal gills of the mosquito larva[J]. J Exp Biol, 1933, 10(1): 16-26. DOI:10.1242/jeb.10.1.16 |
| [11] |
Silberbush A, Abramsky Z, Tsurim I. Dissolved oxygen levels affect the survival and developmental period of the mosquito Culex pipiens[J]. J Vector Ecol, 2015, 40(2): 425-427. DOI:10.1111/jvec.12186 |
| [12] |
Dawood AFD, Baz MM, Ibrahim MI. Influence of Aquatain™, a monomolecular surface film on surface tension for controlling the filarial vector Culex pipiens (Diptera: Culicidae)[J]. Heliyon, 2020, 6(10): e05314. DOI:10.1016/j.heliyon.2020.e05314 |
| [13] |
Lee SJ, Kim JH, Lee SC. Effects of oil-film layer and surfactant on the siphonal respiration and survivorship in the fourth instar larvae of Aedes togoi mosquito in laboratory conditions[J]. Sci Rep, 2018, 8(1): 5694. DOI:10.1038/s41598-018-23980-5 |
| [14] |
任东升, 周志俊. 聚二甲基硅氧烷应用及安全性评估概况[J]. 中国食品卫生杂志, 2011, 23(2): 181-185. Ren DS, Zhou ZJ. An overview on the application and safety assessment of polydimethylsiloxane[J]. Chin J Food Hyg, 2011, 23(2): 181-185. DOI:10.13590/j.cjfh.2011.02.005 |
| [15] |
Thomas IM. The reactions of mosquito larvae to regular repetitions of shadows as stimuli[J]. Aust J Biol Sci, 1950, 3(1): 113-123. DOI:10.1071/bi9500113 |
 2024, Vol. 35
2024, Vol. 35


