扩展功能
文章信息
- 南晓伟, 王珊珊, 陈继来, 司晓艳, 吕威, 郭之君, 乔丽红, 王大伟, 王文瑞
- NAN Xiao-wei, WANG Shan-shan, CHEN Ji-lai, SI Xiao-yan, LYU Wei, GUO Zhi-jun, QIAO Li-hong, WANG Da-wei, WANG Wen-rui
- 内蒙古首次采获白纹伊蚊的形态学与分子生物学鉴定
- Morphological and molecular identification of Aedes albopictus first reported in Inner Mongolia Autonomous Region, China
- 中国媒介生物学及控制杂志, 2024, 35(1): 109-114
- Chin J Vector Biol & Control, 2024, 35(1): 109-114
- 10.11853/j.issn.1003.8280.2024.01.020
-
文章历史
- 收稿日期: 2023-10-12
白纹伊蚊(Aedes albopictus)属双翅目(Diptera)蚊科(Culicidae)库蚊亚科(Culicinae)伊蚊属(Aedes),在中国分布主要集中在北纬30°以南地区,沿辽宁-河北-山西-陕西-甘肃-四川-西藏东南沿线的25个省和直辖市分布[1]。白纹伊蚊是重要的媒介蚊虫,具有较强的攻击性,能够传播登革、黄热、寨卡、基孔肯雅和裂谷热等多种病毒,仅登革热每年在100多个国家流行,感染人数高达5 000万~1亿例[2],是目前严重的公共卫生问题。内蒙古自治区(内蒙古)分布的伊蚊主要有背点伊蚊(Ochlerotatus dorsalis)和里海伊蚊(O. caspius)等,广泛分布的背点伊蚊亦是流行性乙型脑炎的传播媒介[3]。2022年国家级蚊虫监测点呼和浩特市开展蚊虫监测时,在土默特左旗沙尔沁镇捕获6只伊蚊属蚊虫,经形态学鉴定为白纹伊蚊,因白纹伊蚊未见在此纬度分布的报道,作者对上述标本进行分子生物学鉴定,借助线粒体细胞色素C氧化酶亚基Ⅰ(mitochondrion cytochrome c oxidase subunitⅠ,COⅠ)基因和内转录间隔区2(internal transcribed spacer 2,ITS2)基因进行序列同源性比对和分析[4-5],现将结果报告如下。
1 材料与方法 1.1 标本采集 1.1.1 蚊虫监测工具“功夫小帅”诱蚊灯(LTS-M01B)。
1.1.2 采集方法按照《内蒙古自治区病媒生物生态学监测方案》对呼和浩特市进行成蚊监测。8月初,在呼和浩特市土默特左旗,对鱼塘及周边农户进行成蚊监测,于太阳落山前将诱蚊灯挂出,第2天太阳升起时回收诱蚊灯,将集蚊袋放于有冰袋的转运箱转运至实验室进行分拣。
1.2 形态学鉴定查阅《中国动物志昆虫纲第八卷双翅目蚊科(上卷)》[6]进行形态学鉴定,并用体视显微镜(莱卡S9i)对针插标本典型特征进行拍摄。
1.3 分子生物学鉴定 1.3.1 主要仪器试剂PCR扩增仪(杭州博日科技股份有限公司,FQD-96A)、电泳仪[韦克斯科技(北京)有限公司,WIX-EP600]、凝胶成像系统(上海勤翔科学仪器有限公司,IX-EP600)、低温离心机(湖南赫西仪器装备有限公司,HR/T16MM)。昆虫基因组提取试剂盒(Insect DNA Isolation Kit)购于Omega Bio-Tek公司、DNA扩增酶(Phanta®Max Super-Fidelity DNA Polymerase)购于南京诺唯赞生物科技股份有限公司;引物(序列信息见表 1)由生工生物工程(上海)股份有限公司合成,DNA Marker购于宝生物(大连)工程有限公司。

|
将储存于超低温冰箱中的标本单只置于放有液氮的研钵中,迅速将其研磨粉碎,待研钵稍有回温后,加入400 μl裂解液(CTL Buffer)和25 μl Proteinase K,之后将液体全部吸入1.5 ml EP管中,放入65 ℃水浴锅水浴5 h,之后用昆虫基因组提取试剂盒提取蚊虫组织DNA,获得的DNA放置-80 ℃冰箱备用。
1.3.3 PCR扩增及测序用DNA扩增试剂盒进行目的片段扩增。其中2×Phanta Max Buffer12.5 μl,正、反向引物各1 μl(10 μmol/L),Phanta Max Super-Fidelity DNA聚合酶(50 U)0.5 μl,dNTP(10 μmol/L)0.5 μl,DNA模板5 μl,ddH2O 4.5 μl补足至25 μl。PCR扩增条件:95 ℃预变性3 min;95 ℃变性15 s,52 ℃退火15 s(COⅠ和ITS2基因退火温度相同),72 ℃延伸15 s,共35个循环;72 ℃延伸5 min。取5 μl PCR产物于1.5%琼脂糖电泳检查扩增条带,若为阳性结果(COⅠ约720 bp、ITS2 400~600 bp),将产物送生工生物工程(上海)股份有限公司进行双向测序。
1.3.4 基因序列分析将测得的序列在美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)中用基于局部比对算法的搜索工具(basic local alignment search tool,BLAST)模块进行搜索比对,同时在NCBI数据库进行检索,综合上述两项序列相似性比对结果确定蚊种。从GenBank中选择库蚊属(Culex)、按蚊属(Anopheles)相应区段的核苷酸序列,将测序结果及其他形态相近蚊种COⅠ序列和ITS2序列用MEGA 11的Clustal W方法进行比对,在MEGA 11软件使用邻接法(neighbor-joining,NJ)进行系统发育分析,1 000次循环估计系统树中节点的自举置信水平(bootstrap confidence level,BCL)。
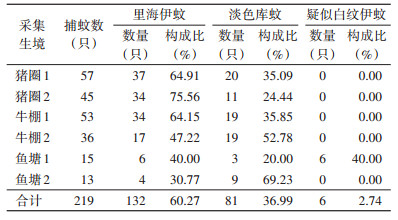
2 结果 2.1 标本采集情况监测日最高气温27 ℃,天气晴,风力2级。本次共采集到蚊虫219只(表 2)。其中淡色库蚊(Cx. pipiens pallens)81只,里海伊蚊132只,疑似白纹伊蚊6只(5雄1雌)。
成蚊:小型或中型蚊虫,体色暗黑色(图 1A);胸:中胸盾片中央银白色纵条已脱落,盾片侧缘翅基前有一簇白色宽鳞(图 1B);足:后足1~4跗节有较宽基白环,第5跗节全白(图 1C)。

|
| A. 6只伊蚊属蚊虫; B. 盾片侧缘特征图; C. 蚊足部特征图 图 1 呼和浩特市土默特左旗捕获的疑似白纹伊蚊成蚊形态特征 Figure 1 Morphological characteristics of the suspected adult Aedes albopictus captured in Tumed Left Banner, Hohhot |
| |
将此伊蚊属蚊虫与本地常见的淡色库蚊、里海伊蚊进行形态学比对。淡色库蚊为中型蚊虫,黄褐色,无斑纹,喙无白环,中足和后足股节前面无明显的淡色带,翅鳞暗色[7]。里海伊蚊中胸盾片鳞铜棕或棕黄,背中线上有白鳞窄纵条,后跗节1~4有跨关节白环,节5全白[6]。白纹伊蚊体色为暗黑色,中胸盾片有一中央银白色纵条,盾片侧缘翅基前有一簇白色宽鳞,后足1~4跗节有较宽基白环,第5跗节全白[7]。该蚊基本符合白纹伊蚊特征,体色为暗黑色与其他2种蚊虫易于区分。
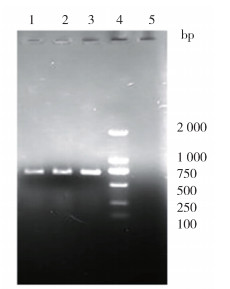
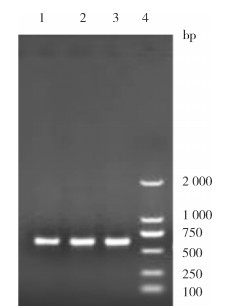
2.3 分子生物学鉴定对采集的蚊虫进行COⅠ基因和ITS2基因的PCR扩增,产物经琼脂糖凝胶电泳在700和580 bp附近呈现特异性条带(图 2、3),经双向测序拼接后获得713、721和721 bp的COⅠ基因碱基序列,及590、584和572 bp的ITS2基因碱基序列。对COⅠ基因的碱基序列组成分析得知,样本NMG1、NMG2和NMG3的A+T和G+C含量分别为67.65%和32.35%、67.92%和32.08%、67.78%和32.22%,3条序列的测序结果均为A+T的含量远远高于G+C的含量,具有显著的A+T偏好性,符合线粒体DNA的特性;对ITS2核苷酸组成分析得知,NMG1、NMG2和NMG3的A+T和G+C含量分别为46.94%和53.06%、46.91%和53.09%、48.42%和51.58%,3条序列的测序结果均为A+T的含量小于G+C含量。
|
| 注:1 NMG1;2 NMG2;3 NMG3;4 DNA标记物;5阴性样本。 图 2 呼和浩特市土默特左旗捕获疑似白纹伊蚊线粒体细胞色素C氧化酶亚基Ⅰ基因琼脂糖凝胶电泳检测结果 Figure 2 Agarose gel electrophoresis for detection of cytochrome c oxidase subunit Ⅰ gene of the suspected Aedes albopictus captured in Tumed Left Banner, Hohhot |
| |
|
| 注:1 NMG1;2 NMG2;3 NMG3;4 DNA标记物。 图 3 呼和浩特市土默特左旗捕获疑似白纹伊蚊内转录间隔区2基因琼脂糖凝胶电泳检测结果 Figure 3 Agarose gel electrophoresis for detection of internal transcribed spacer 2 gene of the suspected Aedes albopictus captured in Tumed Left Banner, Hohhot |
| |
在NCBI中分别将COⅠ基因和ITS2基因进行BLAST比对,其中与NMG1、NMG2和NMG3分别比较后显示的前100条白纹伊蚊COⅠ序列相似度均高达99.43%~99.86%,ITS2序列相似度为90.73%~99.49%。根据种内COⅠ同源性一般 > 98%[8-9]的依据综合判断采集到的蚊虫为白纹伊蚊。将序列提交至GenBank,序列号分别为OR237235、OR237213、OR237214、OR512353、OR512354和OR512355。
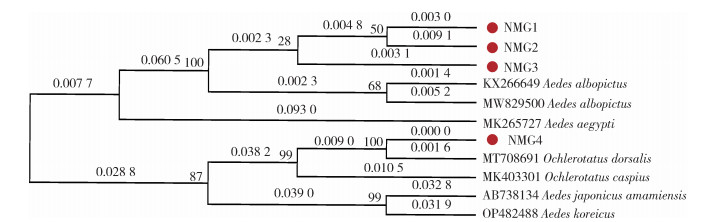
2.4 系统发育分析 2.4.1 基于COⅠ序列的系统发育树关系构建在NCBI上下载内蒙古常见伊蚊属蚊虫的COⅠ序列进行比对,分别有背点伊蚊(MK403301,瑞典)、里海伊蚊(MT708691,塞尔维亚)、朝鲜伊蚊(Ae. koreicus,OP482488,塞尔维亚)和日本伊蚊(Ae. japonicus amamiensis,AB738134,日本),同时查询其他国家或我国其他省份白纹伊蚊(KX266649,上海和MW829500,韩国)和埃及伊蚊(Ae. aegypti,MK265727,印度)的序列。与上述序列进行相似性比较,由发育树可以看出,内蒙古获得的NMG1~NMG3基因片段和来自我国上海和韩国的白纹伊蚊归为一支;另外NMG4和里海伊蚊聚为一支。见图 4。
|
| 图 4 不同蚊虫基于线粒体细胞色素C氧化酶亚基Ⅰ基因的系统发育关系分析 Figure 4 Phylogenetic analysis of different mosquitoes based on the cytochrome c oxidase subunit Ⅰ gene |
| |
在NCBI上下载常见蚊虫ITS2序列,分别有白纹伊蚊(KU497619和KU497617,福建;KX495935,芬兰)、埃及伊蚊(MZ851347,印度,ON652374,印度尼西亚)、淡色库蚊(MK972062,英国)、中华按蚊(An. sinensis,KU497635,福建)、可莱尼按蚊(An. kleini,MW546419,韩国)、里海伊蚊(GU977216,塞尔维亚)和外缘基因序列白蛉(Sergentomyia darlingi,KU555394,法国)。与上述序列进行相似性比较,由发育树可以看出,内蒙古的NMG1~NMG3基因片段与来自芬兰的白纹伊蚊亲缘关系最近,之后与福建的白纹伊蚊聚为一支;NMG4与里海伊蚊聚集为一支。见图 5。
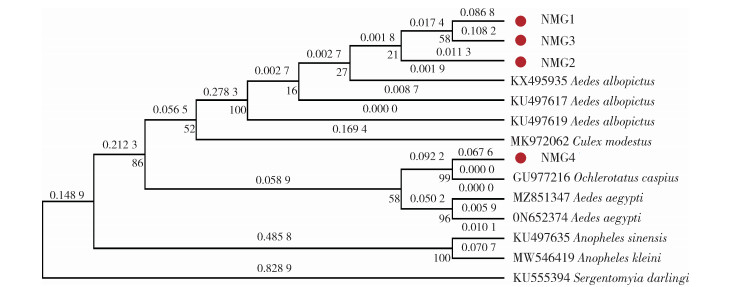
|
| 图 5 不同蚊虫基于内转录间隔区2基因系统发育关系分析 Figure 5 Phylogenetic analysis of different species of mosquitoes based on the internal transcribed spacer 2 gene |
| |
种类鉴定是蚊虫生态学监测与蚊媒传染病控制的基础。形态学鉴定较为直观、快速,但对标本的完整性和鉴定者的专业能力及经验要求较高,易受到鉴定者主观因素影响。DNA序列分析是分子生物学鉴定生物亲缘种、研究系统进化关系的方法之一。COⅠ基因属线粒体基因普遍存在于真核生物细胞中,在双翅目昆虫进化机制和系统重建研究上是一种有效的分子标记[8-9]。ITS2不加入成熟核糖体,受到的选择压力小,进化的速率较快,具有种内遗传变异小而种间遗传变异大的特性,是蚊种鉴定理想的DNA条形码分子工具和系统发育分析的遗传标记[10-11],曾用作蚊虫复合体成员种的分子鉴别研究[12]。本研究先对采集到的成蚊进行形态学鉴定,发现其盾片侧缘翅基前有一簇白色宽鳞及后足1~4跗节有较宽基白环,且第5跗节全白,这些特征与白纹伊蚊特征相符,因其中胸盾板鳞片脱落,未观察到中胸盾片中央银白色纵条,仅可观察到纵条痕迹,因此不能从形态学上确定其为白纹伊蚊,随后对其进行COⅠ基因和ITS2基因的序列分析,经过在NCBI上序列比对,及与形态相似和本地区常见蚊种系统进化树的分析,最终确定为白纹伊蚊。尽管COⅠ基因在种内和属间不能进行精确的定位,但是在种水平的表现值得肯定,DNA条形码技术作为一项常用的物种鉴别方法,尽管不能单独用来解决全部物种鉴别的任务,但在实际应用中依然具有很大优势:①所检对象无生活周期和组织材料的特异性;②非专家鉴定,技术人员经简单培训即可大量、迅速地进行;③准确性高;④大大缓解了分类学家缺乏的问题。
白纹伊蚊在全球范围内扩散速度快,现在被列为前100种入侵物种之一。白纹伊蚊在欧洲最早的记录是1979年,于阿尔巴尼亚第一次发现白纹伊蚊[13]。近年来报道白纹伊蚊在欧洲多数国家都有出现,其中包括法国、德国、意大利、摩纳哥、瑞士、西班牙、荷兰、希腊等[14]。由欧洲各地白纹伊蚊入侵过程显示,一旦在当地定殖,很难再消除[15]。影响白纹伊蚊定殖的因素有很多,如:生态可塑性、强大的竞争能力、贸易和旅行的增加、缺乏监测及有效的控制。2009和2012年的气候变化相关研究预测白纹伊蚊将是一个成功的入侵物种,并将扩散到当时的地理边界以外[16-17]。该蚊种已经显示出适应较冷气候的迹象[18],可能导致疾病在新的地区传播[19]。在我国,白纹伊蚊虽然在东洋区和古北区均有分布,但更适宜在东洋区生存。与内蒙古地区毗邻的陕西、山西、河北等省均有白纹伊蚊的活动,而且近年来在甘肃省嘉临江流域也有白纹伊蚊的发现[20],由此可见其繁衍生境在不断扩大。本次白纹伊蚊采样点位于北纬40°31′,东经111°40′,属于内蒙古中西部,据气象局资料显示,该地区近3年冬季最低气温-27.5~-20.9 ℃,30年平均最低温为-30.4 ℃。最低气温低于-21 ℃可能为白纹伊蚊能否越冬繁殖的限制气候因子[21-22],因此该地区冬季温度不适宜白纹伊蚊越冬定殖,且病媒监测信息平台数据显示截止2023年10月,2023年在此采样点及内蒙古地区再次采样均未捕获到该蚊种,由此推断此次捕获到的白纹伊蚊很大程度为偶然输入。其在内蒙古虽未定殖,但其存活时间及动态、是否能完成发育史等仍值得我们持续关注。
白纹伊蚊在实验室被认为是至少22种虫媒病毒的有效媒介[23],包括黄热病毒、裂谷热病毒、日本脑炎病毒、西尼罗河病毒和辛德比斯病毒等,这些病毒均在欧洲这样纬度较高且与内蒙古相近的地区引起相关疾病流行,在我国历年亦均有各疾病输入病例的相关报道[24],而且白纹伊蚊是我国登革热传播的主要媒介。在内蒙古呼和浩特市土默特左旗开展蚊虫生态学监测并捕获到白纹伊蚊,说明白纹伊蚊可能存在向内蒙古地区这样更高纬度地区扩散的趋势,提示该地区未来可能存在因其所携带病毒引起疾病传播的风险,但因本次调查覆盖范围小、采样次数有限,该蚊种是否能在当地定殖繁衍还须今后进一步开展调查研究。
利益冲突 无
| [1] |
岳玉娟, 刘小波, 郭玉红, 等. 2020-2022年中国登革热时空分布及相关环境因素分析[J]. 环境卫生学杂志, 2023, 13(5): 341-345. Yue YJ, Liu XB, Guo YH, et al. Spatio-temporal distribution and environmental factors of dengue fever in China, 2020-2022[J]. J Environ Hyg, 2023, 13(5): 341-345. DOI:10.13421/j.cnki.hjwsxzz.2023.05.006 |
| [2] |
岳玉娟, 刘小波, 任东升等. 中国大陆2005-2020年登革热流行病学特征分析[J]. 中国媒介生物学及控制杂志, 2023, 34(6): 761-766, 818. Yue YJ, Liu XB, Ren DS, et al. Epidemiological characteristics of dengue fever in Chinese mainland, 2005-2020[J]. Chin J Vector Biol Control, 2023, 34(6): 761-766, 818. DOI:10.11853/j.issn.1003.8280.2023.06.010 |
| [3] |
南晓伟, 解新霞, 于红敏, 等. 内蒙古包头市2018年一起流行性乙型脑炎疫情的媒介蚊虫及感染虫媒病毒调查[J]. 中国媒介生物学及控制杂志, 2020, 31(6): 652-656. Nan XW, Xie XX, Yu HM, et al. An investigation of the vector mosquitoes and arboviruses during a Japanese encephalitis epidemic in Baotou of Inner Mongolia autonomous region, China, 2018[J]. Chin J Vector Biol Control, 2020, 31(6): 652-656. DOI:10.11853/j.issn.1003.8280.2020.06.005 |
| [4] |
Hebert PDN, Cywinska A, Ball SL, et al. Biological identifications through DNA barcodes[J]. Proc Roy Soc B Biol Sci, 2003, 270(1512): 313-321. DOI:10.1098/rspb.2002.2218 |
| [5] |
Wang X, Tu WC, Huang EJ, et al. Identification of disease-transmitting mosquitoes: Development of species-specific probes for DNA chip assay using mitochondrial COⅠ and ND2 genes and ribosomal internal transcribed spacer 2[J]. J Med Entomol, 2017, 54(2): 396-402. DOI:10.1093/jme/tjw195 |
| [6] |
陆宝麟. 中国动物志昆虫纲第8卷双翅目: 蚊科(上卷)[M]. 北京: 科学出版社, 1997: 132-133, 189-192. Lu BL. Fauna sinica. Insecta, Volume 8. Diptera: Culicidae Ⅰ[M]. Beijing: Science Press, 1997: 132-133, 189-192. |
| [7] |
周明浩, 褚宏亮. 常见病媒生物分类鉴定手册[M]. 苏州: 苏州大学出版社, 2019: 15. Zhou MH, Chu HL. Handbook for classification and identification of main vectors[M]. Suzhou: Soochow University Press, 2019: 15. |
| [8] |
马英, 鲁亮. DNA条形码技术[J]. 中国媒介生物学及控制杂志, 2012, 23(3): 185-190, 205. Ma Y, Lu L. DNA barcode technology[J]. Chin J Vector Biol Control, 2012, 23(3): 185-190, 205. |
| [9] |
郭玉燕, 罗雷, 宋璋瑶, 等. 我国部分地区28种蚊虫的线粒体COⅠ基因序列分析[J]. 中国寄生虫学与寄生虫病杂志, 2017, 35(3): 280-287. Guo YY, Luo L, Song ZY, et al. Mitochondrial DNA sequence analysis of cytochrome oxidase subunit Ⅰ gene from 28 mosquito species in China[J]. Chin J Parasitol Parasit Dis, 2017, 35(3): 280-287. |
| [10] |
Poter CH, Collins FN. Species-diagnostic differences in a ribosomal DNA internal transcribed spacer from the sibling species Anopheles freeborni and An. hermsi[J]. Am J Trop Med Hyg, 1991, 45(2): 217-279. DOI:10.4269/ajtmh.1991.45.271 |
| [11] |
Folmer O, Black M, Hoeh W, et al. DNA primers for amplification of mitochondrial cytochrome c oxidase subunit Ⅰ from diverse metazoan invertebrates[J]. Mol Mar Biol Biotechnol, 1994, 3(5): 294-299. |
| [12] |
徐建农, 瞿逢伊, 董学书. 不同蚊种核糖体DNA第二内转录间隔区的PCR扩增[J]. 第二军医大学学报, 1996, 17(2): 180-181. Xu JN, Qu FY, Dong XS. PCR amplification of the second inner transcription spacer of ribosomal DNA in different mosquito species[J]. Acad J Second Mil Med Univ, 1996, 17(2): 180-181. DOI:10.16781/j.0258-879x.1996.02.033 |
| [13] |
Adhami J, Reiter P. Introduction and establishment of Aedes (Stegomyia) albopictus Skuse (Diptera: Culicidae) in Albania[J]. J Am Mosq Control Assoc, 1998, 14(3): 340-343. |
| [14] |
Medlock JM, Hansford KM, Schaffner F, et al. A review of the invasive mosquitoes in Europe: Ecology, public health risks, and control options[J]. Vector Borne Zoonotic Dis, 2012, 12(6): 435-447. DOI:10.1089/vbz.2011.0814 |
| [15] |
Gould EA, Higgs S. Impact of climate change and other factors on emerging arbovirus diseases[J]. Trans Roy Soc Trop Med Hyg, 2009, 103(2): 109-121. DOI:10.1016/j.trstmh.2008.07.025 |
| [16] |
European Centre for Disease Prevention and Control. Development of Aedes albopictus risk maps[M]. Stockholm: ECDC, 2009: 24.
|
| [17] |
European Centre for Disease Prevention and Control. The climatic suitability for dengue transmission in continental Europe[M]. Stockholm: ECDC, 2012: 13.
|
| [18] |
Paupy C, Delatte H, Bagny L, et al. Aedes albopictus, an arbovirus vector: From the darkness to the light[J]. Microbes Infect, 2009, 11(14/15): 1177-1185. |
| [19] |
Kraemer MU, Sinka ME, Duda KA, et al. The global distribution of the arbovirus vectors Aedes aegypti and Ae. albopictus[J]. eLife, 2015, 4: e08347. DOI:10.7554/eLife.08347 |
| [20] |
李国太, 傅鸿, 郭玉红, 等. 甘肃省嘉陵江流域首次发现登革热媒介白纹伊蚊[J]. 中国自然医学杂志, 2009, 11(2): 128-129. Li GT, Fu H, Guo YH, et al. First record of dengue vector Aedes albopictus in Jialingjiang River basin of Gansu province[J]. Chin J Nat Med, 2009, 11(2): 128-129. DOI:10.16505/j.2095-0136.2009.02.002 |
| [21] |
Ogden NH, Lindsay LR. Effects of climate and climate change on vectors and vector-borne diseases: Ticks are different[J]. Trends Parasitol, 2016, 32(8): 646-656. DOI:10.1016/j.pt.2016.04.015 |
| [22] |
孙养信, 佘建军, 孙亮, 等. 陕西省白纹伊蚊分布边界及影响因素调查[J]. 中国媒介生物学及控制杂志, 2009, 20(5): 430-432. Sun YX, She JJ, Sun L, et al. Study on dividing line and influence factor of Aedes albopictus in Shaanxi province[J]. Chin J Vector Biol Control, 2009, 20(5): 430-432. |
| [23] |
Medlock JM, Hansford KM, Versteirt V, et al. An entomological review of invasive mosquitoes in Europe[J]. Bull Entomol Res, 2015, 105(6): 637-663. |
| [24] |
杨舒然, 刘起勇. 白纹伊蚊的全球分布及扩散趋势[J]. 中国媒介生物学及控制杂志, 2013, 24(1): 1-4. Yang SR, Liu QY. Trend in global distribution and spread of Aedes albopictus[J]. Chin J Vector Biol Control, 2013, 24(1): 1-4. |
 2024, Vol. 35
2024, Vol. 35