扩展功能
文章信息
- 唐烨榕, 周红宁, 马文军, 肖建鹏, 赵建国, 张倩, 李菁华
- TANG Ye-rong, ZHOU Hong-ning, MA Wen-jun, XIAO Jian-peng, ZHAO Jian-guo, ZHANG Qian, LI Jing-hua
- 基于Knox模型分析2019年中缅边境地区景洪市登革热时空聚集性特征
- Spatial-temporal clustering characteristics of dengue fever based on Knox model analysis in the China-Myanmar border area, Jinghong, China, 2019
- 中国媒介生物学及控制杂志, 2024, 35(1): 56-62
- Chin J Vector Biol & Control, 2024, 35(1): 56-62
- 10.11853/j.issn.1003.8280.2024.01.010
-
文章历史
- 收稿日期: 2023-07-14
2 云南省虫媒传染病防控关键技术创新团队, 云南省虫媒传染病防控研究重点实验室, 云南省热带传染病国际联合实验室, 云南省寄生虫病防治所, 云南 普洱 665000;
3 暨南大学, 广东 广州 510632;
4 广东省公共卫生研究院, 广东 广州 511400;
5 广东药科大学, 广东 广州 510006;
6 中山大学全球卫生研究中心, 广东 广州 510080
2 Yunnan Innovative Team of Key Techniques for Vector-borne Disease Control and Prevention, Yunnan Provincial Key Laboratory of Vector-borne Diseases Control and Research, Yunan International Joint Laboratory of Tropical Infectious Diseases, Yunnan Institute of Parasitic Diseases, Pu'er, Yunnan 665000, China;
3 Ji'nan University, Guangzhou, Guangdong 510632, China;
4 Guangdong Provincial Institution of Public Health, Guangzhou, Guangdong 511400, China;
5 Guangdong Pharmaceutical University, Guangzhou, Guangdong 510006, China;
6 Global Health Research Center, Sun Yat-sen University, Guangzhou, Guangdong 510080, China
登革热(dengue fever)是登革病毒(Dengue virus,DENV)经伊蚊传播引起的急性虫媒传染病,重症患者死亡率高达20%,登革热已成为最常见的蚊媒传染病,流行于100多个国家[1-2],其发病数较过去50年增加了30倍[3],全球有40%的地区面临感染登革热风险,主要集中在东南亚、太平洋沿岸和美洲的热带和亚热带国家及地区,严重威胁全球公共卫生,被公认为最致命的传染病,被世界卫生组织(WHO)列入2019年全球健康十大威胁之一[4-8]。在我国,登革热是非本土流行传染病,具有输入性病例和本地病例并存的复杂形势,疫情呈快速上升趋势,分布范围也在进一步扩大,已逐渐从中国南部沿海地区的广东省扩展到相对西部和北部的地区,其中广州市和云南省尤为严重[9-10]。云南省登革热本地疫情主要发生在与老挝、缅甸、越南相邻的景洪市、瑞丽市、耿马傣族佤族自治县、勐腊县、河口瑶族自治县等地。据相关研究报道,在云南省德宏傣族景颇族自治州(德宏州)、西双版纳傣族自治州(西双版纳州)景洪市本地病例中检出与缅甸、老挝输入病例相同的病毒基因型,暴发与输入病例有关[11-12]。景洪市与缅甸相邻,国境线长112.39 km,海拔552.7 m,属于热带和南亚热带湿润季风气候,年平均气温21 ℃,平均降水量1 531.9 mm,适合蚊虫孳生繁衍。历年来,景洪市边境互市繁华,出入境人流量和货物吞吐量大,边民通婚现象普遍,入境就医已是常态,周边缅甸等东南亚国家登革热疫情十分严重。自2013年以来,景洪市几乎全年均有登革热境外输入病例报告或本地疫情暴发,2019年发生了较为严重的登革热暴发疫情。本研究基于街道尺度对景洪市2019年登革热不同人群时空聚集性特点进行分析,为制定精准防控策略提供参考依据。
1 材料与方法 1.1 登革热病例资料来源于中国疾病预防控制信息系统,按照属地管理原则(现住址+发病日期)收集2019年中缅边境景洪市逐日登革热本地病例资料,本地病例的现住址均精确到街道。其中,本地感染病例指发病前14 d内未离开居住地或未到过登革热流行国家和地区的登革热病例[13]。
1.2 人口学资料来源于景洪市2019年年鉴中允景洪街道、景洪工业园区等各街道/乡镇的年末总人口数据。
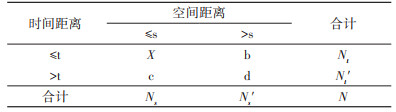
1.3 Knox模型分析采用Knox方法分析景洪市2019年登革热时空聚集性。Knox方法的备择假设是疾病的发生有时空聚集性,无效假设是疾病的发生没有时空聚集性[14]。首先将所有病例进行两两配对,然后计算每个病例对子之间的时间距离和空间距离,结合事先设定的时间界值(t)和空间界值(s)进行分析。见表 1。
其中,时间距离为“近”(时间距离≤t)的病例对子总数为Nt;空间距离为“近”(空间距离≤s)的病例对子总数为Ns;X为Knox方法的检验统计量,是时间距离和空间距离均为“近”(时间距离≤t和空间距离≤s)的病例对子总数,其计算公式为:X (s,t)=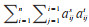
Knox方法中时间、空间界值的确定有2种方法,一种是如果已知部分疾病信息,时间界值和空间界值的设定会比较简单,但对于传染病来说,其潜伏期较为清楚,时间界值设定比较容易,但空间界值却不易设定。另一种设定方法是设置一系列的时间界值和空间界值,分别对各个组合进行检验,但其设定不能超过所有病例的平均时间距离和空间距离(平均时间距离=所有病例对子的时间间隔之和/病例对子总数,平均空间距离=所有病例对子的空间距离之和/病例对子总数)。本研究根据时间和空间距离一般不超过所有病例的平均时间和空间距离原则,以及结合登革热潜伏期(一般为3~14 d,多数情况下是5~8 d)将时间界值设定为0~15 d,间隔1 d,空间界值设置为大尺度(0~1.00 ㎞,间隔0.10 ㎞)和小尺度(0~0.10 ㎞,间隔0.005 ㎞)。通过这一系列的时间和空间界值对2019年景洪市登革热疫情进行时空聚集性分析,计算各个时空界值下的时空聚集强度[Strength(S),S=(X-E)/E×100]和相对危险度[relative risk(RR),RR=X/E],其中,S值越大表示时空聚集强度越强,RR则表示与其他时空临界值相比,在该时空界值下登革热发病风险的倍数。
1.4 统计学分析运用Excel 2010软件建立2019年景洪市登革热病例和人口学数据库;通过ArcGIS 10.7软件绘制登革热疫情时空分布图等,以及运用R 4.0.3软件实现Knox分析。
2 结果 2.1 流行病学特征 2.1.1 发病情况2019年景洪市累计报告3 303例本地病例,发病率为763.44/10万(3 303/432 646),无死亡病例。首例登革热本地感染病例于7月21日发病,随后病例数呈快速上升趋势,单日发病数于9月10日达最高峰(133例);其中8-10月为发病高峰,共报告登革热病例3 160例,占发病总数的95.67%(3 160/3 303),见图 1。
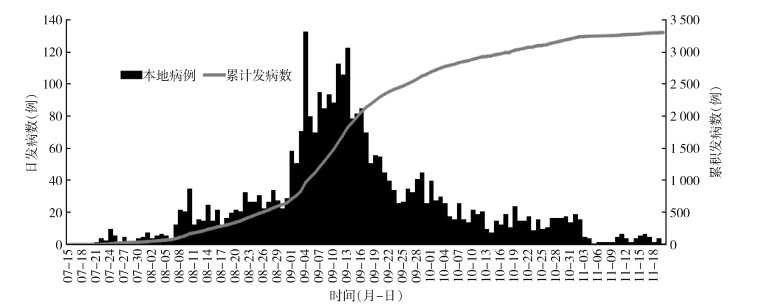
|
| 图 1 中缅边境地区云南省景洪市2019年登革热本地病例逐日分布 Figure 1 Daily distribution of local dengue cases in the China-Myanmar border area, Jinghong, Yunnan Province, 2019 |
| |
3 303例病例中,男、女性别比为1.14∶1,以青中年为主,占72.93%(2 409/3 303),年龄最小1月龄,最大93岁。职业分布中以农民为主(654例),其次为离退人员(558例)、家务及待业(425例)和商业服务(401例),合计占总发病数的61.70%(2 038/3 303)。见表 2。
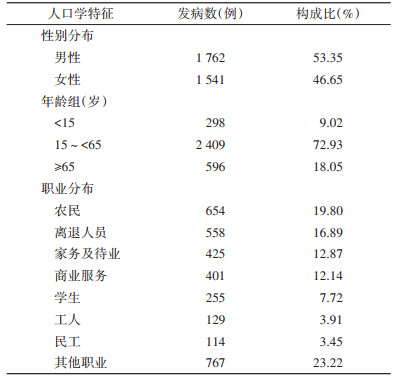
|
本次疫情除勐旺乡外其余12个乡镇均受波及,其中允景洪街道疫情最严重,累计报告2 516例(占76.17%),发病数大于150例的区域有嘎洒镇(237例)、景洪工业园区(217例)和旅游度假区(166例),而发病数最少的为基诺乡(3例)。见图 2。
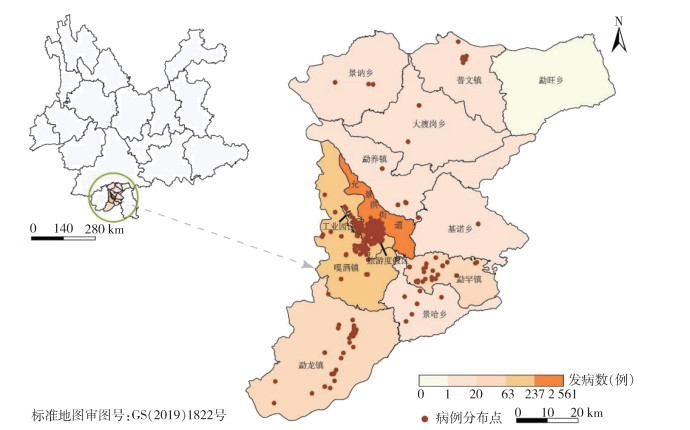
|
| 图 2 中缅边境景洪市2019年登革热本地病例空间分布 Figure 2 Spatial distribution of local dengue cases in the China-Myanmar border area, Jinghong, Yunnan Province, 2019 |
| |
通过Konx模型分析结果显示,病例对子的时间距离密度分布随着时间距离的增加而下降,所有病例对子的平均时间距离为23.49 d,病例对子的空间距离密度分布随着距离的增加呈现断崖式下降,平均空间距离为5.54 km。
2.2.2 发病风险分析配对病例对子时间间隔越短,发病风险(RR值)越大,且随空间距离增加而下降的幅度更大。在0.40 km后的不同时间界值下登革热发病风险随空间距离的增加而快速下降,类似于幂律分布现象(Power-law)。时间间隔在1 d时,空间距离在0.40~0.50 km时登革热发病风险处于极高水平(RR≈2.0),空间距离在>0.50~1.00 km时,发病风险处于较高水平(RR>1.60),在>1.00~2.00 km时,发病风险处于中等水平(RR≥1.40),距离达4.00 km时RR=1.20,随后缓慢下降,距离为15.00 km时仍RR>1.00。见图 3。
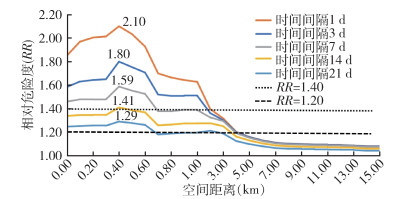
|
| 图 3 病例对子不同时间界值下云南省景洪市登革热发病风险与距离的关系 Figure 3 Relationship between dengue risk and distance in case pairs at different time intervals in Jinghong, Yunnan Province |
| |
大尺度下,登革热病例在不同时空界值组合下均呈现出时空聚集性,通过蒙特卡洛法检验,P<0.05。病例的时空聚集强度(S值)随时间、空间距离的增加而下降,在短距离(≤500.00 m)9 d内S值呈现较高水平。而小尺度分析中发现,各时空界值组合均呈现极高的时空聚集强度,其中空间距离65.00~100.00 m和时间间隔在3 d内尤为明显。
2.2.4 不同特征人群时空聚集分析 2.2.4.1 大尺度下人群分布特征(≤1.00 ㎞和≤15 d)大尺度分析发现,不同性别年龄组登革热病例的时空聚集特点相近且差异较小,总体上均呈现时空聚集强度随时间、空间距离的增加而逐渐下降的趋势,在第1天600.00 m内均呈现较高强度。其中,在性别上看,病例对子总的时空聚集强度未见明显差异(图 4A)。从年龄方面来看,病例的时空聚集特点差异较大,呈现多种聚集模式。儿童-儿童(≤14岁)病例对子短时间长距离的时空聚集强度明显高于其他组合,在第1天300.00 m处聚集强度最高;而老年人-老年人(≥65岁)病例对子在200.00 m处最高;中青年-中青年(15~<65岁)病例对子聚集模式与性别的时空聚集特点相近;病例对子总的时空聚集强度(∑S值)呈现儿童-儿童>老年人-老年人>青中年-青中年的规律(图 4B)。
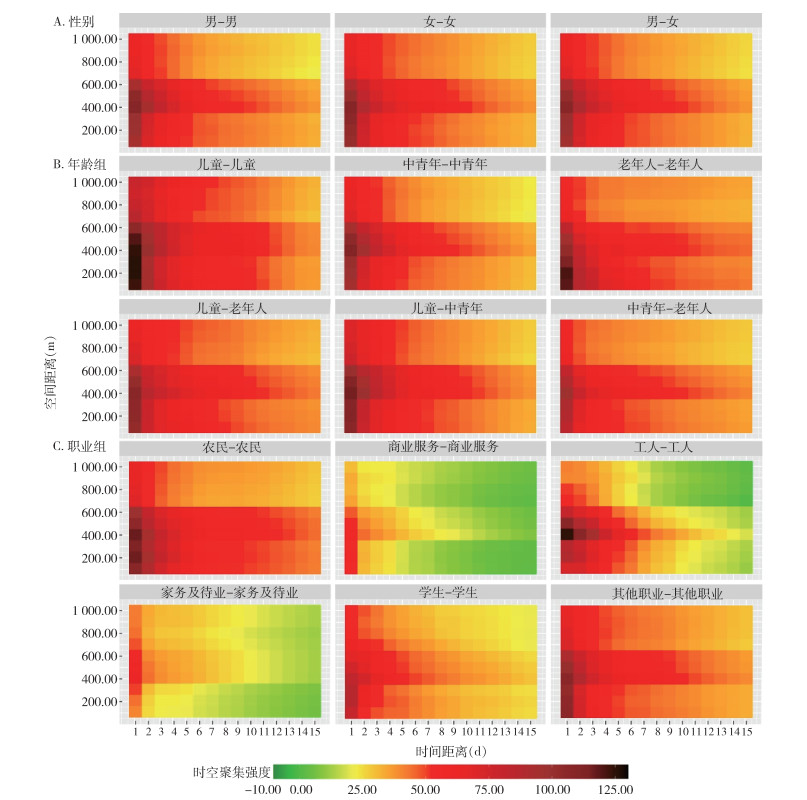
|
| 图 4 大尺度下云南省景洪市不同性别、年龄和职业登革热病例的时空聚集强度 Figure 4 Strength of spatial-temporal clustering of dengue fever cases of different sexes, ages, and occupations at a large scale in Jinghong, Yunnan Province |
| |
从职业方面分析,不同组登革热病例的时空聚集特点相差较大,但总体上仍均呈现时空聚集强度随时间、空间距离的增加而逐渐下降的趋势。其中,工人-工人病例对子时空聚集性较高的空间距离为500.00 m以内,农民-农民则具有2个空间聚集峰值,分别在200.00和400.00 m。见图 4C。
2.2.4.2 小尺度下人群分布特征(≤0.10 km和≤15 d)小尺度分析发现,各病例对子组合均呈现较高的时空聚集强度,且呈随时间、空间距离的增加而逐渐下降的趋势。其中,在性别上看,各病例对子组合间时空聚集强度未见明显差异,均在第1天呈现明显聚集性(图 5A)。从年龄方面来看,病例的时空聚集特点差异较大,儿童-儿童病例对子短时间短距离的时空聚集强度明显高于其他组合,其次为老年人-老年人病例对子组合(图 5B)。从职业方面分析,农民-农民病例对子时空聚集性最高,呈现农民-农民>其他职业-其他职业>学生-学生>工人-工人>家务及待业-家务及待业>商业服务-商业服务(图 5C)。
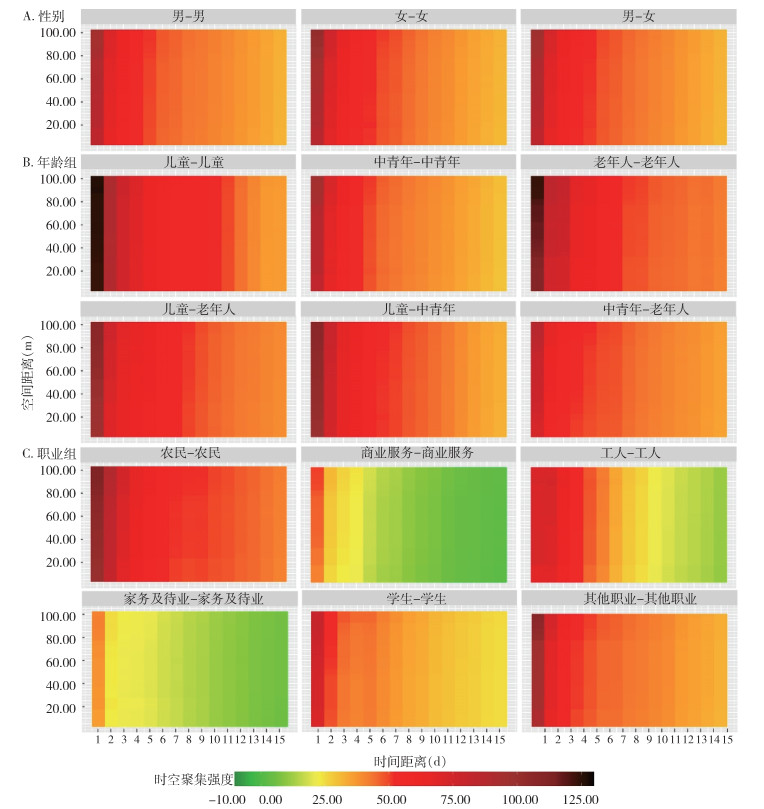
|
| 图 5 小尺度下云南省景洪市不同性别、年龄和职业登革热病例的时空聚集强度 Figure 5 Strength of spatial-temporal clustering of dengue fever cases of different sexes, ages, and occupations at a small scale in Jinghong, Yunnan Province |
| |
云南省景洪市与缅甸接壤,商务往来频繁,加之景洪市为全国热带雨林旅游胜地,跨境及省内外旅游繁荣,人员流动大。研究发现,云南省登革热本地疫情发生早期与周边国家输入病例相关性较大,主要由境外输入病例引发本地疫情暴发[15]。本调查发现在新型冠状病毒感染疫情暴发前景洪市登革热流行态势十分严峻,发病高峰在8-10月,病例主要集中在青年和中年人群,与姜进勇等[16]结果一致。
3.2 登革热疫情时空聚集性特征以往研究发现,伊蚊密度(如布雷图指数)的高低对登革热发生或控制具有关键性的驱动作用,且登革热传播距离受伊蚊飞行距离影响[17]。本研究结果也揭示,在时间间隔在1 d的情况下,空间距离在0.40~0.50 km内登革热发病风险处于极高水平(RR≈2.00),这可能与当地居民的居住环境、房屋构建、蚊虫飞行距离、蚊虫孳生地和活动范围相关。空间距离在>0.60~1.00 km内,发病风险处于较高水平,而在>1.00~2.00 km内,发病风险处于中等水平(RR≥1.40),与谢润生[17]、Viet等[18]和Tran等[19]的研究结果基本一致,即在短时间短距离内,时空聚集强度和发病风险越高。此外,本次分析可初步确定景洪市登革热传播的最大关注范围在间隔5.00 km和23 d内,即使空间距离在15.00 ㎞时发病风险仍较高(RR>1.00),与Aldstadt等[20]研究结果类似,提示在相对长空间距离或时间距离也存在较高登革热发病风险,可能与作为登革热传染源的患者和隐性感染者在日常生活中远距离跨区域活动相关[17]。
登革热内潜伏期一般为5~8 d,外潜伏期为8~10 d[13]。本研究发现大尺度下,病例的时空聚集强度(S值)随时间、空间距离的增加而下降,在短距离(≤500.00 m)9 d内S值呈现较高水平;在小尺度下时间间隔在3 d内时空聚集强度尤为明显,这可能受登革病毒在蚊虫体内繁殖时间、隐性感染者及二代病例等因素的影响。
本研究还发现景洪市登革热时空传播规律在不同特征人群(性别、年龄、职业)中具有异质性,长时间短距离接触人群时空聚集强度最强,如儿童-儿童和老年人-老年人病例对子。在进行分析时,不同尺度下不同职业时空聚集具有明显差异,大尺度下工人-工人病例对子最强,小尺度下农民-农民病例对子最强,这可能与人群接触模式不同有关,有研究发现不同的人群行为模式可导致不同的疾病传播风险和时空特性[21]。建议景洪市在今后的防控工作中,应加大对儿童、老年人、农民和工人等人群的登革热防控知识宣传力度,提高此类人群的知晓率和防控意识。
3.3 局限性为了保证数据的可获得性和完整性,本次研究仅采用了本地病例的现住址进行分析,未纳入病例的行动轨迹,如工作场所、娱乐场所等;其次,未考虑登革病毒基因型,在今后的调查研究中应尽量夯实数据基础,更全面、更精准地分析景洪市的登革热疫情特征。
利益冲突 无
| [1] |
Kumar K, Singh PK, Tomar J, et al. Dengue: Epidemiology, prevention and pressing need for vaccine development[J]. Asian Pac J Trop Med, 2010, 3(12): 997-1000. DOI:10.1016/S1995-7645(11)60017-5 |
| [2] |
WHO. Dengue and severe dengue[EB/OL]. (2023-03-17)[2023-07-14]. https://www.who.int/news-room/fact-sheets/detail/dengue-and-severe-dengue.
|
| [3] |
Guzman MG, Harris E. Dengue[J]. Lancet, 2015, 385(9966): 453-465. DOI:10.1016/S0140-6736(14)60572-9 |
| [4] |
Hosseini S, Oliva-Ramírez J, Vázquez-Villegas P, et al. Dengue fever: A worldwide threat an overview of the infection process, environmental factors for a global outbreak, diagnostic platforms and vaccine developments[J]. Curr Top Med Chem, 2018, 18(18): 1531-1549. DOI:10.2174/1568026618666181105130000 |
| [5] |
WHO. Global strategy for dengue prevention and control, 2012-2020[R]. Geneva: World Health Organization, 2012: 4-5.
|
| [6] |
WHO. Scientific working group report on dengue[R]. Geneva, Switzerland: World Health Organization, 2007: 183.
|
| [7] |
李晋涛. 登革热防治研究进展[J]. 第三军医大学学报, 2019, 41(19): 1902-1907. Li JT. Advances in prevention and control for dengue fever[J]. J Third Milit Med Univ, 2019, 41(19): 1902-1907. DOI:10.16016/j.1000-5404.201909095 |
| [8] |
刘媛媛, 刘远, 罗雷, 等. 2011-2019年广州市登革热流行病学特征分析[J]. 现代预防医学, 2021, 48(11): 1925-1929. Liu YY, Liu Y, Luo L, et al. Epidemiological analysis on dengue fever cases in Guangzhou, 2011-2019[J]. Mod Prev Med, 2021, 48(11): 1925-1929. |
| [9] |
岳玉娟, 任东升, 刘小波, 等. 2014-2018年中国登革热病例空间特征及相关关系研究[J]. 中国媒介生物学及控制杂志, 2020, 31(5): 517-520. Yue YJ, Ren DS, Liu XB, et al. A study on spatial characteristics and correlations of different types of dengue cases in mainland China, 2014-2018[J]. Chin J Vector Biol Control, 2020, 31(5): 517-520. DOI:10.11853/J.ISSN.1003.8280.2020.05.003 |
| [10] |
Wu JY, Lun ZR, James AA, et al. Dengue fever in mainland China[J]. Am J Trop Med Hyg, 2010, 83(3): 664-671. DOI:10.4269/ajtmh.2010.09-0755 |
| [11] |
Sang SW, Wang SS, Lu L, et al. The epidemiological characteristics and dynamic transmission of dengue in China, 2013[J]. PLoS Negl Trop Dis, 2016, 10(11): e0005095. DOI:10.1371/journal.pntd.0005095 |
| [12] |
Wang BH, Li YP, Feng Y, et al. Phylogenetic analysis of Dengue virus reveals the high relatedness between imported and local strains during the 2013 dengue outbreak in Yunnan, China: A retrospective analysis[J]. BMC Infect Dis, 2015, 15: 142. DOI:10.1186/s12879-015-0908-x |
| [13] |
肖东楼. 登革热防治手册[M]. 2版. 北京: 人民卫生出版社, 2008: 1-4. Xiao DL. Dengue fever control manual[M]. 2nd ed. Beijing: People's Medical Publishing House, 2008: 1-4. |
| [14] |
李晓松, 冯子健, 殷菲, 等. 传染病时空聚集性探测与预测预警方法[M]. 北京: 高等教育出版社, 2014: 16-18. Li XS, Feng ZJ, Yin F, et al. Spatio-temporal cluster detection, forecasting and early warning for infectious disease[M]. Beijing: Higher Education Press, 2014: 16-18. |
| [15] |
陈纯, 郑红英, 张周斌, 等. 气象因素对广州市虫媒传染病发病影响研究[J]. 疾病监测, 2016, 31(12): 984-988. Chen C, Zheng HY, Zhang ZB, et al. Influence of meteorological factors on arbo infectious diseases in Guangzhou[J]. Dis Surveill, 2016, 31(12): 984-988. DOI:10.3784/j.issn.1003-9961.2016.12.004 |
| [16] |
姜进勇, 郭晓芳, 唐烨榕, 等. 云南省2004-2014年输入性登革热病例监测与防控对策分析[J]. 中国媒介生物学及控制杂志, 2016, 27(1): 5-8. Jiang JY, Guo XF, Tang YR, et al. Surveillance and control of imported dengue cases in Yunnan from 2004 to 2014[J]. Chin J Vector Biol Control, 2016, 27(1): 5-8. DOI:10.11853/j.issn.1003.4692.2016.01.002 |
| [17] |
谢润生. 潮州市登革热时空传播规律及其驱动因素研究[D]. 广州: 广东药科大学, 2017. Xie RS. Spatial-temporal transmission and the driven factors of dengue fever in Chaozhou, Guangdong province[D]. Guangzhou: Guangdong Pharmaceutical University, 2017. (in Chinese) |
| [18] |
Le Viet T, Choisy M, Bryant JE, et al. A dengue outbreak on a floating village at Cat Ba Island in Vietnam[J]. BMC Public Health, 2015, 15: 940. DOI:10.1186/s12889-015-2235-y |
| [19] |
Tran A, Deparis X, Dussart P, et al. Dengue spatial and temporal patterns, French Guiana, 2001[J]. Emerg Infect Dis, 2004, 10(4): 615-621. DOI:10.3201/eid1004.030186 |
| [20] |
Aldstadt J, Yoon IK, Tannitisupawong D, et al. Space-time analysis of hospitalised dengue patients in rural Thailand reveals important temporal intervals in the pattern of Dengue virus transmission[J]. Trop Med Int Health, 2012, 17(9): 1076-1085. DOI:10.1111/j.1365-3156.2012.03040.x |
| [21] |
Meyer S, Held L. Incorporating social contact data in spatio-temporal models for infectious disease spread[J]. Biostatistics, 2016, 18(2): 338-351. DOI:10.1093/biostatistics/kxw051 |
 2024, Vol. 35
2024, Vol. 35