扩展功能
文章信息
- 汤复根, 吕勇, 陈智超, 杨卫, 杨慧, 常宏伟
- TANG Fu-gen, LYU Yong, CHEN Zhi-chao, YANG Wei, YANG Hui, CHANG Hong-wei
- 安徽省六安市立克次体病血清学诊断和分子流行病学分析
- Serological diagnosis and molecular epidemiological analysis of rickettsiosis in Lu'an, Anhui Province, China
- 中国媒介生物学及控制杂志, 2024, 35(1): 42-48
- Chin J Vector Biol & Control, 2024, 35(1): 42-48
- 10.11853/j.issn.1003.8280.2024.01.008
-
文章历史
- 收稿日期: 2023-06-08
2 六安市疾病预防控制中心, 安徽 六安 237000
2 Lu'an Center for Disease Control and Prevention, Lu'an, Anhui 237000, China
立克次体是一类严格细胞内寄生、体积小、革兰阴性的原核细胞型微生物[1]。立克次体主要分为原始群、斑点热群、斑疹伤寒群和过渡群4个群[2]。斑点热群立克次体(spotted fever group Rickettsia,SFGR)通过被感染立克次体的蜱、螨叮咬传播[3],目前已有21种SFGR在我国被发现,其中具有致病性的立克次体已增加至8种,分别是黑龙江立克次体(Rickettsia heilongjiangensis)、拉欧蒂立克次体(R. raoultii)、新塔拉塞维奇立克次体(Candidatus Rickettsia tarasevichiae)、西伯利亚立克次体BJ-90亚种(R. sibirica sp BJ-90)、R. sp. XY99、日本立克次体(R. japonica)、蒙纳森斯立克次体(R. monacensis)、信阳立克次体(Candidatus Rickettsia xinyangensis)[4]。随着我国传染病监测的不断加强,以及生物学技术的不断进步,新的立克次体类病原体将不断被发现。斑点热群的另1种——立氏立克次体(R. rickettsia)目前在我国尚未发现,其经蜱叮咬传播引起立氏立克次体病,该病是一种急性地方性传染病,也称落基山斑点热、蜱传斑疹伤寒,临床特征有发热、头痛和皮疹[5],重型患者可危及生命[6]。立氏立克次体已成为我国高入侵风险等级的主要病原体之一[7]。
早在1899年就有立克次体病的报道,直到1906年美国才报道首例分离于人体的斑点热立克次体[8]。此后,在非洲、欧洲、美洲均有蜱传立克次体病的报道。中国研究立克次体病较晚,1958年我国从患者体内分离出莫氏立克次体菌株。一项调查显示,1990年我国立克次体人群感染率为2.2%[9]。随着调查的深入,我国陆续发现了无形体(Anaplasma)、贝纳柯克斯体(Coxiella burneti)[10]、日本立克次体、扇头蜱立克次体(R. rhipicephalus)、马赛立克次体(R. massilliae)和埃立克体(Ehrlichia)等[11]。
2017年5月,六安市疾病预防控制中心(疾控中心)接到辖区霍山县疾控中心报告,该县2家医疗卫生机构1周内接诊多例发热伴皮疹患者,发病原因不明。霍山县是一个山区县和库区县,森林覆盖率达75.1%。患者的主要临床表现为发热、乏力、全身酸痛、畏寒、皮疹和头痛等症状,部分患者有血小板和白细胞减少。患者在发病前都曾从事采茶活动,多数患者有蜱虫、蚂蟥等叮咬史。为了进一步弄清引起该病的原因,市疾控中心与霍山、金寨和舒城县多家医疗卫生机构于2017年5月-2021年11月,收集患者急性期和恢复期血样,进行相关病原体的检测和排除。由于患者进行强力霉素治疗后,症状很快消失,病人逐渐恢复,结合其临床表现考虑立克次体感染。现将结果报告如下。
1 材料与方法 1.1 标本采集2017年5月-2021年11月在六安市辖区内收集发热伴皮疹患者急性期(发病1周内)、恢复期(发病后3~4周内)的血清和对照人群(年龄、性别相近,同一村庄,1年内无蜱叮咬史和无相关症状)的血清。分别取3 ml外周静脉血及时分离血清,分离后血清存放-20 ℃冰箱备用。所有样本采集均获知情同意。
1.2 血清抗体检测使用间接免疫荧光法(indirect immunofluorescence assay,IFA)检测血清中不同病原体的IgG水平,立氏立克次体、无形体、伯氏疏螺旋体、东方体、埃立克体、斑疹伤寒立克次体试剂盒均购于美国Fuller公司。检测过程均按照试剂盒提供的使用说明书进行。
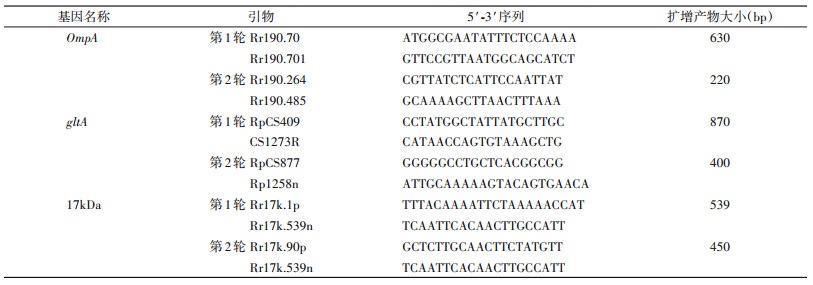
1.3 核酸扩增和序列测定选取10份急性期和恢复期血液样本中特异性IgG滴度升高4倍以上的急性期血液,由中国军事医学科学院首先采用QIAGEN DNA试剂盒,按照试剂盒说明书提取DNA,采用巢式PCR分别对样本进行ompA、gltA和17kDa基因扩增,扩增引物见表 1[1, 3, 12]。第1轮PCR反应体系为:4 μl核酸提取物,12.5 μl酶混合物,正、反向引物各0.5 μl,7.5 μl无核酸水;第2轮0.25 μl第1轮扩增产物,12.5 μl酶混合物,正、反向引物各0.5 μl,11.5 μl无核酸水。ompA、gltA、17kDa扩增反应条件见表 2,扩增产物送北京天一辉远生物科技有限公司在illumina Miseq进行二代测序。
|

|
采用MEGA Ⅹ软件,与PubMed公布的基因序列进行分析比较。采用最大似然法(maximum likelihood,ML)与相关序列构建进化树,并用PhyML 3.0软件进行系统进化分析,明确六安市引起发热伴皮疹的病原体及其分子流行病学特征。
1.5 统计学方法采用SPSS 21.0软件进行统计学分析,率的比较采用χ2检验,P < 0.05表示差异有统计学意义。
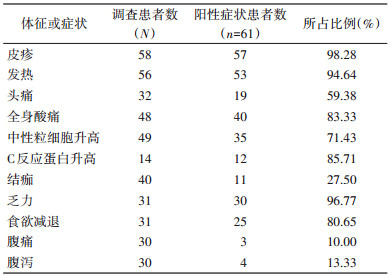
2 结果 2.1 患者基本情况2017-2021年,共调查139例发热伴皮疹患者,其中霍山县69例,金寨县45例,舒城县11例,金安区7例,裕安区6例,安庆市岳西县1例。77例为60岁以上的老年人,占患者总数的55.40%,其次是20~60岁人群,占患者的43.88%,而20岁以下患者仅1例。发热伴皮疹139例患者中女性94例,占67.63%,男女性别比为1∶2.09。调查21例患者的职业,其中18例为务农,占调查总数的85.71%。见表 3。

|
共获得139例患者中61例的临床症状,主要临床表现为发热、乏力、食欲减退、头痛、全身酸痛、皮疹和焦痂(表 4),还有少部分出现白细胞减少。61例患者中的31例获得暴露情况,其中有8例种地,占比为25.81%,29例从事过采茶工作,占比为93.55%。。
|
共获得139例患者急性期血样132人份,恢复期37人份,对照组21人份,计190人份,其中有30例发热伴皮疹患者收集了急性期和恢复期双份血样。使用IFA法对血清中的6种致病病原微生物进行检测,其中无形体、伯氏疏螺旋体、斑疹伤寒立克次体的抗体检测结果均为阴性。双份血清中立氏立克次体IgG抗体均为阳性(患者发病1周内采集的第1份血清和恢复后2周内采集的第2份血清,按照试剂盒说明书进行检测和判定,恢复期血清中抗体滴度水平较之急性期有4倍升高,判定为结果阳性)。见图 1。

|
| A. 阴性对照;B. 阳性对照;C. 加入样本稀释液的空白对照;D. 急性期血清稀释倍数1∶64(+);E. 恢复期血清稀释倍数1∶512(+);F. 恢复期血清稀释倍数1∶8192(+)。 图 1 安徽省六安市发热伴皮疹患者血清中立氏立克次体IgG间接免疫荧光法检测结果 Figure 1 Results of serum IgG antibody of cases of fever with rashes in Lu'an, Anhui Province, China to Rickettsia rickettsii by indirect immunofluorescence assay |
| |
本次研究采集的190份血液样本,全部进行了立氏立克次体IgG抗体的检测,其中34份急性期血液同时进行了埃立克体、伯氏疏螺旋体、东方体、无形体和斑疹伤寒立克次体IgG抗体检测,结果伯氏疏螺旋体、无形体和斑疹伤寒立克次体IgG抗体检测均为阴性。
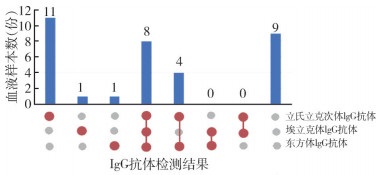
立氏立克次体IgG抗体检测结果显示,急性期、对照组和恢复期的阳性率分别为51.52%(68/132)、90.48%(19/21)和89.19%(33/37),差异有统计学意义(χ2=25.200,P < 0.001)。34份急性期血液样本立氏立克次体、埃立克体和东方体IgG抗体阳性率分别为67.65%(23/34)、26.47%(9/34)和38.24%(13/34)(表 5),不同病原体阳性率差异有统计学意义(χ2=12.407,P=0.002),其中3种抗体均阳性的8份,2种抗体阳性的4份,1种抗体阳性的2份,3种抗体均阴性的9份。见图 2。

|
|
| 注:红色点表示该抗体阳性,灰色点表示该抗体阴性。 图 2 安徽省六安市发热伴皮疹患者34份急性期血液样本3种立克次体IgG抗体检测结果 Figure 2 Results of IgG antibodies of cases in 34 acute-stage blood samples of cases of fever with rashes in Lu'an, Anhui Province, China to three rickettsial species |
| |
血清样本经过PCR扩增及电泳,ompA序列仅1份标本出现目标长度片段,经测序,并经基于局部比对算法的搜索工具(basic local alignment search tool,BLAST)比对,同源性为90.3%~99.4%,证实为斑点热立克次体。gltA及17kDa序列无阳性条带出现。从GenBank上下载国内外公布的斑点热立克次体ompA序列,其中国内50条,国外18条,涵盖16个亚型和22个未定型,用MEGA Ⅹ构建邻接法进化树,结果见图 3。

|
| 注:▲本研究所获得的序列。 图 3 基于ompA序列的安徽省六安市发热伴皮疹患者感染立克次体进化树 Figure 3 Rickettsial phylogenetic analysis of fever with rash infection based on rickettsial ompA sequence in Lu'an, Anhui Province, China |
| |
六安市下辖的霍山、金寨和舒城3县地处大别山北麓,主要为山区丘陵地貌,地势西南高峻,东北低平,由南向北呈阶梯状分布。地理环境决定了本地有非常丰富的动植物资源,其生态环境适合病媒生物的孳生和生长,2015年该地被确定为发热伴血小板减少综合征疫源地。
本研究共调查139例发热伴皮疹患者,主要人群为老年人,职业主要为农民。霍山县患者主要集中在4-5月采茶季,患者均有采茶或上山耕地的暴露史,80%以上的患者出现皮疹、乏力、发热、C反应蛋白升高、全身酸痛和食欲减退。部分患者出现头痛和中性粒细胞升高,极少患者出现腹痛、腹泻症状。重症患者表现为全身严重过敏反应、心肌炎、出血、心力衰竭、呼吸衰竭、脓毒性休克等致命并发症[8]。SFGR感染的临床症状主要有发热、皮疹和头痛,但一项本研究邻近地区的立克次体感染研究中,5名患者均未出现皮疹或焦痂,仅1例出现头痛;因此该研究认为,由于SFGR感染的临床症状不典型,需通过实验室检测方法辅助加以诊断[13]。本研究采集发热伴皮疹病例的急性期血清样本进行立氏立克次体、东方体和埃立克体IgG检测,结果显示3种病原体均检出阳性。对采集有急性期和恢复期双份血清的30例病例进行立氏立克次体IgG滴度检测发现,恢复期滴度较急性期升高4倍以上有28例。立氏立克次体是落基山斑点热的病原体,为SFGR中毒力最强的一个种。立氏立克次体进入机体,在血管内皮细胞中生长繁殖导致血管损伤,患者可因主要器官衰竭而死亡[14]。由于检测方法和试剂的局限性,SFGR存在一定的交叉反应,不能通过IFA检测结果来判定感染立克次体的具体种类,因此有必要对病原体核酸序列进一步分析,确立病原体分型,为后续流行病学调查和治疗奠定基础。
我国致病性SFGR目前报道的主要有8种,其引起的非特异性临床表现是诊断的一个重大挑战,患者均有高热、头痛、全身不适等非特异性临床症状,并且随种型特性、感染途径、数量以及人体敏感性的不同而呈现轻重不等的临床表现,极易误诊为上呼吸道感染或不明原因发热[15]。大多数临床医生不熟悉疾病在早期表现为非特异性的蜱传疾病症状,应予以关注[16]。随着现代分子生物学诊断技术的发展、应用,如三代测序技术及化学发光基因芯片等的应用,将有助于新病原体的发现,提高人类感染的实验室诊断水平[17-19]。
根据立克次体遗传学分类指南,斑点热群成员应具有ompA基因或至少满足4项rrs、gltA、ompB和基因D标准中的2项。该群任何成员的rrs、gltA、ompB和基因D的成对核苷酸序列同源性分别为≥98.8%、≥92.7%、≥85.8%和≥82.2%[20]。gltA基因编码柠檬酸合成酶,该酶的序列具有种属特异性,进化距离较远的立克次体之间有明显差异[21]。ompA是外膜蛋白基因,由于5′端具有高度特异性,因此可作为SFGR的种属鉴定金标准[22]。本研究对采集的发热伴皮疹病例的急性期血液样本进行立克次体ompA、gltA和17kDa[23]巢式PCR扩增。结果只在Lu’an007样本中测出ompA目标片段,经二代测序得到序列,BLAST比对发现与SFGR的序列同源性达90%以上,可见该病原体确定为SFGR。Jin等[24]2021-2022年从六安市金寨县880只蜱中分离出251株立克次体,经鉴定分属于立克次体、埃立克体和无形体3属。从建立的进化树可见,本次测得的ompA的序列与我国云南省发现的SFGR Cadidatus R. jingxinensis[25]同源性较近,在进化树上二者形成一个单枝(monoclade),可能属于同一个种,但还需要进一步和其他基因如rrs和gltA检测结果共同确定。而与我国黑龙江省发现的黑龙江立克次体[26-27]同源性较远。遗憾的是,可能由于本次检测样本采集时间的问题或其他原因,在gltA和17kDa均未扩增出目标片段,未得到相应序列,该立克次体的确切分类需进一步深入研究。
利益冲突 无
| [1] |
Li H, Li XM, Du J, et al. Candidatus Rickettsia xinyangensis as cause of spotted fever group rickettsiosis, Xinyang, China, 2015[J]. Emerg Infect Dis, 2020, 26(5): 985-988. DOI:10.3201/eid2605.170294 |
| [2] |
Blanton LS. The rickettsioses: A practical update[J]. Infect Dis Clin North Am, 2019, 33(1): 213-229. DOI:10.1016/j.idc.2018.10.010 |
| [3] |
姜理平, 孟真, 崔清荣, 等. 浙江省蜱标本中斑点热群立克次体rOmpA和gltA基因检测[J]. 中国媒介生物学及控制杂志, 2010, 21(4): 350-352. Jiang LP, Meng Z, Cui QR, et al. Detection of rOmpA and gltA genes of spotted fever group rickettsiae from tick specimens in Zhejiang province[J]. Chin J Vector Biol Control, 2010, 21(4): 350-352. |
| [4] |
夏珞媛. 我国南方地区新斑点热群立克次体的发现、分离鉴定及其潜在致病性研究[D]. 安徽医科大学, 2021. DOI: 10.26921/d.cnki.ganyu.2020.001088. Xia LY. Isolation, identification and potential pathogenicity of three spotted fever group rickettsiae in southern China [D]. Anhui Medical University, 2021. DOI: 10.26921/d.cnki.ganyu.2020.001088.(in Chinese). |
| [5] |
Lyu Y, Shen Y, Hu CY, et al. The first reported outbreak of an undetermined species of human infection with spotted fever group Rickettsia in Lu'an, China[J]. Acta Tropica, 2021, 223: 106072. DOI:10.1016/j.actatropica.2021.106072 |
| [6] |
Jia N, Zheng YC, Ma L, et al. Human infections with Rickettsia raoultii, China[J]. Emerg Infect Dis, 2014, 20(5): 866-868. DOI:10.3201/eid2005.130995 |
| [7] |
王晓旭, 冀好强, 韦晓慧, 等. 中国外来入侵致病菌风险评估研究[J]. 中国媒介生物学及控制杂志, 2023, 34(2): 154-164. Wang XX, Ji HQ, Wei XH, et al. Risk assessment of alien pathogen invasion in China[J]. Chin J Vector Biol Control, 2023, 34(2): 154-164. DOI:10.11853/j.issn.1003.8280.2023.02.004 |
| [8] |
Parola P, Paddock CD, Raoult D. Tick-borne rickettsioses around the world: Emerging diseases challenging old concepts[J]. Clin Microbiol Rev, 2005, 18(4): 719-756. DOI:10.1128/CMR.18.4.719-756.2005 |
| [9] |
郭雨微, 孟庆峰, 王伟利, 等. 蜱传立克次体病检测方法研究进展[J]. 中国农学通报, 2012, 28(26): 36-39. Guo YW, Meng QF, Wang WL, et al. The progress of the test methods of tick-borne rickettsial disease[J]. Chin Agric Sci Bull, 2012, 28(26): 36-39. DOI:10.3969/j.issn.1000-6850.2012.26.009 |
| [10] |
孙长俭, 周连庆, 薛文成, 等. 辽宁省农村地区Q热立克次体血清学及虫媒蜱携带病原体状况调查[J]. 华南国防医学杂志, 2016, 30(6): 362-364. Sun CJ, Zhou LQ, Xue WC, et al. Epidemiological survey of Coxiella burnetii serology and tick carrying pathogen conditions in the rural area of Liaoning province[J]. Mil Med J S Chin, 2016, 30(6): 362-364. DOI:10.13730/j.issn.1009-2595.2016.06.002 |
| [11] |
韩茜, 许红彬, 冯云, 等. 江西省赣州市蜱携带立克次体和埃立克体的调研[J]. 中国人兽共患病学报, 2019, 35(6): 518-524. Han X, Xu HB, Feng Y, et al. Rickettsia and Ehrichia from ticks: Field and laboratory investigation in Ganzhou city, Jiangxi province, China[J]. Chin J Zoonoses, 2019, 35(6): 518-524. DOI:10.3969/j.issn.1002-2694.2019.00.077 |
| [12] |
Shao JW, Yao XY, Song XD, et al. Molecular detection and genetic diversity of Rickettsia spp. in pet dogs and their infesting ticks in Harbin, northeastern China[J]. BMC Vet Res, 2021, 17(1): 113. DOI:10.1186/s12917-021-02823-y |
| [13] |
Li H, Cui XM, Cui N, et al. Human infection with novel spotted fever group Rickettsia genotype, China, 2015[J]. Emerg Infect Dis, 2016, 22(12): 2153-2156. DOI:10.3201/eid2212.160962 |
| [14] |
吴德平, 王颖, 王锡乐, 等. 立氏立克次体蛋白抗原基因的表达和重组蛋白抗原的免疫印迹分析[J]. 中国人兽共患病学报, 2009, 25(10): 931-934, 939. Wu DP, Wang Y, Wang XL, et al. Expression of the genes encoding protein antigens of Rickettesia rickettesii and the analysis of the recombinant protein antigens by immunoblotting[J]. Chin J Zoonoses, 2009, 25(10): 931-934, 939. DOI:10.3969/j.issn.1002-2694.2009.10.002 |
| [15] |
于永慧, 焦俊, 付梦姣, 等. 实时荧光定量PCR同时快速检测4类致病性立克次体[J]. 寄生虫与医学昆虫学报, 2019, 26(2): 110-117. Yu YH, Jiao J, Fu MJ, et al. Simultaneous and rapid detection of four kinds of pathogenic Rickettsia by quantitative real-time PCR[J]. Acta Parasitol Med Entomol Sin, 2019, 26(2): 110-117. DOI:10.3969/j.issn.1005-0507.2019.02.007 |
| [16] |
Nilsson K, Wallménius K, Hartwig S, et al. Bell's palsy and sudden deafness associated with Rickettsia spp. infection in Sweden. A retrospective and prospective serological survey including PCR findings[J]. Eur J Neurol, 2014, 21(2): 206-214. DOI:10.1111/ene.12218 |
| [17] |
Jia N, Zheng YC, Jiang JF, et al. Human infection with Candidatus Rickettsia tarasevichiae[J]. N Engl J Med, 2013, 369(12): 1178-1180. DOI:10.1056/NEJMc1303004 |
| [18] |
李灵云, 张英杰, 王升启, 等. 7种立克次体甄别检测基因芯片方法的建立[J]. 军事医学, 2015, 39(7): 508-513. Li LY, Zhang YJ, Wang SQ, et al. DNA microarray for simultaneous screening and detection of seven rickettsia[J]. Mil Med Sci, 2015, 39(7): 508-513. DOI:10.7644/j.issn.1674-9960.2015.07.005 |
| [19] |
吴捷, 王少玲, 马焱, 等. 斑点热群立克次体实时荧光定量PCR检测方法的建立及应用[J]. 现代预防医学, 2015, 42(22): 4137-4139, 4146. Wu J, Wang SL, Ma Y, et al. Establishment and application of real-time fluorescence quantitative PCR in spotted fever group rickettsiae detection[J]. Mod Prev Med, 2015, 42(22): 4137-4139, 4146. |
| [20] |
Fournier PE, Dumler JS, Greub G, et al. Gene sequence-based criteria for identification of new Rickettsia isolates and description of Rickettsia heilongjiangensis sp. nov[J]. J Clin Microbiol, 2003, 41(12): 5456-5465. DOI:10.1128/JCM.41.12.5456-5465.2003 |
| [21] |
Roux V, Rydkina E, Eremeeva M, et al. Citrate synthase gene comparison, a new tool for phylogenetic analysis, and its application for the rickettsiae[J]. Int J Syst Bacteriol, 1997, 47(2): 252-261. DOI:10.1099/00207713-47-2-252 |
| [22] |
Miranda J, Mattar S. Molecular detection of Rickettsia bellii and Rickettsia sp. strain Colombianensi in ticks from Cordoba, Colombia[J]. Ticks Tick-Borne Dis, 2014, 5(2): 208-212. DOI:10.1016/j.ttbdis.2013.10.008 |
| [23] |
Sekeyova Z, Roux V, Raoult D. Phylogeny of Rickettsia spp. inferred by comparing sequences of 'gene D', which encodes an intracytoplasmic protein[J]. Int J Syst Evol Microbiol, 2001, 51(Pt 4): 1353-1360. DOI:10.1099/00207713-51-4-1353 |
| [24] |
Jin XJ, Liao JS, Chen QQ, et al. Diversity of Rickettsiales bacteria in five species of ticks collected from Jinzhai county, Anhui province, China in 2021-2022[J]. Front Microbiol, 2023, 14: 1141217. DOI:10.3389/fmicb.2023.1141217 |
| [25] |
Liu H, Liang XT, Wang HJ, et al. Molecular evidence of the spotted fever group rickettsiae in ticks from Yunnan province, Southwest China[J]. Exp Appl Acarol, 2020, 80(3): 339-348. DOI:10.1007/s10493-020-00467-5 |
| [26] |
杜娟. 发热伴血小板减少综合征疫源地中斑点热群立克次体的调查研究[D]. 北京: 军事科学院, 2018. Du J. Investigation of spotted fever group rickettsiae in the epidemic region of severe fever with thrombocytopenia syndrome[D]. Beijing: Academy of Military Sciences, 2018. (in Chinese) |
| [27] |
Mediannikov OY, Sidelnikov Y, Ivanov L, et al. Acute tick-borne rickettsiosis caused by Rickettsia heilongjiangensis in the Russian far East[J]. Emerg Infect Dis, 2004, 10(5): 810-817. DOI:10.3201/eid1005.030437 |
 2024, Vol. 35
2024, Vol. 35


