扩展功能
文章信息
- 陈丽, 周克梅, 吴超, 赵晓涛, 董朝良, 尹小雄, 王炳辉, 姜进勇
- CHEN Li, ZHOU Ke-mei, WU Chao, ZHAO Xiao-tao, DONG Chao-liang, YIN Xiao-xiong, WANG Bing-hui, JIANG Jin-yong
- 云南省埃及伊蚊击倒抗性基因流行特征研究
- Prevalence characteristics of knockdown resistance gene of Aedes aegypti in Yunnan Province, China
- 中国媒介生物学及控制杂志, 2024, 35(1): 1-8
- Chin J Vector Biol & Control, 2024, 35(1): 1-8
- 10.11853/j.issn.1003.8280.2024.01.001
-
文章历史
- 收稿日期: 2023-09-18
2 云南省热带传染病国际联合实验室, 云南省病媒生物学与控制国际联合实验室, 云南省虫媒传染病防控研究重点实验室, 云南省虫媒传染病防控关键技术创新团队, 云南省寄生虫病防治所, 云南 普洱 665000;
3 德宏傣族景颇族自治州疾病预防控制中心, 云南 芒市 678400;
4 瑞丽市疾病预防控制中心, 云南 瑞丽 678600
2 Yunnan International Joint Laboratory of Tropical Infectious Diseases, Yunnan International Joint Laboratory of Vector Biology and Control, Yunnan Provincial Key Laboratory of Vector-borne Diseases Control and Research, Yunnan Institute of Parasitic Diseases Innovative Team of Key Techniques for Vector Borne Disease Control and Prevention, Yunnan Institute of Parasitic Diseases, Pu'er, Yunnan 665000, China;
3 Dehong Dai and Jingpo Autonomous Prefecture Center for Disease Control and Prevention, Mangshi, Yunnan 678400, China;
4 Ruili Center for Disease Control and Prevention, Ruili, Yunnan 678600, China
埃及伊蚊(Aedes aegypti)最早被发现于非洲大陆,现已从非洲扩展到全球其他热带和亚热带区域[1]。老挝、缅甸、越南、泰国和柬埔寨等东南亚国家均有分布,中国云南省与上述国家接壤或邻近,2002年中国疾病预防控制中心“媒介伊蚊调查专项”首次在瑞丽市发现该蚊,因云南省边境地区海拔、气候和温度等适宜其定殖、繁殖和扩散,短短20年间已扩散分布于德宏傣族景颇族自治州(德宏州)、临沧市和西双版纳傣族自治州(西双版纳州)等边境州(市)的12县(市)[2]。埃及伊蚊是登革热(dengue fever,DF)、基孔肯雅热(chikungunya)、寨卡病毒病(Zika virus disease)的主要传播媒介,近20年来这些疾病在全球范围内快速增长,成为全球重要的公共卫生问题。特别是登革热病例在东南亚国家持续增加,给地区国家公共卫生系统带来挑战[3]。随着埃及伊蚊在云南省边境地区的分布,加之周边国家登革热病例输入后,已引起了多起埃及伊蚊传播疾病的本地疫情暴发,特别是2019年云南省首次在瑞丽市发生基孔肯雅热本地疫情[4]。登革热目前尚无可推广使用的高效疫苗或预防、治疗药物,使用卫生杀虫剂控制伊蚊密度可有效切断相关传染病的传播,因此在云南省多次的本地疫情暴发处置中,长期大量地使用各种杀虫剂开展灭蚊控制,埃及伊蚊对拟除虫菊酯类杀虫剂已产生不同程度抗性[5-6]。了解埃及伊蚊对杀虫剂产生抗药性的机制对于有效管理杀虫剂抗性至关重要。既往研究发现,病媒生物抗药性产生的机制主要有增强对杀虫剂解毒代谢作用的代谢抗性和降低靶点敏感性的靶标抗性[7]。
电压门控钠离子通道(voltage-gated sodium channel,VGSC)是拟除虫菊酯类杀虫剂的作用靶标,VGSC中核苷酸突变使相应编码的氨基酸发生改变,VGSC基因结构发生变化,导致对拟除虫菊酯类杀虫剂的敏感性降低产生抗性称为击倒抗性(knockdown resistance,kdr)[8]。已发现埃及伊蚊VGSC中V410L、G923V、L982W、S989P、A1007G、I1011M/V、V1016G/I、T1520I、F1534C/L和D1763Y[9]等13个位点kdr突变与拟除虫菊酯类杀虫剂抗性有关。目前关于云南省埃及伊蚊kdr突变情况研究较少,2015-2022年Li等[10]、师灿南[11]、石清明[12]、王戈[13]和兰学梅等[14]分别对云南省埃及伊蚊kdr突变情况进行了检测,样本均只涉及云南省部分埃及伊蚊分布区,扩增大多为特异性检测单个位点突变情况,未包含13个突变位点所在的VGSC基因的4个结构域区域。为掌握云南省埃及伊蚊VGSC蛋白编码基因13个位点突变情况,本研究收集云南省埃及伊蚊现有分布地区,包括瑞丽市、耿马傣族佤族自治县(耿马县)、景洪市、镇康县、勐海县、勐腊县和盈江县等县(市)埃及伊蚊野外种群样本,设计引物,采用直接测序法,检测VGSC基因中kdr突变情况,旨在丰富云南省埃及伊蚊群体kdr突变数据,为杀虫剂抗性机制研究提供依据。
1 材料与方法 1.1 供试蚊虫来源2022-2023年,在云南省6个县(市)采集埃及伊蚊幼虫和蛹带回实验室饲养,羽化后鉴定[15]为埃及伊蚊,收集于装有75%乙醇溶液的冻存管中,4 ℃保存。盈江县仅收集伊蚊幼虫鉴定为埃及伊蚊后,收集并置于-80 ℃冰箱保存,详细信息见表 1。

|
收集的埃及伊蚊(成蚊/幼蚊)按照试剂盒[天根生化科技(北京)有限公司,批号:23040610T324]说明书,提取单只样本基因组DNA。参照文献[16]合成并设计引物(表 2),扩增VGSC第Ⅰ、Ⅱ、Ⅲ和Ⅳ部分区域基因,各引物的PCR反应体系相同:包含2×Taq预混液12.5 μl,10 μmol/L正、反引物各1.0 μl,DNA模板2.0 μl,加双蒸灭菌水至25.0 μl。反应条件为:95 ℃ 10 min;95 ℃ 30 s,55 ℃ 45 s,72 ℃ 45 s,35个循环;72 ℃延伸5 min(第Ⅰ区域);94 ℃ 3 min;94 ℃15 s,60 ℃/55 ℃/60 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃延伸7 min(第Ⅱ/Ⅲ/Ⅳ区域)。扩增产物经1.5%琼脂糖凝胶电泳检测,凝胶成像分析系统检测后观察电泳条带大小。将与目的条带大小相符的样品送至北京擎科生物科技有限公司(昆明)测序。

|
所获序列数据在美国国立生物技术信息中心(NCBI)进行比对,从分子特征上确认为埃及伊蚊后,使用Snapgene 6.0.2软件对所得的序列文件和峰图与埃及伊蚊参考序列(No.AY663385.1)进行比对分析,观察各位点的突变情况,确定突变类型和基因型,使用Microsoft Excel 2021软件计算各采集地样本的VGSC等位基因类型和各位点突变率。使用SPSS 25.0软件,χ2检验比较不同位点突变率和不同性别成蚊VGSC基因kdr突变的差异等。
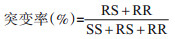
|
式中,SS表示敏感纯合子,RS表示抗性杂合子,RR表示抗性纯合子。
2 结果 2.1 序列分析结果自盈江县、瑞丽市、镇康县、耿马县、勐海县、景洪市和勐腊县7个县(市)共采集732只蚊虫,其中561只(雌蚊276只、雄蚊242只和幼蚊43只)埃及伊蚊样本成功提取蚊DNA基因组并被用于VGSC基因的扩增,共获得2 244条测序结果。与GenBank下载的参考序列(No.AY663385.1)比较,结果显示基因相似度≥98.97%,所得序列均为埃及伊蚊的VGSC序列片段。
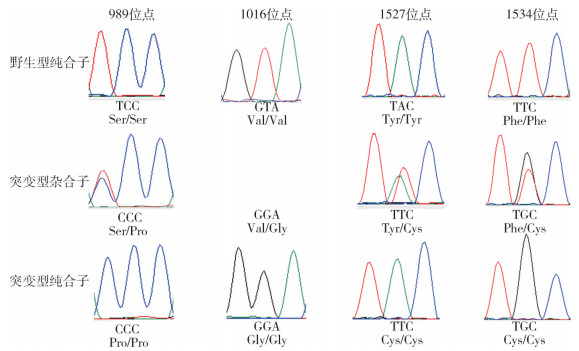
通过比对,发现所得序列中存在4个位点的突变,分别是氨基酸序列第989位点由丝氨酸(S)突变为脯氨酸(P),相对应的碱基TCC突变为CCC;第1016位点由缬氨酸(V)突变为甘氨酸(G),相对应的碱基GTA突变为GGA;第1527位点由酪氨酸(Y)突变为苯丙氨酸(F),相对应的碱基TAC突变为TTC;第1534位点由苯丙氨酸(F)突变为半胱氨酸(C),相对应的碱基TTC突变TGC。见图 1。
|
| 注:Ser丝氨酸;Val缬氨酸;Tyr酪氨酸;Cys半胱氨酸;Phe苯丙氨酸;Pro脯氨酸;Gly甘氨酸。 图 1 云南省埃及伊蚊电压门控钠离子通道基因各位点非同义突变 Figure 1 Non-synonymous mutation at each locus in the voltage-gated sodium channel gene of Aedes aegypti in Yunnan Province, China |
| |
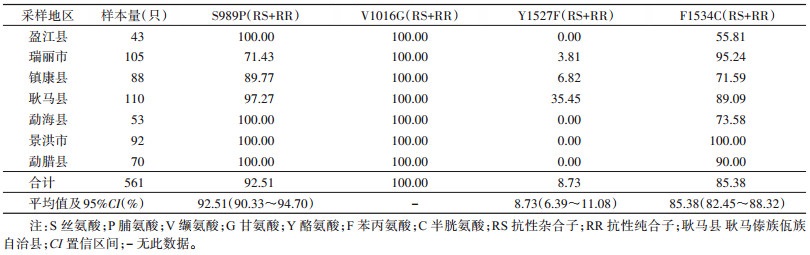
7个县(市)埃及伊蚊均存在S989P、V1016G和F1534C位点突变(图 2),其中S989P突变率为71.43%~100%,均值为92.51%,最低为瑞丽市种群,各县(市)突变率差异有统计学意义(χ2=87.253,P < 0.001);V1016G突变率均为100%;F1534C突变率为55.81%~100%,均值为85.38%,盈江县种群最低,各县(市)突变率差异有统计学意义(χ2=98.839,P < 0.001);另外发现瑞丽市、耿马和镇康县3个县(市)存在Y1527F位点突变(图 2),均值为8.73%,3地种群间突变率差异有统计学意义(χ2=47.687,P < 0.001),瑞丽市突变率最低,仅3.81%,见表 3。

|
| 图 2 云南省7个县(市)埃及伊蚊电压门控钠离子通道基因4个位点突变对比图 Figure 2 Comparison of mutations at 4 loci of the voltage-gated sodium channel gene of Aedes aegypti in 7 counties/cities of Yunnan Province, China |
| |
|
埃及伊蚊共存在4种联合突变类型:S989P+V1016G、V1016G+F1534C、S989P+V1016G+F1534C和S989P+V1016G+Y1527F+ F1534C。每个县(市)均存在S989P+V1016G+F1534C突变,其中景洪市占比最高(100%),镇康县占比最低(50.00%);除景洪市外,其余6个县(市)均存在S989P+V1016G联合突变,其中盈江县占比最高(44.19%),瑞丽市占比最低(5.71%);V1016G+F1534C和S989P+V1016G+Y1527F+F1534C突变仅存在于瑞丽市、耿马和镇康县3个县(市),其中V1016G+F1534C突变瑞丽市占比最高(28.57%),耿马县占比最低(2.73%),而S989P+V1016G+Y1527F+F1534C突变耿马县占比最高(35.45%),瑞丽市占比最低(3.81%)。见表 4。

|
采用χ2检验分别对6个县(市)的雌、雄蚊进行989、1527和1534位点突变率比较,差异均无统计学意义,1016位点各地雌、雄蚊突变率均为100%;对6个县(市)雌、雄蚊联合突变构成比进行比较,差异均无统计学意义。盈江县因仅采集到埃及伊蚊幼虫,未开展雌、雄蚊突变率比较。见表 5、6。

|

|
埃及伊蚊VGSC中有多个位点kdr突变与拟除虫菊酯类杀虫剂抗性有关,多数突变位于ⅡS6和ⅢS6区域,既往云南省常见突变位点有1016和1534[17]。本次研究对云南省7个埃及伊蚊分布区VGSC基因进行检测,共发现989、1016、1527和1534 4个位点突变。首次发现云南省瑞丽市、镇康县和耿马县野生埃及伊蚊群体中存在Y1527F突变,突变率分别为3.81%、6.82%和35.45%,以瑞丽市最高。云南省Y1527F总突变率为8.73%。此突变仅于2022年由Naw等[18]在缅甸Chan Aye Thazan和Naung Cho埃及伊蚊中发现且突变率相对较低,为0.76%。比较云南省与缅甸埃及伊蚊Y1527F突变率差异有统计学意义(χ2=28.577,P < 0.001)。云南省埃及伊蚊Y1527F突变与拟除虫菊酯类杀虫剂产生靶标抗性是否有关,需进一步进行研究。
本次研究发现,S989P突变率为71.43%~100%,最低为瑞丽市,盈江县、勐海县、景洪市和勐腊县均为100%,V1016G在7个县(市)突变率均为100%,F1534C突变率为55.81%~100%,最低为盈江县,最高为景洪市。2015年Li等[10]研究中瑞丽埃及伊蚊S989P突变率(99.07%)与本次结果比较差异有统计学意义(χ2=32.720,P < 0.001),其原因可能是瑞丽市埃及伊蚊接触了某种因素,S989P产生了回复突变,具体何种因素有待进一步研究。7个县(市)V1016G突变率均为100%,既往学者的研究也得到了相似的结果,如2017年师灿南[11]研究云南省景洪市埃及伊蚊V1016G突变率为100%,2020年兰学梅等[14]研究云南省5个县(市)(景洪市、勐腊县、勐海县、瑞丽市和耿马县)埃及伊蚊V1016G突变率为99.83%,本次研究V1016G基因型均为突变纯合子,推测V1016G突变在云南省埃及伊蚊中普遍发生且呈稳定遗传趋势。本研究总的F1534C突变率为85.38%,与2020年兰学梅等[14]研究(46.38%)相比,差异有统计学意义(χ2=192.132,P < 0.001),F1534C的突变率大幅上升,提示埃及伊蚊对拟除虫菊酯类杀虫剂抗性进一步增强。特别是景洪市埃及伊蚊S989P、V1016G和F1534C突变率均为100%,与近几年来景洪市开展登革热防控大量多频次使用拟除虫菊酯类杀虫剂有重要关系。
比较6个县(市)雌、雄埃及伊蚊的S989P、V1016G、F1534C和Y1527F的突变率,证实雌、雄蚊VGSC各位点的突变率差异无统计学意义;同一县(市)的雌、雄埃及伊蚊联合突变的构成情况差异无统计学意义,可以认为同一埃及伊蚊种群性别不影响各个位点的突变率和联合突变的构成比。幼蚊与成蚊间是否存在不同,需进一步收集样本进行比较研究。
埃及伊蚊VGSC基因kdr突变类型有单突变、2位点联合突变、3位点联合突变和4位点联合突变,S989P+V1016G和S989P+V1016G+F1534C是亚洲最常见的联合突变类型,在泰国[19-20]、缅甸[21-22]、柬埔寨[23]和老挝[24]等国均有发现,集中分布于澜沧江-湄公河流域。多个位点突变同时存在可能导致埃及伊蚊对拟除虫菊酯类杀虫剂产生或具有更高水平的抗性[25]。Del Fiol等[26]发现与S989P+V1016G+F1534C相比,S989P+V1016G增强了对溴氰菊酯和氯菊酯的抗性。本研究发现2种2位点联合突变(S989P+V1016G和V1016G+F1534C),1种3位点联合突变(S989P+V1016G+F1534C)和1种4位点联合突变(S989P+V1016G+Y1527F+F1534C)。S989P+V1016G+ F1534C在7个县(市)构成比均是最高(50.00%~100%),仍占据联合突变类型的主导地位,未发现单位点突变的情况。2017-2019年兰学梅等[5, 27]发现景洪市、耿马、勐海和勐腊县野外采集的埃及伊蚊对3.2%氯菊酯死亡率分别为0.92%、1.43%、3.51%和8.57%;对0.08%氯氟氰菊酯死亡率勐海和勐腊县分别为2.86%和5.67%;对0.20%溴氰菊酯死亡率耿马、勐海和勐腊县分别为60.27%、63.45%和8.24%,进一步证实联合突变对抗药性程度的变化有影响,影响程度需做埃及伊蚊对杀虫剂死亡率与联合突变构成间的相关分析。此外,S989P+V1016G+Y1527F+F1534C联合突变仅分布于云南省瑞丽市、耿马县和镇康县3个县(市),该突变是否比S989P+V1016G+F1534C导致埃及伊蚊更高水平的抗药性,未来有待进一步研究。
综上所述,本研究首次发现云南省瑞丽市、镇康和耿马县野生埃及伊蚊种群中存在Y1527F突变,以耿马县突变率最高。调查点均存在S989P、V1016G和F1534C高频率突变。7个调查县(市)V1016G突变率均为100%,此突变有稳定遗传趋势。同一种群埃及伊蚊性别不影响各个位点的突变率和联合突变的构成比。VGSC中kdr多位点联合突变占据主导地位,表明云南省埃及伊蚊对拟除虫菊酯类杀虫剂抗性程度高。云南省应定期开展埃及伊蚊VGSC基因突变监测,及时掌握埃及伊蚊对杀虫剂靶标抗性变化规律。
利益冲突 无
| [1] |
Beaty BJ, Black W, Eisen L, et al. The intensifying storm: Domestication of Aedes aegypti, urbanization of arboviruses, and emerging insecticide resistance[M]//Mack A. Global health impacts of vector-borne diseases: Workshop summary. Washington: National Academies Press, 2016: 64-66.
|
| [2] |
李春敏, 董学书, 杨明东. 云南省埃及伊蚊地理分布与季节消长[J]. 中国媒介生物学及控制杂志, 2018, 29(4): 394-396, 399. Li CM, Dong XS, Yang MD. Geographical distribution and seasonal variations of Aedes aegypti in Yunnan province[J]. Chin J Vector Biol Control, 2018, 29(4): 394-396, 399. DOI:10.11853/j.issn.1003.8280.2018.04.019 |
| [3] |
刘慧. 东南亚国家加紧应对登革热[N]. 人民日报, 2023-07-25(017). DOI: 10.28655/n.cnki.nrmrb.2023.007493. Liu H. Southeast Asian countries are stepping up their response to dengue fever[N]. 2023-07-25(017). DOI: 10.28655/n.cnki.nrmrb.2023.007493.(in Chinese) |
| [4] |
张海林. 云南省登革热和基孔肯雅热跨境传播、本地流行、发展趋势及对策[J]. 中国媒介生物学及控制杂志, 2021, 32(1): 12-20. Zhang HL. Cross-border spread, indigenous transmission, development trend, and control strategy for dengue fever and chikungunya fever in Yunnan province, China[J]. Chin J Vector Biol Control, 2021, 32(1): 12-20. DOI:10.11853/j.issn.1003.8280.2021.01.002 |
| [5] |
兰学梅, 魏春, 朱进, 等. 中国-老挝登革热重点地区埃及伊蚊孳生习性及杀虫剂抗性水平比较研究[J]. 中国媒介生物学及控制杂志, 2023, 34(2): 238-243. Lan XM, Wei C, Zhu J, et al. A comparative study of breeding habits and insecticide resistance of Aedes aegypti in key areas of dengue fever in China and Laos[J]. Chin J Vector Biol Control, 2023, 34(2): 238-243. DOI:10.11853/j.issn.1003.8280.2023.02.016 |
| [6] |
郑宇婷, 杨春梅, 杨明东, 等. 云南边境地区登革热媒介伊蚊生态学及抗药性监测[J]. 中国媒介生物学及控制杂志, 2022, 33(1): 38-43. Zheng YT, Yang CM, Yang MD, et al. Ecological and insecticide resistance surveillance of dengue vector Aedes in Yunnan border region of China[J]. Chin J Vector Biol Control, 2022, 33(1): 38-43. DOI:10.11853/j.issn.1003.8280.2022.01.007 |
| [7] |
宋晓, 史琦琪, 程鹏, 等. 病媒昆虫的抗药性分子机制研究进展[J]. 中国媒介生物学及控制杂志, 2018, 29(6): 657-661, 665. Song X, Shi QQ, Cheng P, et al. Research progress in molecular mechanisms of vector insect's resistance to insecticides[J]. Chin J Vector Biol Control, 2018, 29(6): 657-661, 665. DOI:10.11853/j.issn.1003.8280.2018.06.029 |
| [8] |
Dang K, Doggett SL, Veera Singham G, et al. Insecticide resistance and resistance mechanisms in bed bugs, Cimex spp. (Hemiptera: Cimicidae)[J]. Parasit Vectors, 2017, 10(1): 318. DOI:10.1186/s13071-017-2232-3 |
| [9] |
Chen ML, Du YZ, Nomura Y, et al. Chronology of sodium channel mutations associated with pyrethroid resistance in Aedes aegypti[J]. Arch Insect Biochem Physiol, 2020, 104(2): E21686. DOI:10.1002/arch.21686 |
| [10] |
Li CX, Kaufman PE, Xue RD, et al. Relationship between insecticide resistance and kdr mutations in the dengue vector Aedes aegypti in Southern China[J]. Parasit Vectors, 2015, 8: 325. DOI:10.1186/s13071-015-0933-z |
| [11] |
师灿南. 景洪市登革热媒介伊蚊对常用杀虫剂的抗药性及机制初步研究[D]. 北京: 中国疾病预防控制中心, 2017. Shi CN. Insecticides resistance and its underlying mechanisms for dengue vectors Aedes albopictus and Ae. aegypti in Jinghong city, Yunnan province[D]. Beijing: Chinese Center for Disease Control and Prevention, 2017. (in Chinese) |
| [12] |
石清明. 云南省埃及伊蚊种群遗传特征研究[D]. 北京: 中国人民解放军军事医学科学院, 2017. Shi QM. Genetic characteristics of Aedes aegypti (Diptera: Culicidae) in Yunnan province[D]. Beijing: Academy of Military Sciences of Chinese Peopleʼs Liberation Army, 2017. (in Chinese) |
| [13] |
王戈. 云南省中老和中缅边境地区埃及伊蚊种群遗传特征研究[D]. 北京: 中国人民解放军军事医学科学院, 2023. DOI: 10.27193/d.cnki.gjsky.2022.000140. Wang G. Study on population genetic characteristics of Aedes aegypti in China-Laos and China-Myanmar border areas of Yunnan province[D]. Beijing: Military Academy of Sciences, 2023. DOI: 10.27193/d.cnki.gjsky.2022.000140.(in Chinese) |
| [14] |
兰学梅, 杨明东, 杨锐, 等. 云南省埃及伊蚊对拟除虫菊酯类抗性群体的击倒抗性基因突变分析[J]. 中国人兽共患病学报, 2020, 36(12): 993-999. Lan XM, Yang MD, Yang R, et al. Analysis of knockdown resistance gene mutations in pyrethroid insecticide resistant populations of Aedes aegypti in Yunnan province[J]. Chin J Zoonoses, 2020, 36(12): 993-999. DOI:10.3969/j.issn.1002-2694.2020.00.163 |
| [15] |
陆宝麟. 中国动物志 昆虫纲 第八卷 双翅目: 蚊科(上卷)[M]. 北京: 科学技出版社, 1997: 221-223. Lu BL. Fauna sinica. Insecta, Volume 8. Diptera: Culicidae Ⅰ[M]. Beijing: Science Press, 1997: 221-223. |
| [16] |
Endersby-Harshman NM, Ali A, Alhumrani B, et al. Voltage-sensitive sodium channel (Vssc) mutations associated with pyrethroid insecticide resistance in Aedes aegypti (L.) from two districts of Jeddah, Kingdom of Saudi Arabia: Baseline information for a Wolbachia release program[J]. Parasit Vectors, 2021, 14(1): 361. DOI:10.1186/s13071-021-04867-3 |
| [17] |
陈丽, 姜进勇. 澜沧江-湄公河流域埃及伊蚊电压门控钠离子通道击倒抗性基因研究进展[J]. 中国病原生物学杂志, 2023, 18(3): 354-357, 363. Chen L, Jiang JY. A review of knockdown resistance in voltage-gated sodium channel of Aedes aegypti in Lancang-Mekong river Basin[J]. J Pathog Biol, 2023, 18(3): 354-357, 363. DOI:10.13350/j.cjpb.230322 |
| [18] |
Naw H, Võ TC, Lê HG, et al. Knockdown resistance mutations in the voltage-gated sodium channel of Aedes aegypti (Diptera: Culicidae) in Myanmar[J]. Insects, 2022, 13(4): 322. DOI:10.3390/insects13040322 |
| [19] |
Son-Un P, Choovattanapakorn N, Saingamsook J, et al. Effect of relaxation of deltamethrin pressure on metabolic resistance in a pyrethroid-resistant Aedes aegypti (Diptera: Culicidae) strain harboring fixed P989P and G1016G kdr alleles[J]. J Med Entomol, 2018, 55(4): 975-981. DOI:10.1093/jme/tjy037 |
| [20] |
Plernsub S, Saingamsook J, Yanola J, et al. Additive effect of knockdown resistance mutations, S989P, V1016G and F1534C, in a heterozygous genotype conferring pyrethroid resistance in Aedes aegypti in Thailand[J]. Parasit Vectors, 2016, 9(1): 417. DOI:10.1186/s13071-016-1713-0 |
| [21] |
Kawada H, Oo SZM, Thaung S, et al. Co-occurrence of point mutations in the voltage-gated sodium channel of pyrethroid-resistant Aedes aegypti populations in Myanmar[J]. PLoS Negl Trop Dis, 2014, 8(7): E3032. DOI:10.1371/journal.pntd.0003032 |
| [22] |
Naw H, Su MNC, Võ TC, et al. Overall prevalence and distribution of knockdown resistance (kdr) mutations in Aedes aegypti from Mandalay Region, Myanmar[J]. Korean J Parasitol, 2020, 58(6): 709-714. DOI:10.3347/kjp.2020.58.6.709 |
| [23] |
Boyer S, Lopes S, Prasetyo D, et al. Resistance of Aedes aegypti (Diptera: Culicidae) populations to deltamethrin, permethrin, and temephos in Cambodia[J]. Asia Pac J Public Health, 2018, 30(2): 158-166. DOI:10.1177/1010539517753876 |
| [24] |
Shimono T, Kanda S, Lamaningao P, et al. Phenotypic and haplotypic profiles of insecticide resistance in populations of Aedes aegypti larvae (Diptera: Culicidae) from central Lao PDR[J]. Trop Med Health, 2021, 49(1): 32. DOI:10.1186/s41182-021-00321-3 |
| [25] |
Fan YJ, O'Grady P, Yoshimizu M, et al. Evidence for both sequential mutations and recombination in the evolution of kdr alleles in Aedes aegypti[J]. PLoS Negl Trop Dis, 2020, 14(4): E0008154. DOI:10.1371/journal.pntd.0008154 |
| [26] |
Del Fiol FS, Balcão VM, Barberato-Fillho S, et al. Obesity: A new adverse effect of antibiotics?[J]. Front Pharmacol, 2018, 9: 1408. DOI:10.3389/fphar.2018.01408 |
| [27] |
兰学梅, 朱进, 李华昌, 等. 云南省登革热重点地区埃及伊蚊对11种杀虫剂的抗药性调查[J]. 中国媒介生物学及控制杂志, 2019, 30(5): 582-585. Lan XM, Zhu J, Li HC, et al. An investigation of the resistance of Aedes aegypti to 11 insecticides in key areas of dengue fever in Yunnan province, China[J]. Chin J Vector Biol Control, 2019, 30(5): 582-585. DOI:10.11853/j.issn.1003.8280.2019.05.025 |
 2024, Vol. 35
2024, Vol. 35


