扩展功能
文章信息
- 于波, 刘星媛, 王一平, 牛磊, 魏子桐, 王强, 梁慧杰
- YU Bo, LIU Xing-yuan, WANG Yi-ping, NIU Lei, WEI Zi-tong, WANG Qiang, LIANG Hui-jie
- 黑龙江省漠河口岸地区2019-2022年鼠类及其携带病原监测结果分析
- Surveillance and analysis of rodents and pathogens carried by them at Mohe Port in Heilongjiang Province, China, in 2019-2022
- 中国媒介生物学及控制杂志, 2023, 34(6): 728-732
- Chin J Vector Biol & Control, 2023, 34(6): 728-732
- 10.11853/j.issn.1003.8280.2023.06.004
-
文章历史
- 收稿日期: 2023-04-26
2 中华人民共和国漠河海关, 黑龙江 漠河 165300;
3 珲春国际旅行卫生保健中心, 吉林 珲春 133300;
4 中华人民共和国抚远海关, 黑龙江 抚远 156500;
5 上海国际旅行卫生保健中心, 上海 200335;
6 黑龙江国际旅行卫生保健中心检验部, 黑龙江 哈尔滨 151000
2 Mohe Customs of the People's Republic of China, Mohe, Heilongjiang 165300, China;
3 Hunchun International Travel Health Care Center, Hunchun, Jilin 133300, China;
4 Fuyuan Customs of the People's Republic of China, Fuyuan, Heilongjiang 156500, China;
5 Shanghai International Travel Health Care Center, Shanghai 200335, China;
6 Department of Medical Laboratory, Heilongjiang International Travel Health Care Center, Harbin, Heilongjiang 151000, China
鼠类与人类关系密切,作为多种病原体的宿主,严重威胁人类健康。在边境口岸地区,存在鼠源疾病跨境传播的风险。因此,在边境口岸地区开展鼠类监测非常重要。
漠河口岸位于黑龙江省漠河市兴安镇,是黑龙江省对俄边境贸易的重要口岸之一。该口岸与俄罗斯加林达口岸隔江相对,地理位置极为优越,是联通俄罗斯西伯利亚地区和远东地区最近的资源战略大通道。2019年之前,受交通不便和人员流动性大等多种因素影响,该口岸区域的鼠类监测工作未能系统开展,监测数据不完整。2019-2022年,哈尔滨海关连续4年在该区域开展鼠类监测,旨在掌握该地区鼠类的鼠种构成、季节消长及携带病原体等情况,为该口岸恢复通关,制定有针对性的鼠源疾病防控方案提供参考依据。
1 材料与方法 1.1 监测时间、地点2019-2022年,每年5-8月,以漠河口岸为中心,在其周边延伸10 km范围内,选择灌木丛、农田、工作区及针阔混交林林缘地带4种生境设置4个监测点,按照“定人员、定时间、定生境、定方法”的原则,每月监测1次,每次连续3 d。如遇恶劣天气则顺延。
1.2 监测方法 1.2.1 鼠类监测夹夜法。采用铁制标准2号鼠夹,夹距为5 m,花生米为诱饵,晚放晨收。捕获的鼠类装入鼠袋,扎紧袋口,带回实验室进行种类鉴定[1-2]并计数。
1.2.2 病原体检测无菌采集鼠肺、心、肝、肾、脾等内脏样本,冷冻密封保存,按生物安全要求,冷链送至黑龙江国际旅行卫生保健中心采用普通PCR和巢式PCR方法进行病原体检测。
鼠肝用于鼠疫耶尔森菌(Yersinia pestis,鼠疫菌)[3]、巴尔通体(Bartonella)[4]的检测;鼠肺用于汉坦病毒(Hantavirus)[3]、斑点热群立克次体(spotted fever group Rickettsia,SFGR)[5]、博卡病毒(Bocavirus)[6]的检测;鼠肾、膀胱用于伯氏疏螺旋体(Borrelia burgdorferi)[7]、钩端螺旋体(Leptospira)[8]的检测;鼠脾用于巴尔通体、埃立克体(Ehrlichia)[9]、Q热立克次体[贝纳柯克斯体(Coxiella burnetii)][10]、噬吞噬细胞无形体(Anaplasma phagoctophilum)[9]和恙虫病东方体(Orientia tsutsugamushi)[11-12]的检测。
1.3 统计学分析数据结果采用Excel 2007、SPSS 17.0软件进行统计学分析,鼠密度和鼠携带病原体阳性率的比较进行χ2检验,P < 0.05为差异有统计学意义。
2 结果 2.1 鼠密度及鼠种构成本次调查共布放鼠夹4 800夹次,有效鼠夹4 780夹次,共捕获鼠208只,平均鼠密度(捕获率)为4.35%。经形态学鉴定,共计1目3科6属7种。包括棕背䶄(Myodes rufocanns)、东方田鼠(Microtus fortis)、褐家鼠(Rattus norvegicus)、黑线姬鼠(Apodemus agrarius)、朝鲜姬鼠(A. peninsulae)、小家鼠(Mus musculus)和花鼠(Tamias sibiricus)。其中,黑线姬鼠74只,占35.58%,为优势鼠种;朝鲜姬鼠35只,占16.83%;小家鼠34只,占16.34%。见表 1。
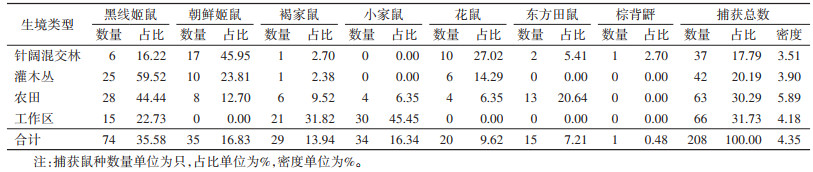
|
不同生态环境下鼠种分布不同。本次监测地点属大兴安岭林区,林木和植被丰富,捕获的鼠类以林区常见种为主。朝鲜姬鼠为黑龙江省漠河口岸地区针阔混交林的优势种,占该生境捕获鼠数的45.95%;黑线姬鼠在4个生境中均有分布,在灌木丛、农田占比较高,分别占59.52%和44.44%;工作区以小家鼠为主,占45.45%,其次为褐家鼠,占31.82%。各生境鼠密度差异有统计学意义(χ2=8.494,P < 0.05),其中农田密度最高,为5.89%,针阔混交林密度最低,为3.51%。见表 1。
2.3 不同年份鼠密度及季节消长2019-2022年各年间平均密度差异无统计学意义(χ2=1.810,P=0.613),见表 2。
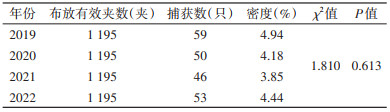
|
2019-2022年5-8月,平均鼠密度6月为高峰,后持续下降。4年中,除2019年外,其余3年鼠密度高峰期均为7月。见图 1。
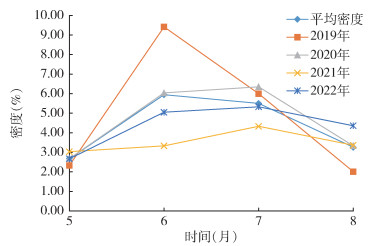
|
| 图 1 2019-2022年黑龙江省漠河口岸鼠类监测季节消长 Figure 1 Seasonal variation of rodent density at Mohe Port in Heilongjiang Province, 2019-2022 |
| |
2019-2022年5-8月捕获鼠中,朝鲜姬鼠、花鼠密度高峰期为6月,自7月开始下降;黑线姬鼠、褐家鼠密度自5月开始,呈逐渐上升趋势,至7月达到高峰后开始下降;东方田鼠密度5月为高峰期,而后呈缓慢下降趋势;棕背䶄仅在6月捕获1只。见图 2。
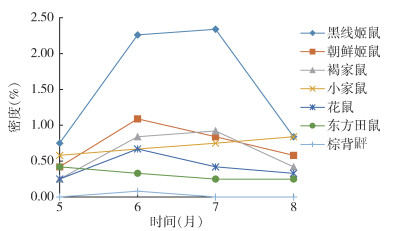
|
| 图 2 2019-2022年黑龙江省漠河口岸不同鼠种季节消长 Figure 2 Seasonal variation of different rodent species at Mohe Port in Heilongjiang Province, 2019-2022 |
| |
对采集到的208只鼠的肝脏、脾脏、肺脏、肾脏、膀胱共计1 040份样本进行11种(类)病原体检测,共在105只鼠中检出6种病原体,总病原体阳性率为50.48%。其中SFGR阳性率最高,其次为汉坦病毒和伯氏疏螺旋体,阳性率分别为40.38%、11.54%和3.85%;埃立克体、鼠疫菌、Q热立克次体、恙虫病东方体、博卡病毒5种病原体未检出。各病原体在不同鼠种间检出率差异无统计学意义(均P > 0.05)。见表 3。
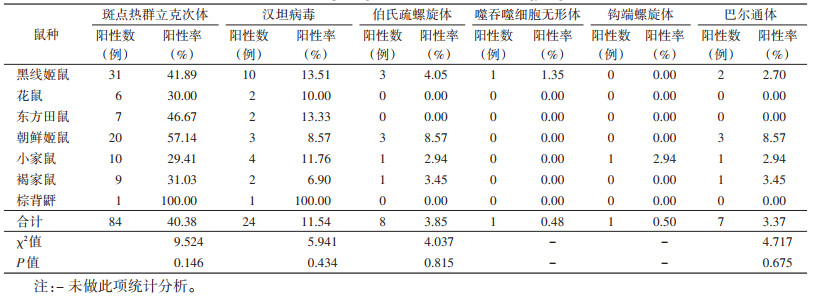
|
鼠类病原体复合感染例数较多,共20例(1例即1只鼠),占阳性例数的19.05%,其中三重感染1例(只),为SFGR与伯氏疏螺旋体、巴尔通体的复合感染,感染宿主为朝鲜姬鼠;SFGR和伯氏疏螺旋体、SFGR和巴尔通体复合感染例数最多,感染例数各为7例(只);其次为SFGR和汉坦病毒复合感染,感染例数为5例(只)。见表 4。
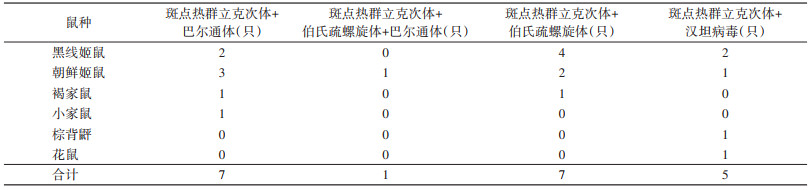
|
本轮监测共布放有效鼠夹4 780夹次,捕获鼠类7种208只,平均鼠密度4.35%。鼠种构成上以黑线姬鼠、朝鲜姬鼠、小家鼠所占比例较高,分别为35.58%、16.83%和16.34%。本次监测地点所处的地理位置为大兴安岭林区,仅有少数工作用房,捕获的鼠类以林区常见鼠为主。结果显示鼠密度高于国境口岸鼠密度标准(1%,《国境口岸除鼠规程》)。鼠密度较高的原因一是漠河口岸所在地兴安镇地处大兴安岭地区,得天独厚的植物资源,有利于鼠类孳生繁衍;二是受当地气候条件的限制,选择了鼠类活动较为活跃的时间段集中开展监测工作,9月至次年4月气温较低的冰封期未开展监测。
在近几年的黑龙江省中俄边境口岸鼠类调查研究中,SFGR始终保持较高的检出率[13-14]。本轮监测中,SFGR阳性率为40.38%,阳性率远高于Zhan等[15](9.1%)和左双燕等[16](9.3%)的调查结果。感染鼠种涵盖捕获的全部7种鼠,以棕背䶄、朝鲜姬鼠、东方田鼠和黑线姬鼠的阳性率较高,与左双燕等[16]的结果一致。本次调查地点在我国北方的SFGR覆盖面范围内(北纬40°~50°,东经80°~135°)[17]。应加强该地区斑点热的宣教工作,降低人群斑点热感染的风险。
人类鼠传疾病的发病情况与啮齿动物的密度和感染率密切相关。以往关于漠河口岸地区鼠类监测数据较少,本轮监测显示,漠河口岸地区鼠密度为4.35%,虽然低于可能出现肾综合征出血热小流行的标准(5%)[18],但野鼠型出血热的主要宿主黑线姬鼠占比最高,结合鼠携带汉坦病毒的阳性结果(11.54%),该地区肾综合征出血热暴发流行的风险不容忽视。
我国报告的莱姆病鼠类宿主为黑线姬鼠、朝鲜姬鼠、褐家鼠等[19]。上述鼠种在本轮监测捕获鼠中的占比及伯氏疏螺旋体阳性率均较高。应采取综合治理措施降低鼠密度,从而降低漠河口岸地区莱姆病的传播风险。
研究证实,啮齿动物是巴尔通体最主要的自然宿主和贮存宿主[20-21]。本次调查中,朝鲜姬鼠携带巴尔通体阳性率最高,其次为褐家鼠和小家鼠。检测结果显示,巴尔通体、SFGR复合感染例数占比较高,占总阳性数的6.67%,且存在与SFGR及伯氏疏螺旋体三重感染的情况。与巴尔通体在啮齿动物中自然感染率较高、且不受宿主动物和病原体的物种限制研究结果相符[22]。棕背䶄在此次调查中仅捕获1只,巴尔通体未检出。与文献报道的黑线姬鼠和棕背䶄是东北林区巴尔通体重要贮存宿主略有差异[21],可能与该鼠种捕获数量少有关。巴尔通体具有广泛适应性和宿主多样性的特征[23],可通过某些节肢动物的吸血活动在哺乳动物中播散[23]。因本轮监测仅使用鼠夹作为监测工具,对于巴尔通体重要的传播媒介蚤、蜱类未能检获,应在今后的监测工作中予以改进并进行风险评估。
漠河-加林达口岸是中国最北的口岸,也是距离俄罗斯西伯利亚腹地及大部分远东地区最近的口岸。与其他口岸相比,该口岸具有通关路程短、成本低的优势。随着中俄两国战略合作的逐渐深入,漠河口岸有望在不久的将来恢复通关。为漠河-加林达口岸复关后,筑牢公共卫生防线,保障人民健康,应重点加强该地区鼠及鼠源疾病的监测预警,持续关注该地区鼠种构成、携带病原体及主要有害鼠种的分布等情况,同时加强该地区鼠类体表寄生虫的调查,以便制定有针对性的环境治理方案,降低鼠源疾病潜在的传播风险。
利益冲突 无
| [1] |
郑智民, 姜志宽, 陈安国. 啮齿动物学[M]. 2版. 上海: 上海交通大学出版社, 2012: 143-191. Zheng ZM, Jiang ZK, Chen AG. Rodents zoology[M]. 2nd ed. Shanghai: Shanghai Jiao Tong University Press, 2012: 143-191. |
| [2] |
张际文. 中国国境口岸医学媒介生物鉴定图谱[M]. 天津: 天津科学技术出版社, 2015: 1-78. Zhang JW. The identification atlas of medical vectors in Chinese points of entry[M]. Tianjin: Tianjin Science and Technology Publishing House, 2015: 1-78. |
| [3] |
中华人民共和国国家质量监督检验检疫总局. SN/T 2616―2010国境口岸鼠携带鼠疫杆菌和汉坦病毒快速检测方法[S]. 北京: 中国标准出版社, 2010. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. SN/T 2616-2010 Rapid detection of Yersinia pestis and Hantavirus on rodents at frontier port[S]. Beijing: Standards Press of China, 2010. (in Chinese) |
| [4] |
中华人民共和国国家质量监督检验检疫总局. SN/T 4616―2016国境口岸巴尔通体PCR检测方法[S]. 北京: 中国标准出版社, 2017. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. SN/T 4616-2016 Detection with PCR for Bartonella at frontier port[S]. Beijing: Standards Press of China, 2017. (in Chinese) |
| [5] |
中华人民共和国国家质量监督检验检疫总局. SN/T 4611―2016国境口岸斑点热群立克次体巢式PCR检测方法[S]. 北京: 中国标准出版社, 2017. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. SN/T 4611-2016 Nested PCR detecting method for spotted fever group rickettsiae at frontier port[S]. Beijing: Standards Press of China, 2017. (in Chinese) |
| [6] |
何涛君, 王琼, 何英, 等. 采用半巢式PCR技术从临床标本中克隆人类博卡病毒的全基因[J]. 国际检验医学杂志, 2014, 35(1): 3-5. He TJ, Wang Q, He Y et al. , Half nested PCR cloning human Bocavirus complete genome from clinical specimen[J]. Int J Lab Med, 2014, 35(1): 3-5. DOI:10.3969/j.issn.1673-4130.2014.01.002 |
| [7] |
Shih CM, Chao LL. Genetic analysis of the outer surface protein C gene of Lyme disease spirochaetes (Borrelia burgdorferi sensu lato) isolated from rodents in Taiwan[J]. J Med Microbiol, 2002, 51(4): 318-325. DOI:10.1099/0022-1317-51-4-318 |
| [8] |
中华人民共和国国家质量监督检验检疫总局. SN/T 3741.1―2013国境口岸鼠类携带病原体检测方法第1部分: 致病性钩端螺旋体PCR检测方法[S]. 北京: 中国标准出版社, 2014. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. SN∕T 3741.1-2013 Detection for pathogens of rodents at frontier ports-Part 1: Detection for pathogenic Leptospira[S]. Beijing: Standards Press of China, 2014. (in Chinese) |
| [9] |
Chu FK. Rapid and sensitive PCR-based detection and differentiation of aetiologic agents of human granulocytotropic and monocytotropic ehrlichiosis[J]. Mol Cell Probes, 1998, 12(2): 93-99. DOI:10.1006/mcpr.1998.0150 |
| [10] |
Lee JH, Park HS, Jong WJ, et al. Identification of the Coxiella sp. detected from Haemaphysalis longicornis ticks in Korea[J]. Microbiol Immunol, 2004, 48(2): 125-130. DOI:10.1111/j.1348-0421.2004.tb03498.x |
| [11] |
Regnery RL, Spruill CL, Plikaytis BD. Genotypic identification of rickettsiae and estimation of intraspecies sequence divergence for portions of two rickettsial genes[J]. J Bacteriol, 1991, 173(5): 1576-1589. DOI:10.1128/jb.173.5.1576-1589.1991 |
| [12] |
张倩, 刘运喜, 高媛, 等. 山东地区不同季节优势恙螨自然感染恙虫病东方体的分子流行病学调查[J]. 中华流行病学杂志, 2006, 27(7): 600-603. Zhang Q, Liu YX, Gao Y, et al. Study on the molecular epidemiology regarding the natural infection of Orientia tsutsugamushi in 4 species of dominant chiggers collected in various seasons from the foci of Shandong province[J]. Chin J Epidemiol, 2006, 27(7): 600-603. DOI:10.3760/j.issn:0254-6450.2006.07.012 |
| [13] |
鞠文东, 程成, 付维明, 等. 黑龙江口岸斑点热群立克次体调查研究[J]. 寄生虫与医学昆虫学报, 2015, 22(1): 37-43. Ju WD, Cheng C, Fu WM, et al. Investigation of spotted fever group Rickettsia in Heilongjiang Port[J]. Acta Parasitol Med Entomol Sin, 2015, 22(1): 37-43. DOI:10.3969/j.issn.1005-0507.2015.01.007 |
| [14] |
梁慧杰, 汪东伟, 王玉梅, 等. 黑龙江省边境口岸2019-2020年鼠形动物专项监测分析[J]. 中国口岸科学技术, 2021, 3(10): 23-29. Liang HJ, Wang DW, Wang YM, et al. Analysis of special surveillance on rodents at border ports in Heilongjiang province from 2019 to 2020[J]. China Port Sci Technol, 2021, 3(10): 23-29. DOI:10.3969/j.issn.1002-4689.2021.10.004 |
| [15] |
Zhan L, Cao WC, Chu CY, et al. Tick-borne agents in rodents, China, 2004-2006[J]. Emerg Infect Dis, 2009, 15(12): 1904-1908. DOI:10.3201/eid1512.081141 |
| [16] |
左双燕, 唐琨, 郑元春, 等. 黑龙江林区野鼠中斑点热群立克次体的核酸检测与序列分析[J]. 中南大学学报: 医学版, 2013, 38(5): 443-447. Zuo SY, Tang K, Zheng YC, et al. DNA detection and sequence analysis of spotted fever group rickettsiae in rodents from Heilongjiang forest region[J]. J Cent South Univ: Med Sci, 2013, 38(5): 443-447. DOI:10.3969/j.issn.1672-7347.2013.05.002 |
| [17] |
张健之, 范明远. 中国斑点热的研究成就[J]. 中华流行病学杂志, 1999, 20(2): 71-73. Zhang JZ, Fan MY. Research achievements of spotted fever in China[J]. Chin J Epidemiol, 1999, 20(2): 71-73. DOI:10.3760/j.issn:0254-6450.1999.02.002 |
| [18] |
曹晓梅, 胡孔新, 王静, 等. 中俄双边口岸鼠类及体表寄生虫调查[J]. 寄生虫与医学昆虫学报, 2011, 18(4): 230-235. Cao XM, Hu KX, Wang J, et al. A survey of rodent and rodent-borne ectozoa in ports between China and Russia[J]. Acta Parasitol Med Entomol Sin, 2011, 18(4): 230-235. DOI:10.3969/j.issn.1005-0507.2011.04.007 |
| [19] |
赵玉强, 程鹏, 公茂庆, 等. 鼠传播疾病及鼠类的防制概述[J]. 中国病原生物学杂志, 2010, 5(5): 378-380. Zhao YQ, Cheng P, Gong MQ, et al. Summary of mouse-spread diseases and measures to control them[J]. J Pathog Biol, 2010, 5(5): 378-380. DOI:10.13350/j.cjpb.2010.05.005 |
| [20] |
Gutiérrez R, Morick D, Cohen C, et al. The effect of ecological and temporal factors on the composition of Bartonella infection in rodents and their fleas[J]. ISME J, 2014, 8(8): 1598-1608. DOI:10.1038/ismej.2014.22 |
| [21] |
白瑛, Kosoy MY, Maupin GO, 等. 首次证实巴尔通体在我国云南鼠群中流行[J]. 中国人兽共患病杂志, 2002, 18(3): 5-9. Bai Y, Kosoy MY, Maupin GO, et al. Discovery of Bartonella species in rodents in Yunnan[J]. Chin J Zoonoses, 2002, 18(3): 5-9. DOI:10.3969/j.issn.1002-2694.2002.03.001 |
| [22] |
栗冬梅, 徐爱玲, 宋秀平, 等. 巴尔通体在自然感染的啮齿动物组织中的分布[J]. 中国媒介生物学及控制杂志, 2021, 32(2): 181-187. Li DM, Xu AL, Song XP, et al. Bartonella distribution in naturally infected rodent tissues[J]. Chin J Vector Biol Control, 2021, 32(2): 181-187. DOI:10.11853/j.issn.1003.8280.2021.02.012 |
| [23] |
俞丹, 尹家祥. 鼠形动物自然感染巴尔通体的研究进展[J]. 疾病监测, 2018, 33(1): 15-19. Yu D, Yin JX. Progress in research of natural infection status of Bartonella in rodents[J]. Dis Surveill, 2018, 33(1): 15-19. DOI:10.3784/j.issn.1003-9961.2018.01.005 |
 2023, Vol. 34
2023, Vol. 34


