扩展功能
文章信息
- 马婧, 陈开廷, 广慧, 赵文斌, 杨寅冉, 高金亮, 曹美娜
- MA Jing, CHEN Kai-ting, GUANG Hui, ZHAO Wen-bin, YANG Yin-ran, GAO Jin-liang, CAO Mei-na
- 青海血蜱Hq012基因在大肠埃希菌中的表达与纯化
- Expression and purification of Hq012 gene of Haemaphysalis qinghaiensis in Escherichia coli
- 中国媒介生物学及控制杂志, 2023, 34(6): 713-718
- Chin J Vector Biol & Control, 2023, 34(6): 713-718
- 10.11853/j.issn.1003.8280.2023.06.001
-
文章历史
- 收稿日期: 2023-04-12
2 鄂尔多斯市中心医院分子医学实验室, 内蒙古 鄂尔多斯 017000
2 Laboratory of Molecular Medicine, Ordos Central Hospital, Ordos, Inner Mongolia 017000, China
大肠埃希菌(Escherichia coli)是被广泛用于生产重组蛋白的宿主微生物[1-2]。然而,重组蛋白在大肠埃希菌中的高水平表达往往会导致表达的蛋白在体内聚集成包涵体,需要在体外变性和复性才能形成其天然蛋白构象[3-4]。包涵体的形成可能与诱导条件有关,如蛋白质合成过程中温度、时间和诱导剂的浓度。为了从包涵体中获得具有生物活性的重组蛋白,建立包涵体的纯化方法非常关键。通常会采用以下3个步骤:首先,从宿主细胞中分离出包涵体;其次,从包涵体中纯化目的蛋白;最后,将纯化的蛋白复性成具有生物活性的构象。然而,在大多数情况下溶解和复性会导致功能蛋白的回收率降低[5]。通常使用高浓度的变性剂如尿素和盐酸胍溶解包涵体,让包涵体蛋白质的二级结构完全变性[6]。复性是这些过程中最关键的步骤。将溶解的蛋白质直接稀释到复性缓冲液中可实现目的蛋白的小规模复性。然而,一些不稳定的重组蛋白在此过程中容易被降解。在这种情况下,通常采用另一种策略,即通过透析进行复性。这种策略通常会导致目的蛋白的聚集和回收率低[7]。为了提高复性的效率并减少聚集的发生,有时会在复性溶液中加入少量的还原剂、小分子聚合物、表面活性剂或分子伴侣等[5]。
蜱是动物和人类的重要体外寄生虫。除了动物因蜱叮咬生产力下降和皮肤损伤而导致畜牧业减产外,蜱还是各种病毒、原核生物和真核生物的重要传播媒介,可以引起人类和动物的疾病[8]。已知蜱类有3科:软蜱科、硬蜱科和纳蜱科。硬蜱的吸血时间需要几分钟到1周或更长的时间。在如此长的血液摄取时间内,宿主发展了广泛的机制来防止失血。而蜱的唾液腺会产生丰富的生物活性分子,这些生物活性分子具有强大的药理作用,可应对宿主的凝血、炎症、免疫等反应。例如,从肩突硬蜱(Ixodes scapularis)唾液腺中发现的Ixolaris[9]和卡宴花蜱(Amblyomma cajennense)的Amblyomin-X[10]都是凝血因子fⅩ的抑制剂。塞氏钝缘蜱(Ornithodoro savigni)的savigni和莫诺湖锐缘蜱(Argas monolakensis)的monobin[11]与毛白钝缘蜱(O. moubata)的ornithodorin相同,都是凝血酶fⅡ的抑制剂。青海血蜱(Haemaphysalis qinghaiensis)是中国西部高原地区特有的蜱种,国外无相关记录。青海血蜱属于硬蜱科,可传播3种泰勒虫病和1种巴贝斯虫病,严重威胁着我国畜牧业的健康发展。
在前期的研究中,从青海血蜱唾液腺cDNA表达文库中发现了1个全新的阳性克隆Hq012。本研究将Hq012的开放阅读框(ORF)插入原核表达载体pET-30a中,构建重组表达质粒pET30a-Hq012,将重组表达质粒转入大肠埃希菌感受态细胞E. coli Rosetta(DE3)中,异丙基硫代-β-D-半乳糖苷(IPTG)诱导表达重组Hq012蛋白(rHq012)。由于产生的rHq012以包涵体形式存在,本研究尝试从包涵体中纯化出可溶性重组蛋白。
1 材料与方法 1.1 菌株和质粒基因Hq012由鄂尔多斯市中心医院分子医学实验室从青海血蜱的cDNA表达库中发现。质粒pET-30a(+)购自Novagen公司;DE3购自上海唯地生物技术有限公司。
1.2 主要试剂IPTG和硫酸卡那霉素(Kan+)购自生工生物工程(上海)股份有限公司,彩虹180广谱蛋白分子标记(11-180KD)购自北京索莱宝科技有限公司,其他常用试剂均为国产分析纯试剂,蛋白纯化树脂Ni-NTA Agarose购自Invitrogen公司(美国)。
1.3 序列分析和体外表达采用DNASTAR(lasergene software package for Windows,DNASTAR,Madison,WI)进行序列分析。利用美国国立生物技术信息中心(NCBI)基于局部比对算法的搜索工具(BLAST)在线分析软件(http://blast.ncbi.nlm.nih.gov/Blast.cgi)分析核苷酸序列及其推断的氨基酸序列与GenBank中先前报道的序列的相似性。使用SignalP 5.0(http://www.cbs.dtu.dk/services/SignalP/)预测潜在的信号肽序列(SignalP)。根据Hq012序列信息,设计了1对PCR引物Hq012F(5'-GCCATATGGAAAGAAATCATCGAATGA-3')和Hq012R(5'-TACTCGAGACACCCACGTTTGGT-3')来扩增Hq012的蛋白编码区。引物序列中下划线部分为引入的Nde Ⅰ和Xho Ⅰ酶切位点。以cDNA文库中获得的阳性克隆Hq012为模板,用所设计的引物进行PCR扩增获得PCR产物,将此PCR产物纯化后克隆到pGEM-T-easy载体(Promega公司),构建重组克隆质粒pGEM-T-easy-Hq012。用Nde Ⅰ和Xho Ⅰ双酶切重组质粒pGEM-T-easy-Hq012获得插入片段,将插入片段与经Nde Ⅰ和Xho Ⅰ双酶切线性化的pET30a连接,构建原核表达质粒pET30a-Hq012。将此质粒送北京六合华大基因科技有限公司进行序列测定。将经测序验证的质粒转化到DE3,挑取单菌落接种至5 ml LB培养液(含50 μg/ml Kan+)中,37 ℃、200 r/min振摇培养过夜。在还原条件下,用12%的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)检测表达的产物。
1.4 rHq012表达条件优化 1.4.1 诱导剂浓度取1 ml培养物转接入100 ml 2×YT培养液(含50 μg/ml Kan+)中,37 ℃、200 r/min振摇培养至菌液吸光度(A)值A600达0.8~1.0时,分别加入0、0.1、0.5、1.0、2.0和3.0 mmol/L IPTG,25 ℃诱导8 h。各取2 ml菌液制备蛋白样品,进行12% SDS-PAGE鉴定,确定最佳诱导剂浓度。
1.4.2 诱导温度加入IPTG浓度为0.1 mmol/L,分别于25、28和31 ℃诱导8 h。其他同1.4.1,确定最佳诱导温度。
1.4.3 诱导时间加入IPTG浓度为0.1 mmol/L,28 ℃分别诱导5、6、7和8 h。其他同1.4.1,确定最佳诱导时间。
1.5 包涵体分离和溶解将最佳诱导条件下诱导的培养物5 500×g离心10 min;收集沉淀,重悬于50 ml磷酸盐缓冲液(PBS)中,在高压均质机上进行均质,将均质液9 500×g离心20 min,弃上清收集沉淀。将收集的沉淀重悬于5 ml变性溶液(6 mol/L盐酸胍,50 mmol/L Tris,500 mmol/L NaCl,pH 7.4)中,放置室温振摇过夜,9 500×g离心10 min,收集上清。
1.6 目的蛋白的先复性后纯化在这种纯化方法中,目的蛋白首先被复性然后再进行纯化。将蛋白变性溶解液用0.45 μm过滤器过滤后,逐滴加至复性缓冲液(50 mmol/L Tris,500 mmol/L NaCl,50 mmol/L咪唑,5%甘油和1% Tween-20,pH 7.4)中,期间不断搅拌,直到出现不溶性颗粒。用0.45 μm过滤器过滤复性的蛋白质,并收集滤液。用平衡缓冲液(50 mmol/L Tris,500 mmol/L NaCl和50 mmol/L咪唑,pH 7.4)平衡Ni-NTA亲和层析柱。将复性的蛋白质通过Ni-NTA亲和层析柱,用5倍柱床体积的冲洗缓冲液(50 mmol/L Tris,500 mmol/L NaCl和100 mmol/L咪唑,pH 7.4)洗涤柱后,用洗脱缓冲液(50 mmol/L Tris,500 mmol/L NaCl和300 mmol/L咪唑,pH 7.4)将目的蛋白从柱上洗出。为了获得最佳纯化条件,对纯化过程中使用的所有缓冲液的pH值、离子强度和咪唑的浓度逐一进行优化。纯化后的蛋白在5 500×g离心10 min,收集上清液,用12% SDS-PAGE鉴定。
1.7 目的蛋白的先纯化后复性在这种纯化方法中,目的蛋白首先被纯化,然后再复性。预先用平衡缓冲液(8 mmol/L尿素,50 mmol/L Tris,500 mmol/L NaCl和50 mmol/L咪唑,pH 7.4)平衡Ni-NTA亲和层析柱。将蛋白变性溶解液慢慢通过Ni-NTA亲和层析柱,用5倍柱床体积的冲洗缓冲液(8 mmol/L尿素,50 mmol/L Tris,500 mmol/L NaCl和100 mmol/L咪唑,pH 7.4)洗涤后,用洗脱缓冲液(8 mmol/L尿素,50 mmol/L Tris,500 mmol/L NaCl和300 mmol/L咪唑,pH 7.4)将目的蛋白从柱上洗出。该纯化过程中使用的所有缓冲液的pH值、离子强度和咪唑的浓度逐一进行优化。此外,为了复性重组蛋白,将洗脱的目的蛋白在含有50 mmol/L Tris、500 mmol/L NaCl、pH为7.4、浓度为0.1~0.5 g/L的L-精氨酸透析缓冲液中透析过夜。
2 结果 2.1 序列分析和原核表达Hq012的序列长度为759 bp(GenBank登录号MN306334),其羧基端含有1个polyA尾巴。第98~583位核苷酸为1个486 bp的完整开放阅读框架(ORF),编码的蛋白质序列长度为161 aa,预测的目标蛋白相对分子质量和等电点(isoelectric point,pI)分别为18 500和8.9(图 1)。通过软件SignalP 5.0A Server分析,第1~18号氨基酸为信号肽序列。BLAST分析显示为新的蛋白质。

|
| 注:黑色框内氨基酸为信息肽。 图 1 青海血蜱Hq012基因的cDNA序列和其推断的氨基酸序列 Figure 1 cDNA sequence and inferred amino acid sequence of Hq012 gene of Haemaphysalis qinghaiensis |
| |
SDS-PAGE显示,一个相对分子质量约为17 000的重组蛋白在大肠埃希菌中成功表达,此相对分子质量与去掉信号肽序列加入6个组氨酸尾巴的重组蛋白相对分子质量一致。见图 2。

|
| 注:泳道1蛋白质marker;2 pET30a载体转化的大肠埃希菌Rosetta(DE3)的裂解液;3用pET30a-Hq012转化的大肠埃希菌感受态细胞Rosetta(DE3)的裂解液;4细菌裂解液沉淀;5细菌裂解液上清;Mr相对分子质量。 图 2 大肠埃希菌中表达的青海血蜱重组Hq012蛋白的十二烷基硫酸钠聚丙烯酰胺凝胶电泳分析 Figure 2 SDS-PAGE analysis of recombinant Hq012 protein of Haemaphysalis qinghaiensis expressed in Escherichia coli |
| |
SDS-PAGE结果显示,诱导温度为31 ℃时获得的目的蛋白表达量最高。结合温度对包涵体质量的影响,为了在接下来的步骤中更有效地复性包涵体,选择28 ℃作为诱导温度。IPTG的终浓度从0.1~3.0 mmol/L对rHq012的表达影响差异不大。当IPTG的终浓度为0.1 mmol/L,诱导8 h后,表达的蛋白量最高。因此,选择28 ℃、0.1 mmol/L IPTG下诱导8 h作为rHq012的最佳诱导条件。见图 3。
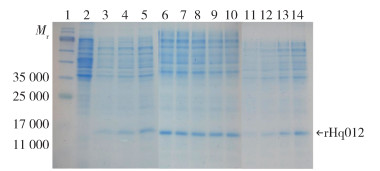
|
| 注:泳道1蛋白质marker;2 pET30a载体转化的大肠埃希菌Rosetta(DE3)的裂解液;3~5分别于25、28和31 ℃诱导的rHq012的裂解液;6~10分别为IPTG浓度为0.1、0.5、1.0、2.0和3.0 mmol/L诱导的rHq012;11~14分别为诱导时间为5、6、7和8 h诱导的重组Hq012;Mr相对分子质量。 图 3 不同条件下大肠埃希菌Rosetta(DE3)中青海血蜱重组Hq012蛋白的表达情况 Figure 3 Expression of recombinant Hq012 protein of Haemaphysalis qinghaiensis in Escherichia coli Rosetta (DE3) under different conditions |
| |
在通过Ni-NTA亲和层析柱之前,将溶解的包涵体复性。如图 4A所示,与pH 6.8和pH 8.0的缓冲液相比,pH 7.4的缓冲液可以获得最大数量的纯化的目的蛋白。缓冲液最佳的离子强度是500 mmol/L NaCl(图 4B)。经过对平衡缓冲液中咪唑的浓度进行筛选,结果显示50 mmol/L的咪唑可以获得纯度较高的目的蛋白,而且在上样过程中不会丢失目的蛋白(数据未显示)。当冲洗缓冲液中的咪唑浓度达到100 mmol/L时,获得了较高纯度的目的蛋白(图 4C)。纯化体系包括:含有50 mmol/L咪唑的平衡缓冲液(50 mmol/L Tris和500 mmol/L NaCl,pH 7.4),含有100 mmol/L咪唑的冲洗缓冲液(50 mmol/L Tris和500 mmol/L NaCl,pH 7.4)和含有300 mmol/L咪唑的洗脱缓冲液。

|
| 注:A不同pH值缓冲液中获得的上样流过、冲洗的杂蛋白以及洗脱缓冲液中获得目的蛋白电泳图,其中泳道1为蛋白质marker,2~4为pH 6.8条件下,5~7为在pH 7.4条件下,8~10为在pH 8.0条件下;B不同NaCl浓度缓冲液中获得的上样流过、冲洗的杂蛋白和洗脱的目的蛋白电泳图,其中泳道1为蛋白质marker,2~4为在含有300 mmol/L NaCl条件下,5~7为在400 mmol/L NaCl条件下,8~10为在500 mmol/L NaCl条件下;C不同咪唑浓度缓冲液中获得的上样流出、冲洗的杂蛋白和洗脱的目的蛋白质电泳图,其中泳道1为蛋白质marker;2~4为在80 mmol/L咪唑条件下,5~7为在90 mmol/L咪唑条件下,8~10为在100 mmol/L咪唑条件下;Mr相对分子质量。 图 4 先复性后纯化策略下青海血蜱重组Hq012蛋白表达的十二烷基硫酸钠聚丙烯酰胺凝胶电泳分析 Figure 4 SDS-PAGE analysis of recombinant Hq012 protein of Haemaphysalis qinghaiensis obtained by first renaturation and then purification |
| |
将纯化的目的蛋白通过一系列尿素稀释透析对目的蛋白进行复性,SDS-PAGE显示,用含有0.5 g/L L-精氨酸的透析缓冲液可以得到具有少量杂质的可溶性目的蛋白。见图 5。

|
| 注:泳道1蛋白质marker;2从Ni-NTA亲和层析柱洗脱的rHq012;3~5分别在含有0.10、0.25和0.50 g/L L-精氨酸的缓冲液中透析的可溶性重组Hq012;Mr相对分子质量。 图 5 先纯化后复性策略下青海血蜱重组Hq012蛋白表达的十二烷基硫酸钠聚丙烯酰胺凝胶电泳分析 Figure 5 SDS-PAGE analysis of recombinant Hq012 protein of Haemaphysalis qinghaiensis obtained by first purification and then renaturation |
| |
将Hq012编码的氨基酸序列进行BLAST比对分析,结果显示Hq012的氨基酸序列与长角血蜱(H. longicornis)的一个预测蛋白(登录号为BAE02650.1)的同源性为30%,在GenBank中未找到其他与其相似的蛋白序列,提示Hq012为一个全新的蛋白编码基因。大肠埃希菌表达系统已被广泛用于生产不需要翻译后修饰的重组蛋白[12]。然而,在大肠埃希菌中高浓度表达的重组蛋白经常会以不溶性包涵体的形式积累,没有生物活性。包涵体的质量受表达条件如诱导温度和诱导时间等影响。通常情况下,低温有助于形成松软的、非经典的包涵体,这种包涵体更容易被重新折叠[13]。因此,尽管在31 ℃下rHq012表达了更多的目的蛋白,但我们选择在28 ℃的较低温度下诱导目的蛋白表达。随着诱导时间的延长,rHq012的表达量增加,并在8 h内达到峰值。
据报道,细胞破裂方法的选择对包涵体的质量有很大影响。从细菌中分离包涵体的方法包括超声波破碎法、法式高压机械均质法和使用溶菌酶裂解法等。与机械方法相比,用溶菌酶裂解细胞的效果更好[14]。也有报道在细菌的破裂过程中,将机械和溶菌酶细胞破裂技术相结合[15]。本研究中,用均质机来破裂细胞,得到了带有一些杂质的包涵体。尽管本研究试图在机械破裂过程中加入溶菌酶,但结果显示溶菌酶未能提高目的蛋白的收获率。
用高盐离子的溶液变性溶解蛋白,利于氨基酸链的打开,去除盐离子后,氨基酸链可能重新折叠成自然结构,形成具有生物活性的蛋白质。通常使用6 mol/L的盐酸胍或8 mol/L的尿素来变性和溶解包涵体,但盐酸胍溶液的变性能力要强于尿素溶液。因此,本研究选择用6 mol/L的盐酸胍来溶解包涵体。在复性缓冲液中稀释和透析变性蛋白质是最常用的回收功能活性蛋白的方法[16-17]。有机溶剂对蛋白质结构的影响早已被研究过[18-19]。一般来说,甲醇、乙醇和三氟乙醇(TFE)等醇类可以稳定蛋白质的二级结构,特别是螺旋结构。有机溶剂对蛋白质三级结构的影响更为普遍,大多数溶剂可以破坏三级结构的稳定性[20-21]。有机溶剂影响蛋白质二级和三级结构的机制是溶剂可以增加多肽的分子内氢键,破坏疏水相互作用或与水分子相互作用并影响其氢键电位[22]。在本研究中,直接将变性蛋白溶解液逐滴加入大体积复性缓冲液中,重新折叠得到可溶性蛋白。加入甘油和Tween-20可促进蛋白质的复性。即使在去除变性缓冲液后也能得到可溶性蛋白质。这表明重组蛋白在大肠埃希菌的诱导过程中可能形成了正确的二级结构,而形成包涵体可能是由于蛋白过度表达而引起的分子间聚集。本研究结果表明,蛋白质浓度也影响到目的蛋白的复性效果。如果目的蛋白和杂质蛋白浓度过高,在折叠过程中蛋白分子之间就更容易发生聚集。由于折叠过程中缺乏空间,蛋白质的错误折叠将最终导致复性失败。
大多数研究都采用了先纯化后复性的方式来纯化包涵体蛋白。在这种方法中,包涵体溶解后,在变性条件下纯化,然后再进行复性[23]。纯化后,可以去除蛋白质溶液中的杂质。去除杂质可以减少它们对蛋白质复性的干扰,避免蛋白质的不可逆聚集。根据Batista等[24]的研究,本研究成功地通过先复性蛋白然后纯化的方式获得了可溶的并稳定存在的目的蛋白。在去除变性剂后,通过镍柱亲和色谱法对重组蛋白进行纯化和浓缩,得到了高纯度的可溶性蛋白。本研究结果还表明,目的蛋白在其复性过程中应保持低浓度和温和的条件,这可能与该蛋白的特性有关。在本研究中,虽然2种方法都能获得可溶性目的蛋白,但先复性后纯化法能收获更纯的rHq012,杂质更少,回收率更高(约30%),而纯化后复性法的目的蛋白回收率只有10%左右。
蛋白质的复性和纯化无固定的方法。由于特定蛋白质的特性不同,纯化和复性的方式也各不相同。应根据不同的重组蛋白及其包涵体的特性来筛选溶液系统和复性方法。最后,溶解度是判断蛋白质是否成功复性的基本标准。但即使如此,也必须注意并非所有复性的可溶性蛋白都能恢复其自然状态。为此,应进行一系列的功能测试,或确定蛋白质的晶体结构。
利益冲突 无
| [1] |
Jia BL, Jeon CO. High-throughput recombinant protein expression in Escherichia coli: Current status and future perspectives[J]. Open Biol, 2016, 6(8): 160196. DOI:10.1098/rsob.160196 |
| [2] |
Rosano GL, Ceccarelli EA. Recombinant protein expression in Escherichia coli: Advances and challenges[J]. Front Microbiol, 2014, 5: 172. DOI:10.3389/fmicb.2014.00172 |
| [3] |
Hashemzadeh MS, Mohammadi M, Ghaleh HEG, et al. Expression, solubilization, refolding and final purification of recombinant proteins as expressed in the form of "classical inclusion bodies" in E. coli[J]. Prot Pept Lett, 2021, 28(2): 122-130. DOI:10.2174/0929866527999200729182831 |
| [4] |
Lipničanová S, Chmelová D, Godány A, et al. Purification of viral neuraminidase from inclusion bodies produced by recombinant Escherichia coli[J]. J Biotechnol, 2020, 316: 27-34. DOI:10.1016/j.jbiotec.2020.04.005 |
| [5] |
Singh A, Upadhyay V, Upadhyay AK, et al. Protein recovery from inclusion bodies of Escherichia coli using mild solubilization process[J]. Microb Cell Fact, 2015, 14: 41. DOI:10.1186/s12934-015-0222-8 |
| [6] |
Maksum IP, Yosua Y, Nabiel A, et al. Refolding of bioactive human epidermal growth factor from E. coli BL21(DE3) inclusion bodies & evaluations on its in vitro & in vivo bioactivity[J]. Heliyon, 2022, 8(4): e09306. DOI:10.1016/j.heliyon.2022.e09306 |
| [7] |
Singh SM, Panda AK. Solubilization and refolding of bacterial inclusion body proteins[J]. J Biosci Bioeng, 2005, 99(4): 303-310. DOI:10.1263/jbb.99.303 |
| [8] |
Batista IFC, Chudzinski-Tavassi AM, Faria F, et al. Expressed sequence tags (ESTs) from the salivary glands of the tick Amblyomma cajennense (Acari: Ixodidae)[J]. Toxicon, 2008, 51(5): 823-834. DOI:10.1016/j.toxicon.2007.12.011 |
| [9] |
Francischetti IMB, Mather TN, Ribeiro JMC. Penthalaris, a novel recombinant five-Kunitz tissue factor pathway inhibitor (TFPI) from the salivary gland of the tick vector of Lyme disease, Ixodes scapularis[J]. Thromb Haemost, 2004, 91(5): 886-898. DOI:10.1160/TH03-11-0715 |
| [10] |
Mast AE. Tissue factor pathway inhibitor: Multiple anticoagulant activities for a single protein[J]. Arterioscler Thromb Vasc Biol, 2016, 36(1): 9-14. DOI:10.1161/ATVBAHA.115.305996 |
| [11] |
Kim TK, Tirloni L, Radulovic Z, et al. Conserved Amblyomma americanum tick Serpin19, an inhibitor of blood clotting factors Ⅹa and Ⅺa, trypsin and plasmin, has anti-haemostatic functions[J]. Int J Parasitol, 2015, 45(9/10): 613-627. DOI:10.1016/j.ijpara.2015.03.009 |
| [12] |
Jugniot N, Bam R, Paulmurugan R. Expression and purification of a native Thy1-single-chain variable fragment for use in molecular imaging[J]. Sci Rep, 2021, 11(1): 23026. DOI:10.1038/s41598-021-02445-2 |
| [13] |
Markova SV, Larionova MD, Gorbunova DA, et al. The disulfide-rich Metridia luciferase refolded from E. coli inclusion bodies reveals the properties of a native folded enzyme produced in insect cells[J]. J Photochem Photobiol B: Biol, 2017, 175: 51-57. DOI:10.1016/j.jphotobiol.2017.08.024 |
| [14] |
Haddad L, Babaeipour V, Mofid MR. The effect of cell disruption techniques and chaotropic agents on the downstream purification process of mecasermin produced as inclusion body in E. coli[J]. Res Pharm Sci, 2015, 10(6): 553-561. |
| [15] |
Upadhyay AK, Murmu A, Singh A, et al. Kinetics of inclusion body formation and its correlation with the characteristics of protein aggregates in Escherichia coli[J]. PLoS One, 2012, 7(3): e33951. DOI:10.1371/journal.pone.0033951 |
| [16] |
Fazeli MR, Hezarjaribi N. A simplified process for purification and refolding of recombinant human interferon-α2b[J]. Iran Biomed J, 2022, 26(1): 85-90. DOI:10.52547/ibj.26.1.85 |
| [17] |
Oyeleye AO, Mohd Yusoff SF, Abd Rahim IN, et al. Effective refolding of a cysteine rich glycoside hydrolase family 19 recombinant chitinase from Streptomyces griseus by reverse dilution and affinity chromatography[J]. PLoS One, 2020, 15(10): e0241074. DOI:10.1371/journal.pone.0241074 |
| [18] |
Shendge AA, D'Souza JS. Strategic optimization of conditions for the solubilization of GST-tagged amphipathic helix-containing ciliary proteins overexpressed as inclusion bodies in E. coli[J]. Microb Cell Fact, 2022, 21(1): 258. DOI:10.1186/s12934-022-01979-y |
| [19] |
Nekoufar S, Fazeli A, Fazeli MR. Solubilization of human interferon β-1b inclusion body proteins by organic solvents[J]. Adv Pharm Bull, 2020, 10(2): 233-238. DOI:10.34172/apb.2020.027 |
| [20] |
Buck M, Radford SE, Dobson CM. A partially folded state of hen egg white lysozyme in trifluoroethanol: Structural characterization and implications for protein folding[J]. Biochemistry, 1993, 32(2): 669-678. DOI:10.1021/bi00053a036 |
| [21] |
Winkler J, Seybert A, König L, et al. Quantitative and spatio-temporal features of protein aggregation in Escherichia coli and consequences on protein quality control and cellular ageing[J]. EMBO J, 2010, 29(5): 910-923. DOI:10.1038/emboj.2009.412 |
| [22] |
Shiratori T, Goto S, Sakaguchi T, et al. Singular value decomposition analysis of the secondary structure features contributing to the circular dichroism spectra of model proteins[J]. Biochem Biophys Rep, 2021, 28: 101153. DOI:10.1016/j.bbrep.2021.101153 |
| [23] |
Plucinsky SM, Root KT, Glover KJ. Efficient solubilization and purification of highly insoluble membrane proteins expressed as inclusion bodies using perfluorooctanoic acid[J]. Protein Expr Purif, 2018, 143: 34-37. DOI:10.1016/j.pep.2017.10.012 |
| [24] |
Batista IFC, Ramos OHP, Ventura JS, et al. A new Factor Xa inhibitor from Amblyomma cajennense with a unique domain composition[J]. Arch Biochem Biophys, 2010, 493(2): 151-156. DOI:10.1016/j.abb.2009.10.009 |
 2023, Vol. 34
2023, Vol. 34


