扩展功能
文章信息
- 陈劲华, 骆淑英, 刘营, 凌锋, 孙继民
- CHEN Jin-hua, LUO Shu-ying, LIU Ying, LING Feng, SUN Ji-min
- 登革病毒感染12年后抗体阳性情况调查
- Seroprevalence of dengue-specific IgG antibodies 12 years after Dengue virus infection
- 中国媒介生物学及控制杂志, 2023, 34(5): 679-681, 702
- Chin J Vector Biol & Control, 2023, 34(5): 679-681, 702
- 10.11853/j.issn.1003.8280.2023.05.016
-
文章历史
- 收稿日期: 2023-02-16
2 义乌市疾病预防控制中心免疫科, 浙江 义乌 322000
2 Department for Immunization Planning and Related Disease Prevention and Control, Yiwu Center for Disease Control and Prevention, Yiwu, Zhejiang 322000, China
登革热(dengue fever,DF)是由登革病毒(Dengue virus,DENV)感染引起的急性蚊媒传染病,主要传播媒介为埃及伊蚊(Aedes aegypti)和白纹伊蚊(Ae. albopictus),临床症状主要包括发热、头痛、肌肉酸痛、骨关节痛、眼眶痛、颜面或颈胸部皮肤潮红、结膜充血等,严重者可发生登革出血热、登革休克综合征甚至死亡[1]。Bhatt等研究结果显示,全球每年有25亿~40亿人口有登革病毒感染风险,每年约有3.9亿登革病毒感染者,其中9 600万例登革热病例,约2.5万例登革热死亡病例[2-4]。2019年,我国大陆地区登革热疫情形势非常严峻,28个省(直辖市、自治区)共报告22 599例登革热病例,其中13个省(直辖市、自治区)发生了本地传播疫情,是建国以来登革热本地传播流行波及范围最广的年份[5]。
浙江省位于中国东南沿海,气候条件适宜白纹伊蚊生长繁殖,而且浙江省对外经贸和旅游发达,近年登革热疫情不断发生,2015-2019年浙江省共报告2 532例登革热病例,其中961例输入病例,1 571例本地病例[6-7]。义乌市位于浙江省中部,有国际著名的小商品城,人员往来频繁,登革热病例输入风险很高,2009年,义乌市发生了一起由登革病毒Ⅲ型引发的本地暴发疫情[8]。登革病毒有4个血清型,不同血清型之间不但无交叉保护作用,还会发生抗体依赖的病毒感染增强作用,即初次感染登革病毒后机体可产生该血清型的IgG抗体,当再次感染其他血清型登革病毒时,会促进病毒在细胞内增生和复制,从而导致重症登革热的发生[9-12]。因此,了解登革病毒抗体的持续时间,对于评估重症登革热的发生风险至关重要。为了解登革病毒感染12年后,登革病毒抗体的持续时间及影响因素,本研究在2021年10月对2009年义乌市登革热暴发期间的既往感染者进行了血清流行病学调查。
1 材料与方法 1.1 调查对象2009年浙江省义乌市登革热暴发疫情中的确诊病例、临床诊断病例和无症状感染者;确诊病例和临床诊断病例按照《登革热诊断标准》(WS 216-2008)进行诊断,无症状感染者为2009年义乌市登革热暴发期间疫点人群中在疫情发生期间无登革热临床表现但登革病毒IgM抗体阳性者。
1.2 标本采集调查对象知情同意后,于2021年10月采集相关人员的血清标本,每名调查对象采集非抗凝血5 ml,分离血清,-80 ℃保存。同时,收集调查对象的姓名、性别、年龄、住址、联系方式等个人信息以及2009-2021年10月期间是否再次感染登革热。伦理审批号:浙江省疾病预防控制中心伦理委员会2020-021。
1.3 检测方法采用登革热IgG间接酶联免疫吸附试验(ELISA)试剂盒(Panbio,澳大利亚)检测血清标本中登革病毒IgG抗体,按照试剂盒说明书进行操作。结果判读:Panbio units > 11为阳性,< 9为阴性,9~11进行重复实验。
1.4 统计学分析采用Excel 2020软件建立数据库,用R 4.2.1软件进行统计学分析。采用卡方检验分析不同特征调查对象血清阳性率差异,P < 0.05为差异有统计学意义。以登革病毒IgG抗体是否阳性作为因变量,以性别、年龄组、感染者类型为自变量,采用logistic回归多因素分析,分析抗体阳性的相关影响因素。
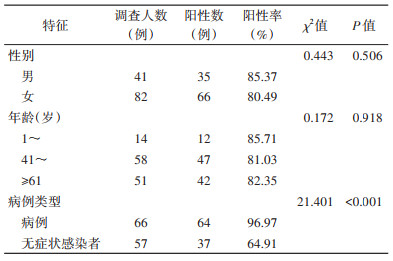
2 结果 2.1 基本情况共采集登革病毒既往感染者血清标本123份,其中57份来自2009年登革热暴发时的无症状感染者,66份来自登革热病例。采集对象中男性41例,女性82例;2009年感染登革病毒时1~岁年龄组的14例,41~岁年龄组的58例,≥61岁的51例。见表 1。
|
123份标本中,IgG抗体阳性率为82.11%(101/123)。其中男性感染者阳性率为85.37%,女性为80.49%,不同性别感染者的阳性率差异无统计学意义(χ2=0.443,P=0.506)。感染者登革病毒IgG抗体阳性率1~岁年龄组为85.71%,41~岁年龄组为81.03%,≥61岁为82.35%,不同年龄组感染者的阳性率差异无统计学意义(χ2=0.172,P=0.918)。登革热病例IgG抗体阳性率为96.97%,无症状感染者为64.91%,来自病例和无症状感染者的IgG抗体阳性率差异有统计学意义(χ2=21.401,P < 0.001)。见表 1。
2.3 多因素分析多因素分析结果显示,登革病毒感染者进入最后的logistic回归方程,相对于无症状感染者,登革热病例抗体阳性的比值比(OR)为17.30(95%置信区间:3.83~78.21)。
3 讨论病毒感染后,一般都会产生抗体,但不同病毒感染后抗体持续时间不同,有的可持续数十年,有的只能持续几个月。Imrie等[13]报道7例60年前感染登革病毒Ⅰ型的病例中4例登革病毒IgG抗体阳性;Ngwe等[14]报道日本长崎1例70年前感染过登革病毒Ⅱ型的病例登革病毒中和抗体仍然阳性。吴琦琳[15]对广州市70例预后2年的登革病毒既往感染者的抗体阳性情况进行调查,发现登革病毒IgG抗体阳性率为100%;对70例预后5年的登革病毒既往感染者的抗体阳性情况进行调查,发现登革病毒IgG抗体阳性率为95.71%(67/70)。Ma等[16]对云南省景洪市登革病毒既往感染者抗体持续情况进行调查,分别于2017和2019年采集了191例感染后4年和99例感染后6年的病例标本,结果显示其抗体阳性率分别为98.40%和82.80%。本研究团队基于2009年浙江省义乌市登革热暴发时的感染者,分别于感染后3和9年采集2009年感染者血清,发现感染3年后,2009年病例的登革病毒IgG抗体阳性率可达96.61%[17];感染9年后,病例的IgG抗体阳性率仍可达到89.11%[18]。
本次调查结果显示12年后既往感染者IgG抗体平均阳性率达到82.11%,尤其是病例的登革病毒IgG抗体阳性率为96.97%,提示登革病毒抗体持续时间较长。但本次调查的阳性率超过了感染后3和9年的抗体阳性率,经分析发现这主要是由于每次调查中病例和无症状感染者的比例以及采样对象不同所导致。2009年义乌市登革热疫情暴发时,我们对当时无临床症状的居民采集血清,发现27.95%的居民登革病毒IgM抗体阳性[19],定义为无症状感染者。此后在不同年份随机抽取病例和无症状感染者检测抗体阳性情况,不同年份采样对象存在差异,我们详细比较了2012和2021年采样的调查对象,2次采样的无症状感染者分别为48和57例,仅有16例2次均采样。此外,样本保存、实验室检测和质控等也可能会导致异常结果,2次检测的试剂虽然是同一厂家,但批号不同,其灵敏度和特异度可能存在差异。
综上所述,本研究发现登革病毒感染12年后无论是病例还是无症状感染者,抗体均广泛存在,而且病例的IgG抗体阳性率显著高于无症状感染者。登革病毒抗体的长期存在虽然可以对同血清型登革病毒有免疫保护作用,但一旦感染另外3个血清型的登革病毒后症状会加重,可能会发生重症病例[9-12]。特别是2023年随着我国入境政策的调整,输入登革病毒感染者和发生本地疫情的风险可能会大幅增加,登革病毒既往感染者再次感染登革病毒的风险也会持续存在,在登革热防控中,要加强对既往感染者的重视,尤其是一旦发现既往感染者再次感染登革病毒,要严防重症病例的发生。
利益冲突 无
| [1] |
World Health Organization. Dengue guidelines, for diagnosis, treatment, prevention and control[R]. Geneva: World Health Organization, 2009: 14.
|
| [2] |
Bhatt S, Gething PW, Brady OJ, et al. The global distribution and burden of dengue[J]. Nature, 2013, 496(7446): 504-507. DOI:10.1038/nature12060 |
| [3] |
World Health Organization. Dengue and severe dengue[EB/OL]. (2023-03-17)[2023-03-17]. https://www.who.int/news-room/fact-sheets/detail/dengue-and-severe-dengue.
|
| [4] |
Brady OJ, Gething PW, Bhatt S, et al. Refining the global spatial limits of Dengue virus transmission by evidence-based consensus[J]. PLoS Negl Trop Dis, 2012, 6(8): e1760. DOI:10.1371/journal.pntd.0001760 |
| [5] |
刘起勇. 我国登革热流行新趋势、防控挑战及策略分析[J]. 中国媒介生物学及控制杂志, 2020, 31(1): 1-6. Liu QY. Dengue fever in China: New epidemical trend, challenges and strategies for prevention and control[J]. Chin J Vector Biol Control, 2020, 31(1): 1-6. DOI:10.11853/j.issn.1003.8280.2020.01.001 |
| [6] |
王桢, 凌锋, 刘营, 等. 浙江省2015-2019年登革热流行特征分析[J]. 中国媒介生物学及控制杂志, 2020, 31(6): 643-647. Wang Z, Ling F, Liu Y, et al. Epidemiological characteristics of dengue fever in Zhejiang province, China, 2015-2019[J]. Chin J Vector Biol Control, 2020, 31(6): 643-647. DOI:10.11853/j.issn.1003.8280.2020.06.003 |
| [7] |
Ren JP, Chen ZP, Ling F, et al. Epidemiology of indigenous dengue cases in Zhejiang province, Southeast China[J]. Front Public Health, 2022, 10: 857911. DOI:10.3389/fpubh.2022.857911 |
| [8] |
Sun JM, Lin JF, Yan JY, et al. Dengue virus serotype 3 subtype Ⅲ, Zhejiang province, China[J]. Emerg Infect Dis, 2011, 17(2): 321-323. DOI:10.3201/eid1702.100396 |
| [9] |
Lau L, Green AM, Balmaseda A, et al. Antibody avidity following secondary Dengue virus type 2 infection across a range of disease severity[J]. J Clin Virol, 2015, 69: 63-67. DOI:10.1016/j.jcv.2015.06.003 |
| [10] |
Dejnirattisai W, Jumnainsong A, Onsirisakul N, et al. Cross-reacting antibodies enhance Dengue virus infection in humans[J]. Science, 2010, 328(5979): 745-748. DOI:10.1126/science.1185181 |
| [11] |
de Alwis R, Williams KL, Schmid MA, et al. Dengue viruses are enhanced by distinct populations of serotype cross-reactive antibodies in human immune sera[J]. PLoS Pathog, 2014, 10(10): e1004386. DOI:10.1371/journal.ppat.1004386 |
| [12] |
Guzman MG, Alvarez M, Halstead SB. Secondary infection as a risk factor for dengue hemorrhagic fever/dengue shock syndrome: An historical perspective and role of antibody-dependent enhancement of infection[J]. Arch Virol, 2013, 158(7): 1445-1459. DOI:10.1007/s00705-013-1645-3 |
| [13] |
Imrie A, Meeks J, Gurary A, et al. Antibody to Dengue 1 detected more than 60 years after infection[J]. Viral Immunol, 2007, 20(4): 672-675. DOI:10.1089/vim.2007.0050 |
| [14] |
Ngwe Tun MM, Muta Y, Inoue S, et al. Persistence of neutralizing antibody against Dengue virus 2 after 70 years from infection in Nagasaki[J]. Biores Open Access, 2016, 5(1): 188-191. DOI:10.1089/biores.2016.0016 |
| [15] |
吴琦琳. 登革热病例抗体动力学及广州市健康人群登革热抗体水平分析[D]. 广州: 广东药科大学, 2020. Wu QL. Kinetics of antibodies in patients with dengue and analysis of dengue antibody levels in healthy population in Guangzhou[D]. Guangzhou: Guangdong Pharmaceutical University, 2020. (in Chinese) |
| [16] |
Ma YS, Li M, Xie L, et al. Seroepidemiologic study on convalescent sera from dengue fever patients in Jinghong, Yunnan[J]. Virol Sin, 2022, 37(1): 19-29. DOI:10.1016/j.virs.2021.12.001 |
| [17] |
Luo SY, Cui WH, Li C, et al. Seroprevalence of dengue IgG antibodies in symptomatic and asymptomatic individuals three years after an outbreak in Zhejiang province, China[J]. BMC Infect Dis, 2018, 18(1): 92. DOI:10.1186/s12879-018-3000-5 |
| [18] |
骆淑英, 刘营, 傅涛, 等. 登革热暴发9年后感染者抗体阳性率调查[J]. 中国媒介生物学及控制杂志, 2019, 30(4): 371-373. Luo SY, Liu Y, Fu T, et al. An investigation of seroprevalence of IgG antibodies in infected cases nine years after a dengue outbreak[J]. Chin J Vector Biol Control, 2019, 30(4): 371-373. DOI:10.11853/j.issn.1003.8280.2019.04.003 |
| [19] |
Sun JM, Luo SY, Lin JF, et al. Inapparent infection during an outbreak of dengue fever in Southeastern China[J]. Viral Immunol, 2012, 25(6): 456-460. DOI:10.1089/vim.2012.0039 |
 2023, Vol. 34
2023, Vol. 34


