扩展功能
文章信息
- 舒纪为, 陈旭辉, 谭启龙, 黄喆, 叶凌, 王志平, 黄懋雯, 李世波, 陈倩, 张彤杰
- SHU Ji-wei, CHEN Xu-hui, TAN Qi-long, HUANG Zhe, YE Ling, WANG Zhi-ping, HUANG Mao-wen, LI Shi-bo, CHEN Qian, ZHANG Tong-jie
- 浙江省舟山群岛3株汉坦病毒全基因组序列分析
- Whole-genome sequence analysis of three strains of Hantavirus in Zhoushan Islands, Zhejiang Province, China
- 中国媒介生物学及控制杂志, 2023, 34(5): 607-611
- Chin J Vector Biol & Control, 2023, 34(5): 607-611
- 10.11853/j.issn.1003.8280.2023.05.004
-
文章历史
- 收稿日期: 2023-05-09
2 岱山县第一人民医院检验科, 浙江 舟山 316200;
3 岱山县疾病预防控制中心, 浙江 舟山 316200;
4 宁波市北仑区人民医院, 浙江 宁波 315800;
5 温州医科大学附属舟山医院, 浙江 舟山 316000
2 Laboratory of Daishan First People's Hospital, Zhoushan, Zhejiang 316200, China;
3 Daishan Center for Disease Control and Prevention, Zhoushan, Zhejiang 316200, China;
4 Beilun District People's Hospital of Ningbo, Ningbo, Zhejiang 315800, China;
5 Zhoushan Hospital Afffiliated to Wenzhou Medical University, Zhoushan, Zhejiang 316000, China
汉坦病毒(Hantavirus)是一类有包膜、分节段的RNA病毒,属汉坦病毒科(Hantaviridae)的正汉坦病毒属(Orthohantavirus),呈球形,ϕ80~120 nm。汉坦病毒基因组包含3个负义单链RNA,基因由小到大分别为S、M和L。其中S片段约1.7 kb,编码核衣壳蛋白(nucleocapsid protein,NP);M片段长约3.6 kb,编码包膜糖蛋白;L片段约6.5 kb,编码RNA依赖的RNA聚合酶,即L蛋白[1-3]。人类感染汉坦病毒后主要引起汉坦病毒心肺综合征(hantavirus pulmonary syndrome,HPS)和肾综合征出血热(hemorrhagic fever with renal syndrome,HFRS),HFRS的临床表现为出血、低血压、少尿或多尿等肾功能损害,病死率约为1%,研究表明,HFRS主要流行于亚欧大陆,而我国是目前报道HFRS最多的国家[4]。
2020年浙江省舟山市连续出现多例HFRS病例[5],对舟山地区公共卫生造成一定的威胁。为明确病毒基因特征,本研究对宿主动物开展汉坦病毒核酸检测及全基因序列测定及分析,为防疫工作提供科学依据。
1 材料与方法 1.1 标本来源收集2021年舟山群岛小型兽类肺标本194份,其中鼠类标本166份,臭鼩(Suncus murinus)28份,经实时荧光定量PCR法检测,汉坦病毒阳性13份,均来自于褐家鼠(Rattus norvegicus),均为首尔型汉坦病毒(SEOV),选取其中循环阈值(cycle threshold,Ct) < 30的样品进行巢式PCR。
1.2 主要试剂与仪器一步法反转录聚合酶链式反应(RT-PCR)试剂盒(RR055A)、PCR试剂盒(RR902A)均购自宝生物工程(大连)有限公司。普通PCR仪使用梯度基因扩增仪T-one 96G(德国耶拿分析仪器股份公司);凝胶成像分析仪Essential V6(英国UVITEC公司);电泳仪EPS300(上海天能科技有限公司)。
1.3 样本处理与核酸提取无菌采集鼠肺标本用组织研磨器研磨1 min制作组织匀浆;将匀浆液4 ℃、8 000×g离心1 min,收集上清液分装至1.5 ml离心管中;采用RNeasy Mini Kiti试剂盒(德国QIAGEN公司),按说明书操作提取病毒核酸。
1.4 巢式PCR引物的设计与合成根据前期工作获得的M片段序列[5]在GenBank数据库中分别找到L、M、S片段同源性最高的序列KP645196、KY639618、KY639699作为参考序列设计引物,送至宁波康贝生化有限公司合成,引物序列见表 1。
对实时荧光定量PCR汉坦病毒核酸阳性的标本采用巢式PCR进行扩增,第2轮扩增产物经琼脂糖凝胶电泳50 min后在成像仪上确认特异性条带达到测序要求后,送上海派森诺基因科技有限公司进行测序。
1.6 序列拼接及系统发育树构建采用DNAStar的子软件SeqMan 7.1.0.44进行序列拼接,采用MEGA 7.0软件进行多序列比对和系统发育树的构建,选用贝叶斯信息量(BIC)值最小的Tamura 3-parameter模型,绘制方法采用邻接(neighbor-joining,NJ)法,参考序列均来自GenBank数据库。
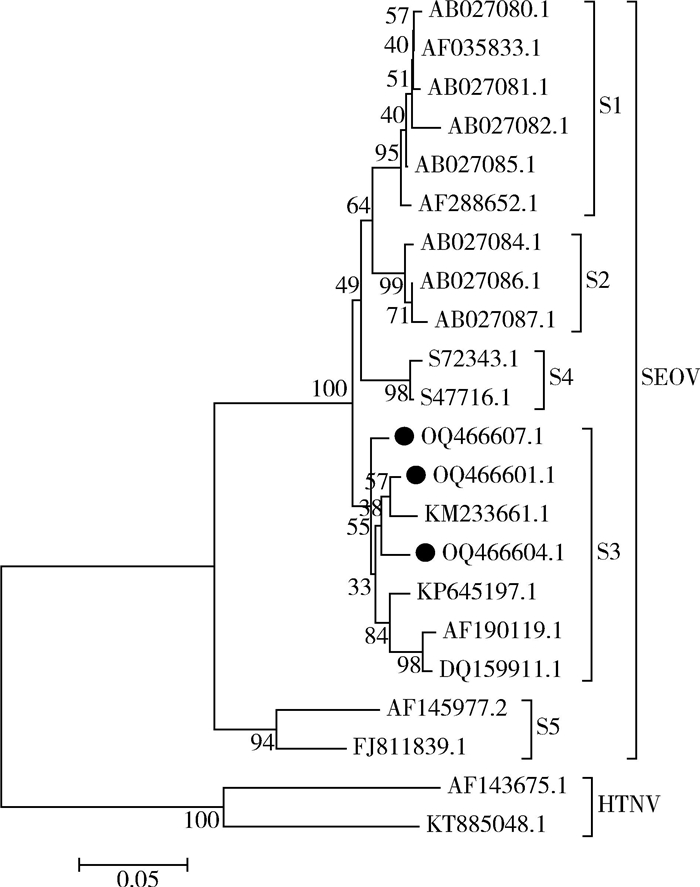
1.7 基因亚型分析M片段基因变异情况可作为汉坦病毒分型的依据,SEOV可分为4~6个亚型[6-7],本研究将AF288652、AF035833、AB027086、AB027087、AF190119、DQ159911、S47716、S72343、FJ811839和AF145977作为参考序列,与本研究中的ZJDS55、ZJDSD3、ZJDSE2三株病毒株的M段基因构建系统发育树。
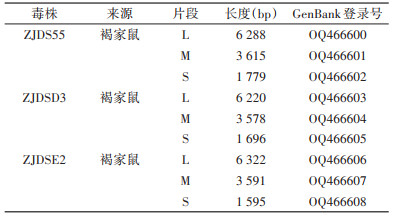
2 结果 2.1 巢式PCR及序列拼接2轮扩增后经琼脂糖凝胶电泳确认获得有效条带共36条,3株完整的汉坦病毒样本ZJDS55、ZJDSD3、ZJDSE2达到测序要求。序列拼接后获得3株汉坦病毒全基因组序列,上传至美国国立生物技术信息中心(NCBI)GenBank数据库,登录号为OQ466600~OQ466608。见表 2。
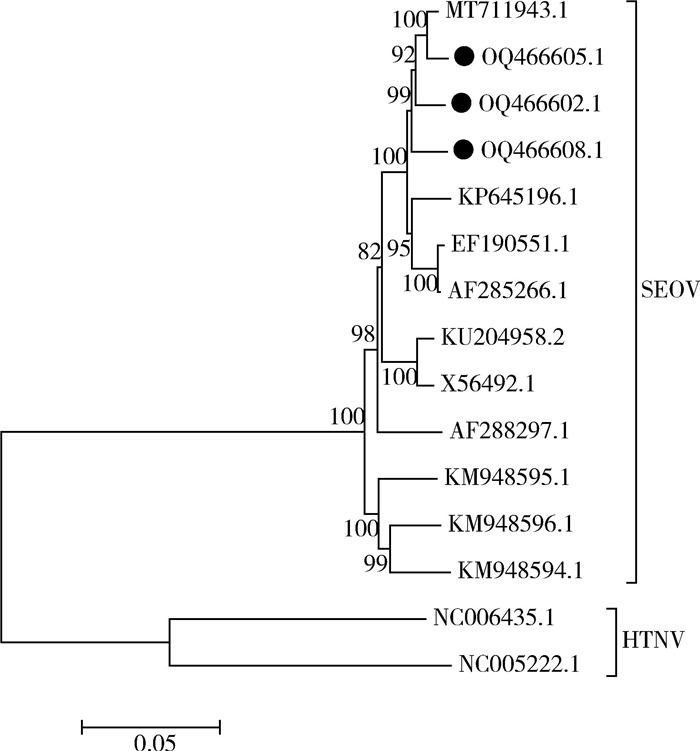
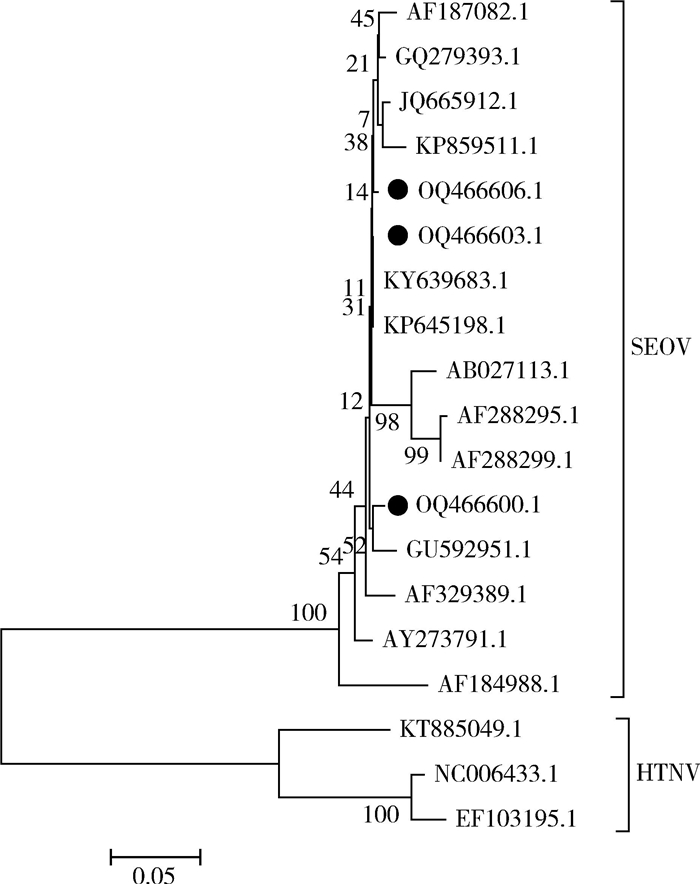
经测序获得的ZJDS55、ZJDSD3、ZJDSE2的全基因组序列分别有11 682、11 494、11 508个核苷酸。这3株汉坦病毒L、M、S基因长度见表 1,其核苷酸同源性分别为97.30%~97.90%、96.80%~97.10%和96.30%~98.20%。采用MEGA 7.0软件对核苷酸进行比对分析,以NJ法构建系统发生树。L、M和S 3个基因的核苷酸系统发生树分别见图 1~3。3株汉坦病毒均属于SEOV,L基因与MT711943.1同源性为97.00%~97.80%;M基因与KM233661.1、MT711943.1等同源性为97.00%~98.98%;S基因与GU592951.1、AF288299、KY639683等毒株同源性达99.00%。3株汉坦病毒与SEOV疫苗株Z37的AF285266.1、AF190119.1、AF285266.1基因核苷酸同源性分别为97.29%~97.63%、96.70%~97.74%和97.61%~97.97%;与SEOV疫苗株Z37的氨基酸同源性L、M、S基因分别为98.52%~99.53%、93.74%~99.59%和99.30%;与疫苗株Z37的2个糖蛋白免疫表位435GQKKTILTKTLVIGQ451、880PFSCPEFGQFRKKC894氨基酸序列一致,与4个核蛋白免疫表位72GKNIGQDRDPTGVEPGDHLKERSALSYGNTLDLNSLDID110、165YEDVNGIRKP174、251PIAGSLSGNPVNRD264、338MRNTIMASK346均一致。
|
| 注:●为本次检测到的病毒序列;SEOV 首尔型汉坦病毒;HTNV 汉滩型汉坦病毒。 图 1 汉坦病毒L基因核苷酸系统发育树 Figure 1 Phylogenetic tree of L gene nucleotide sequence of Hantavirus |
| |
|
| 注:●为本次检测到的病毒序列;SEOV 首尔型汉坦病毒;HTNV 汉滩型汉坦病毒。 图 2 汉坦病毒M基因核苷酸系统发育树 Figure 2 Phylogenetic tree of M gene nucleotide sequence of Hantavirus |
| |
|
| 注:●为本次检测到的病毒序列;SEOV 首尔型汉坦病毒;HTNV 汉滩型汉坦病毒。 图 3 汉坦病毒S基因核苷酸系统发育树 Figure 3 Phylogenetic tree of S gene nucleotide sequence of Hantavirus |
| |
本研究ZJDS55、ZJDSD3、ZJDSE2 3株病毒株的M段基因与参考基因构建系统发育树,3株病毒株与Z37、ZT10等为同一进化分支,均为S3亚型,见图 2。
3 讨论随着社会的快速发展,浙江省舟山群岛工业园的建设逐年增加,其地理地貌发生了巨大变化[8],而研究表明HFRS的发病与生态环境、鼠类分布等因素密切相关[9]。浙江省舟山群岛近30年未有HFRS病例报告,2020年在舟山市连续出现多例HFRS病例,根据目前的生态形势,HFRS的发病概率可能会提高。本研究为明确舟山群岛汉坦病毒基因型别、序列特征、变异情况,采用巢式PCR,自行设计引物序列,采用准确程度较高的Sanger测序法进行全基因组序列测定,巢式PCR通过2轮扩增,大幅度提高了反应灵敏度,在未进行病毒培养的条件下成功扩增出3个汉坦病毒全基因序列,结果表明,浙江省舟山群岛汉坦病毒为SEOV型S3亚型,其基因序列与浙江省瑞安市,辽宁和山东省等地同源性较高。
研究表明,早期建立有效的中和抗体反应可显著改善HFRS患者预后,经疫苗接种产生特异性抗体,在预防HFRS发生和流行可起到积极性作用[10-11],我国目前使用的二价灭活疫苗为沙鼠肾细胞(MGKC)制备的HTNV型(Z10株)、SEOV型(Z37株)和地鼠肾细胞(GHKC)制备的HTNV型(84LFi株)和SEOV型(L99株)[12-13]。汉坦病毒的核衣壳蛋白具有很强的抗原性和免疫原性,汉坦病毒包膜糖蛋白具有病毒毒力位点、细胞结合位点、中和抗原决定簇及特异性抗原位点等,是诱导免疫反应的主要因素[14],ZJDS55、ZJDSD3、ZJDSE2与SEOV疫苗株Z37的2个糖蛋白免疫表位和4个核衣壳蛋白免疫表位氨基酸序列均一致[15],因此,推断疫苗具有较好的保护作用,当地应加强疫苗接种,并持续开展病毒基因序列监测。
本研究采用的Sanger测序法具有准确性高的优点,但操作步骤繁琐,需多对引物和进行序列拼接,且全基因组的完整性仍有缺陷,影响数据的分析结果。因此,下一步的研究可采用二代测序或三代测序的方法,以获得更加完整、准确的全基因组数据。本研究成功测定了3株汉坦病毒的全基因组序列,明确了舟山群岛汉坦病毒基因型别。根据对流行株变异和系统发育的分析推断,目前我国使用的HFRS疫苗对该地区人群仍具有一定的保护力,对当地HFRS的防控提供了重要的科学资料。此外,本研究还积累了舟山群岛汉坦病毒的分子流行病学资料,为未来相关研究提供了参考依据。
利益冲突 无
| [1] |
Kim KA, Choi GH, Jang ES, et al. Epidemiology and treatment status of Hepatitis C virus infection among people who have ever injected drugs in Korea: A prospective multicenter cohort study from 2007 to 2019 in comparison with non-PWID[J]. Epidemiol Health, 2021, 43: e2021077. DOI:10.4178/epih.e2021077 |
| [2] |
Diagne MM, Dieng I, Granjon L, et al. Seoul Orthohantavirus in wild black rats, Senegal, 2012-2013[J]. Emerg Infect Dis, 2020, 26(10): 2460-2464. DOI:10.3201/eid2610.201306 |
| [3] |
Hepojoki J, Strandin T, Lankinen H, et al. Hantavirus structure-molecular interactions behind the scene[J]. J Gen Virol, 2012, 93(Pt 8): 1631-1644. DOI:10.1099/vir.0.042218-0 |
| [4] |
Heuser E, Drewes S, Trimpert J, et al. Pet rats as the likely reservoir for human Seoul Orthohantavirus infection[J]. Viruses, 2023, 15(2): 467. DOI:10.3390/v15020467 |
| [5] |
陈旭辉, 谭启龙, 舒纪为, 等. 浙江省岱山县一起肾综合征出血热疫情汉坦病毒分子流行病学分析[J]. 中国媒介生物学及控制杂志, 2022, 33(5): 706-709. Chen XH, Tan QL, Shu JW, et al. Molecular epidemiological analysis of Hantavirus in an outbreak of hemorrhagic fever with renal syndrome in Daishan county, Zhejiang province, China[J]. Chin J Vector Biol Control, 2022, 33(5): 706-709. DOI:10.11853/j.issn.1003.8280.2022.05.017 |
| [6] |
耿英芝, 田疆, 刘芸, 等. 辽宁省汉城型汉坦病毒基因亚型分析[J]. 中国公共卫生, 2012, 28(12): 1594-1596. Geng YZ, Tian J, Liu Y, et al. Genetic subtypes and distribution of Seoul hanta virus in Liaoning province[J]. Chin J Public Health, 2012, 28(12): 1594-1596. DOI:10.11847/zgggws-2012-28-12-15 |
| [7] |
罗学辉, 黄邵军, 陈立锋, 等. 余姚市鼠形动物携带汉坦病毒及M基因分析[J]. 预防医学, 2016, 28(8): 789-791, 795. Luo XH, Huang SJ, Chen LF, et al. An investigation on the infection status and genotype of Hantavirus carried by rodents in Yuyao city of Zhejiang province[J]. Prev Med, 2016, 28(8): 789-791, 795. DOI:10.19485/j.cnki.issn1007-0931.2016.08.008 |
| [8] |
柴能明, 谭启龙, 舒纪为, 等. 一起肾综合征出血热聚集性疫情调查分析[J]. 中国卫生检验杂志, 2023, 33(1): 95-97, 101. Chai NM, Tan QL, Shu JW, et al. Investigation and analysis of a clustered epidemic of hemorrhagic fever with renal syndrome[J]. Chin J Health Lab Technol, 2023, 33(1): 95-97, 101. |
| [9] |
董晓庆, 石利民, 王雅倩, 等. 南京都市圈肾综合征出血热疑似病例血清学检测及基因亚型分析[J]. 中国人兽共患病学报, 2022, 38(4): 322-326. Dong XQ, Shi LM, Wang YQ, et al. Serological detection and genotype analysis of Hantavirus isolated from patients with suspected hemorrhagic fever with renal syndrome (HFRS) in the Nanjing metropolitan area[J]. Chin J Zoonoses, 2022, 38(4): 322-326. DOI:10.3969/j.issn.1002-2694.2022.00.037 |
| [10] |
胡海峰, 杜虹, 伊宏煜, 等. 肾综合征出血热抗病毒治疗及疫苗研发进展[J]. 传染病信息, 2020, 33(3): 198-201. Hu HF, Du H, Yi HY, et al. Advances in antiviral treatment and vaccine development of hemorrhagic fever with renal syndrome[J]. Infect Dis Inf, 2020, 33(3): 198-201. DOI:10.3969/j.issn.1007-8134.2020.03.002 |
| [11] |
程林峰, 张芳琳, 徐志凯. 肾综合征出血热新型疫苗研究进展[J]. 中国病毒病杂志, 2011, 1(6): 459-462. Cheng LF, Zhang FL, Xu ZK. Progress in HFRS vaccine research[J]. Chin J Viral Dis, 2011, 1(6): 459-462. DOI:10.16505/j.2095-0136.2011.06.007 |
| [12] |
房恩岳. 病毒性出血热的研究进展[J]. 中国生物制品学杂志, 2019, 32(6): 707-712. Fang EY. Progress in research on viral hemorrhagic fevers[J]. Chin J Biol, 2019, 32(6): 707-712. DOI:10.13200/j.cnki.cjb.002643 |
| [13] |
尤佳, 张振. 汉坦病毒疫苗的研究进展[J]. 中华卫生杀虫药械, 2022, 28(1): 90-93. You J, Zhang Z. Research progress of Hantavirus vaccine[J]. Chin J Hyg Insect Equip, 2022, 28(1): 90-93. DOI:10.19821/j.1671-2781.2022.01.025 |
| [14] |
王建文, 赵玉军, 宋卓, 等. 汉坦病毒结构蛋白及其表位生物学活性的研究进展[J]. 现代畜牧兽医, 2007(4): 60-63. Wang JW, Zhao YJ, Song Z, et al. Research progress on structural protein of Hantavirus and biological activity of its epitope[J]. Mod J Anim Husb Vet Med, 2007(4): 60-63. DOI:10.3969/j.issn.1672-9692.2007.04.041 |
| [15] |
刘师文, 张艳妮, 肖芳, 等. 江西省高安市两株汉城病毒分离鉴定及全基因组序列分析[J]. 中国人兽共患病学报, 2022, 38(2): 102-107. Liu SW, Zhang YN, Xiao F, et al. Isolation and complete genome sequence analysis of two Seoul Orthohantavirus strains isolated from Gaoan city, Jiangxi province[J]. Chin J Zoonoses, 2022, 38(2): 102-107. DOI:10.3969/j.issn.1002-2694.2022.00.023 |
 2023, Vol. 34
2023, Vol. 34