扩展功能
文章信息
- 地里努尔·帕尔汗德, 郑小英, 吴忠道, 潘文杰, 张东京
- PAERHANDE Dilinuer, ZHENG Xiao-ying, WU Zhong-dao, PAN Wen-jie, ZHANG Dong-jing
- 蚊虫肠道微生物在辐照不育技术中的应用前景
- Application prospect of mosquito gut microbiotas in the irradiation-based sterile insect technique
- 中国媒介生物学及控制杂志, 2023, 34(4): 579-584
- Chin J Vector Biol & Control, 2023, 34(4): 579-584
- 10.11853/j.issn.1003.8280.2023.04.025
-
文章历史
- 收稿日期: 2022-12-12
2 中山大学热带病防治研究教育部重点实验室, 广东 广州 510080;
3 国家原子能机构核技术(昆虫不育)研发中心, 广东 广州 510080;
4 中大核昆生物技术(东莞)有限公司, 广东 广州 510080
2 Key Laboratory of Tropical Disease Control of Ministry of Education, Sun Yat-sen University, Guangzhou, Guangdong 510080, China;
3 Chinese Atomic Energy Agency Center of Excellence on Nuclear Technology Applications for Insect Control, Guangzhou, Guangdong 510080, China;
4 Guangzhou SYSU Nuclear and Insect Biotechnology Co., Ltd., Guangzhou, Guangdong 510080, China
蚊虫可以传播多种疾病,包括按蚊(Anopheles)传播的疟疾(malaria);伊蚊(Aedes)传播的登革热(dengue fever)、寨卡病毒病(Zika)和基孔肯雅热(chikungunya fever);库蚊(Culex)传播的丝虫病(filariasis)、流行性乙型脑炎(Japanese encephalitis)和西尼罗热(West Nile fever)[1]等。据估计每年有3.9亿人感染登革热,其中约有0.96亿人会出现临床症状[2];《世界疟疾报告2021》显示2020年全球估计有2.41亿例疟疾病例,死亡人数约为62.7万人[3]。蚊媒病因传播迅速、范围广、危害性大,严重威胁人类健康和公共卫生安全。由于缺少有效的特异性疫苗和治疗药物,媒介生物控制仍是预防控制蚊媒病的主要手段。蚊虫的常规控制方法主要依赖环境防制、物理防制、化学防制和生物防制。然而,杀虫剂的广泛使用、滥用已经导致蚊虫抗药性频发,且会危害人类健康和非靶标昆虫,导致环境污染。因此,控制媒介蚊虫需要采取综合防制措施,其中生物防制如昆虫不育技术(sterile insect technique,SIT),以控制有害昆虫种群为目的,因其特异性强、安全有效、绿色环保,可作为蚊媒综合防制措施的重要组成部分,弥补当前传统蚊虫控制措施的不足[4]。
SIT主要通过大量持续释放经辐照绝育的雄虫,与野生雌虫交配后,使雌虫产下后代无法继续发育,从而降低靶标害虫的种群数量[5]。释放高质量的绝育雄虫是SIT成功的关键。然而,集约化生产操作、诱导雄虫绝育的辐照、冷藏运输和释放等均会影响绝育雄虫的质量,从而影响SIT控制蚊虫的效率。蚊虫体表和体内含有大量微生物,其中大部分微生物定植于蚊虫的消化道内,形成稳定的肠道微生物群(gut microbiota),对蚊虫的生长发育、抵御侵害、免疫调控等方面发挥着重要作用,直接或间接影响蚊虫的生理与健康。因此,如何通过调控蚊虫肠道微生物从而提高SIT蚊媒控制效率,值得进一步总结与探讨。本文综述了蚊虫肠道微生物的种类和功能,分析了肠道微生物群与绝育雄虫“致弱”的潜在关系,并展望肠道微生物群在SIT控制蚊虫中的应用前景,即利用蚊虫肠道微生物群来降低或修复绝育雄蚊的“致弱”,从而提升SIT控制蚊媒的效率。
1 昆虫不育技术SIT是一种特异性强、安全有效、绿色环保的害虫防制技术,可以作为大面积害虫综合治理策略(area-wide integrated pest management,AW-IPM)的一个重要组成部分。在20世纪50年代,美国利用SIT结合AW-IPM,首次成功消灭了其东南部的对牲畜致命的寄生虫——新大陆螺旋蝇(Cochliomyia hominivorax)。20世纪80-90年代,科学家们运用SIT在日本冲绳群岛和坦桑尼亚桑给巴尔分别根除了瓜实蝇(Bactrocera cucurbitae)和采采蝇(Glossina)[5]。进入21世纪后,SIT被测试应用于控制不同的害虫,包括农业害虫和卫生害虫,均取得一定的研究成效[6]。
1.1 SIT组成SIT是指通过大量饲养靶标害虫,经过雌雄分离之后,利用来自同位素源的γ射线或X射线辐照处理使雄虫不育,然后把经辐照的雄虫(绝育雄虫)释放到控制区域,当绝育雄虫与靶标种群的野生雌虫交尾后,雌虫产下后代无法继续发育,死于胚胎早期,通过持续释放从而达到控制害虫种群数量的目的[5]。SIT包括昆虫株系的建立、大规模饲养(雌雄分离)、辐照绝育、包装运输、释放和监测、质量控制和社区教育,这些环节均会不同程度影响绝育雄虫的质量,从而影响害虫控制的效益。绝育雄虫质量主要体现在适合度(fitness)指标上,包括雄虫的寿命、飞行能力和交配竞争力(male mating competitiveness)。交配竞争力是指绝育雄虫与野生雄虫竞争交尾雌虫的能力,也称为C指数(C index)。当C=1时,表明绝育雄虫与野生雄虫具有相同的交尾力;当C > 1时,表明绝育雄虫具有比野生雄虫更强的交尾力;而当C < 1时,表明绝育雄虫的交尾力弱于野生雄虫。后者可以通过释放更多数量的绝育雄虫来弥补交尾力的不足,但这意味着技术效益下降。因此,如何获取高质量的绝育雄虫是SIT应用的关键环节。
1.2 SIT制约因素在STT的应用中,电离辐射可诱导雄虫绝育,绝育的强度与辐照剂量、剂量率、环境、虫体接受辐照时的发育阶段相关。当电离辐射穿过生物组织时,其辐射能量直接向组织传递,造成生物体的物理和化学损伤,从而破坏昆虫的生殖系统,使得雌、雄虫的生殖能力发生下降,甚至消失[5]。辐照使雄虫绝育是由于辐照产生的致死性突变,包括染色体缺失、倒位、易位等结构变异,从而影响受精卵的减数分裂,导致胚胎早期死亡。除了生殖系统,辐照也会影响昆虫的消化系统、循环系统和神经系统等方面,使得昆虫出现适合度如交配竞争力下降[7]。有研究指出,经辐照瓜实蝇雄虫的交配竞争力降低为辐照前的0.2~0.6;γ射线能抑制家蚕(Bombyx mori)5龄幼虫继续生长分化出翅和鳞片,从而影响飞行能力;经γ射线处理幼虫后,昆士兰实蝇(Bactrocera tryoni)食道上的神经节明显缩小、中肠上皮丧失、基膜和肌肉松散与微绒毛拥挤,对形成抵抗毒素的屏障产生影响[8]。因此,辐照在绝育雄虫的同时,不可避免对雄虫造成一系列“致弱”影响,影响绝育雄虫的质量,从而影响SIT控制害虫种群的效率。除了辐照,规模化饲养与操作、冷藏运输与释放等过程中,都会不同程度影响雄虫的质量,从而影响SIT的效率。因此,寻找有效的途径来降低或修复因辐照或其他处理对绝育雄虫带来的“致弱”影响,对SIT控制有害昆虫项目具有重大意义。
2 昆虫肠道微生物昆虫体内存在种类繁多的微生物,它们直接或间接影响昆虫的生理与健康,这些微生物主要定植在昆虫消化道,称为肠道微生物。研究发现细菌在所有昆虫肠道内都有分布,并且占据最大的数量。除了细菌,昆虫肠道内定植的微生物也包括原生生物、真菌、古生菌及病毒等。其中原生生物在白蚁和以腐木为食的蜚蠊(Cockroach)等昆虫体内主要通过群体水平传播[9],而真菌和产甲烷的古生菌则在以木材或者腐殖质为食的昆虫肠道中较为常见,它们可能在食物消化方面具有重要作用[10-11]。
2.1 昆虫肠道菌群分类和功能根据功效可将肠道菌群划分为3类,即正常菌群(normal flora)、有害菌群(pernicious flora)和机会致病菌群(opportunistic pathogen)。当正常菌群占主导时,肠道内环境稳定,有害菌群存在但数量远低于正常菌群,机会致病菌群对肠道或宿主不存在威胁。当肠道内菌群失衡,稳态被打乱,有害菌群占主导,使得低丰度有害细菌大量繁殖,此时机会致病菌群会转变功能,转向助长有害菌群从而破坏肠道内环境。这些菌群经常与宿主直接竞争代谢底物,如碳源和氨基酸。一旦肠道生态失调,潜在的病原体可以迅速胜过共生体,因为它们基因组中的某些因素如抗菌肽和活性氧对宿主防御机制具有更强的抵抗力,并能更好地利用肠道的营养环境。因此,肠道菌群中少数成员的增加将有助于形成独特的肠道代谢环境,包括初级营养代谢产物(碳水化合物、脂质和氨基酸等)代谢水平的提高和宿主免疫反应的提高,而这反过来又会对宿主的健康产生负面影响。肠道菌群之间相互作用、相互制约,构成动态稳定的微生态平衡。与此同时,在长期的协同进化过程中,昆虫及其体内的肠道菌群存在严格周密的共生关系。肠道菌群能在多方面影响宿主,包括生长发育[12]、营养代谢[13]及生殖行为[14-16]等方面,宿主也能通过机体免疫应答来“识益排害”[17],保证肠道菌群的稳定存在。
2.2 蚊虫重要肠道微生物群和功能蚊属于昆虫纲(Insecta)双翅目(Diptera)蚊科(Culicidae),可传播多种病原体,尤其是病毒,是最重要的医学昆虫类群,分布广泛,种类繁多。在蚊虫体内,中肠主要负责消化分解进入体内物质,是其抵御病原体感染的第一道防线,也是共生微生物群主要聚集地(图 1),多类微生物定植在此并通过直接或间接的方式发挥作用。生殖系统和唾液腺是蚊虫繁殖和传播病原体的重要器官,而共生微生物群在蚊虫组织细胞中的分布随各器官功能的差异而不同[8]。
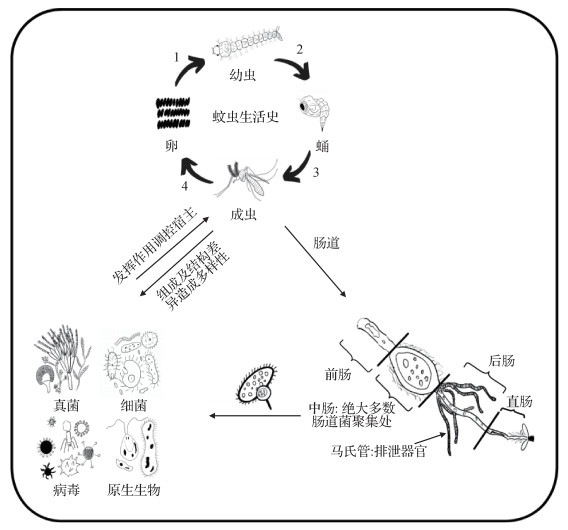
|
| 图 1 蚊虫生活史及其肠道微生物分布与作用 Figure 1 The life cycle of mosquitos and the distribution and roles of their gut microbiotas |
| |
在蚊虫肠道中,细菌菌群以革兰阴性好氧菌或兼性厌氧菌为主[18-20]。通过对不同蚊种的研究发现,其绝大多数菌群属于拟杆菌门(Bacteroidetes)、变形杆菌门(Proteobacteria)、厚壁菌门(Frimicutes)和放线菌门(Actinobacteria)[21],隶属于优势菌门。其中最常见的菌属包括:拟杆菌门的伊丽莎白菌(Elazabethkingia)、金黄杆菌(Chryseobacterium);变形菌门的沙雷菌(Serratia)、肠杆菌(Enterobacter)和不动杆菌(Acinetobacter)[21]。以下对可能在蚊虫生命过程中发挥重要作用的微生物进行简要描述,包括在数量与种类上占优势的菌属,以及一些重要的其他菌属细菌及真菌。
沙雷菌属是蚊虫肠道内最常见的菌属,可以从母代通过产卵的方式传递给子代,即垂直传播。其中以黏质沙雷菌(S. marcescens)最为常见,研究发现该菌能促进登革病毒、寨卡病毒和辛德毕斯病毒(Sindbis virus)感染蚊虫,主要通过分泌一种能够特异性识别和切割埃及伊蚊(Ae. aegypti)肠道黏液素的胞外蛋白酶(SmEnhancin)降解蚊虫肠道细胞表面的黏蛋白层,从而提高肠道细胞对病毒的易感性,表明肠道菌群可以通过编码和分泌增效因子与媒介宿主相互作用,从而影响媒介肠道微绒毛及围食膜结构及生物学功能[22-23]。
色素细菌(Chromobacterium,Csp_P)通过抑制周边多种细菌生长,从而迅速在蚊肠道内定植,并降低宿主埃及伊蚊的寿命,它也可能会影响蚊虫中肠通透性,使得大量肠道微生物进入血淋巴中,从而加速其死亡[24],故被认为是一种蚊虫“致病菌”[25]。进一步研究发现该菌能激活蚊虫自身的抗病毒免疫基因的表达,如抗菌肽基因,或者该菌自身分泌拮抗病原体的物质,如氨肽酶,从而抑制病毒和疟原虫等病原体对冈比亚按蚊(An. gambiae)的感染能力,也能降低登革病毒对埃及伊蚊的易感性,其分泌的氨肽酶可降解登革病毒的E蛋白,抑制病毒附着并感染蚊虫细胞[25]。
沃尔巴克氏体(Wolbachia)是一种胞内共生菌,在肠道中有分布,但其主要分布在雌虫的卵巢与雄虫的精巢中,垂直传播是主要的传播方式。可以通过多种方式操纵其宿主的生殖行为,包括胞质不相容性(cytoplasmic incompatibility,CI)、孤雌生殖、雌性化和杀雄现象,其中基于沃尔巴克氏菌诱导CI的能力可以将其用于控制蚊媒种群数量,也称种群压制。研究发现,人工转染新型沃尔巴克氏菌可以有效降低蚊虫对病毒的易感性[26],主要通过激活宿主的先天免疫反应或直接利用微生物产物来应对病原体的侵袭[27]。
真菌不仅能产生丰富的蛋白质和次级代谢产物为宿主供给营养,也能产生具有免疫抑制作用的真菌毒素来调控宿主对病原体的敏感性,还可以通过争夺宿主营养和释放毒素来缩短宿主寿命。如白僵菌(Beauveria bassiana)能激活埃及伊蚊的Toll通路、酪氨酸激酶/信号转导子及转录激活子(JAK-STAT)通路的相关基因表达从而抑制蚊虫对登革病毒的感染[28]。而绿僵菌(Metarhizium anisopliae)通过其分生孢子附着在蚊虫宿主的角质层上形成附着胞,再在角质层穿孔,侵入宿主血腔,形成菌丝,耗尽宿主营养,产生并释放毒素,最终杀死宿主[28]。同时1种篮状菌(Talaromyces,Tsp_PR)的分泌物能抑制胰蛋白酶的活性,而胰蛋白酶有拮抗登革病毒感染的作用,故该酶表达及活性下降有利于登革病毒感染蚊虫[29]。
2.3 影响蚊虫肠道菌群多样性的因素受多种因素的影响,肠道菌群多样性(组成结构与种类数量)和主要细菌属的相对丰度具有显著差异[30]。蚊种及栖息地不同导致不同种类蚊虫肠道菌群之间存在较大差异[31]。特定蚊种群会选择性的建立自身菌群结构,与蚊媒病传播相关的3大类蚊属包括按蚊属、库蚊属及伊蚊属的肠道菌群有明显差异[4]。
蚊虫是完全变态发育的昆虫,生活史分为卵、4个龄期的幼虫、蛹和成虫阶段,处于不同生命周期的蚊虫肠道菌群在种类和数量上均存在差异。卵可能携带少量垂直传播来的共生菌,孵化为幼虫后,在水中获得新的肠道菌群,幼虫期从2龄到4龄其肠道细菌的数量都在增加,直到发育到蛹的阶段和蛹羽化变成成虫阶段,会各排出1次由围食膜包裹的胎粪,幼虫阶段肠道内的绝大多数细菌通过这种形式被排出体外,使得刚羽化的成虫肠道内处于少菌状态[32],细菌数量和多样性都显著降低[33]。进食后的成虫肠道菌在数量上和多样性上又以指数式增长。
研究发现,在幼虫肠道中鉴定出的大多数菌群与其栖息地微生物存在群落高度重叠,这表明蚊虫肠道微生物主要是从环境中获取,环境中获取的食物是塑造肠道菌最重要的来源。生活在复杂环境的野生蚊虫体内的共生菌群多样性普遍高于实验室种群。野外条件下,生态环境和孳生地类型的多样性导致蚊虫摄入食物的种类和数量存在差异,继而影响其肠道微生物群在组成上的多样性[31, 34]。取食习性不同也会导致菌群差异,如以可为产卵提供必要蛋白质和铁元素的脊椎动物血液为食的雌蚊与“高糖低pH饮食方式”的雄蚊体内肠道菌群差异显著[34]。
3 益生菌修复SIT“致弱”昆虫肠道菌群调控宿主各方面的生理功能,肠道内不同菌群之间也存在着相互影响与制约的关系,并在宿主的免疫生理作用下维持一定的稳态。当发生某种剧烈变化时,整个稳态则会被打破,肠道菌群结构会发生变化,其主要表现在数量改变和比例变动。肠道菌群的变化伴随着代谢产物的变化,且代谢产物和宿主生理改变相互影响,继而影响宿主应对外界环境的适合度。在SIT控制有害昆虫时,辐照是诱导雄虫绝育的关键步骤,已有研究表明辐照会扰乱昆虫肠道微生态平衡,导致靶标雄虫的适合度明显下降,影响雄虫的质量。鉴于肠道菌群对宿主功能的重要作用,研究发现可以通过补充“益生菌”方法来降低或修复因辐照或其他处理对绝育雄虫带来的“致弱”影响,即“益生菌”修复法[35-39]。
有研究发现,经辐照后,橘小实蝇(B. dorsalis)肠道中主要菌群肠杆菌科细菌显著减少,推测该菌群的丰度下降导致宿主体内固氮能力下降、信息素合成被阻断,从而导致不育雄虫的各种生态适应力指标下降,进一步通过比对辐照组与未辐照组之间的菌群功能差异,发现有10个基因类别具有显著差异,例如,相对于未辐照组,辐照组雄虫肠道具有更低的碳水化合物、氨基酸、辅酶和微生物相关的代谢功能活动,这表明辐照对宿主生态适应力的损害与肠道微生物群落失调有关,进而导致辐照雄虫生态适应能力的下降[40]。有研究发现白纹伊蚊辐照前后,其成虫肠道内气单胞菌平均丰度明显上升,而肠球菌平均丰度下降[41]。因此,提示辐照对昆虫肠道菌的影响可能为有益菌减少、有害菌增多,或是两者同时发生。
对饲养条件的标准化和改善(包括优化幼虫培养基[42])将有助于昆虫肠道内形成更利于其生存的菌群。研究发现,在幼虫和成虫的食物中添加有益菌可以增强宿主的质量指标[35],如给经辐照后的地中海实蝇(Ceratitis capitata)喂养含有产酸克雷伯菌(Klebsiella oxytoca)的饲料,绝育雄蝇的交配竞争力显著增加,其耐饥饿的能力也显著提升[36];在地中海实蝇食物中添加弗氏柠檬酸菌(Citrobacter freundii)等菌显著增加雄虫各方面指标[37];辐照导致橘小实蝇雄虫的取食能力和血淋巴中主要营养物质水平显著下降,通过喂食K. michiganensis BD177菌株显著恢复了辐照雄虫的食物摄取量和主要营养素水平[38]。
在蚊虫的饲养过程中同样发现菌群对宿主的适合度起着关键调节作用。如亚细亚菌(Asaia)能够延长埃及伊蚊寿命、缩短发育时间和增大成蚊体型[37],对其生长发育产生积极作用[5];用藻类喂养的埃及伊蚊与对照组蚊虫相比,拥有更大的体型[43];一种肠杆菌属细菌,以其作为益生菌喂养幼虫(雄性),化蛹与成虫的能力显著提高[43]。由于益生菌能够调节肠道菌群平衡,且在细菌增殖过程中可产生多种活性酶和有效物质以产生明确的活性功效,从而改善肠道菌群微生态平衡发挥有益作用。
4 总结与展望蚊媒传染病严重影响人类健康,加强对蚊虫的防制研究,对共同推进人类健康和公共卫生安全有重要意义与价值。近些年,SIT在防制害虫包括蚊虫方面已经取得一些进展,在蚊虫SIT中,绝育雄蚊的质量至关重要,直接影响到该技术控制蚊虫种群数量的效率。然而,在集约化生产操作、诱导雄虫绝育的辐照、冷藏运输和释放等均会不同程度影响绝育雄虫的质量,从而影响SIT控制蚊虫的效率。由于肠道微生物对宿主的功能具有重大意义,推测绝育雄蚊的“致弱”可能与蚊虫肠道微生物失衡有关,因此提出利用肠道菌与“致弱”现象的潜在联系建立“以益生菌修复宿主肠道菌”的构想,进一步扩展微生物在SIT控制蚊虫项目中的应用前景。未来通过进一步分析辐照前后靶标雄蚊的肠道菌差异,以获得差异显著菌群,并通过回补菌群实验,探讨菌群修复或修改能否有效改善辐照后产生的雄蚊“致弱”现象,为提升蚊虫SIT效率提供新思路。
利益冲突 无
| [1] |
Tolle MA. Mosquito-borne diseases[J]. Curr Probl Pediatr Adolesc Health Care, 2009, 39(4): 97-140. DOI:10.1016/j.cppeds.2009.01.001 |
| [2] |
Bhatt S, Gething PW, Brady OJ, et al. The global distribution and burden of dengue[J]. Nature, 2013, 496(7446): 504-507. DOI:10.1038/nature12060 |
| [3] |
World Health Organization. World malaria report 2021[R]. Geneva: World Health Organization, 2021.
|
| [4] |
World Health Organization. Mosquito sterilization offers new opportunity to control chikungunya, dengue, and Zika[EB/OL]. (2019-11-14)[2022-04-26]. https://www.who.int/news/item/14-11-2019-mosquito-sterilization-offers-new-opportunity-to-control-chikungunya-dengue-and-zika.
|
| [5] |
阿诺德·戴克, 乔治·亨德里克斯, 阿兰·鲁宾逊. 昆虫不育技术: 原理及在大面积害虫综合治理中的应用[M]. 路大光, 译. 北京: 中国农业科学技术出版社, 2010: 20-65. Dyck VA, Hendrichs J, Robinson AS. Sterile insect technique: Principles and practice in area-wide integrated pest management[M]. Lu DG, trans. Beijing: China Agricultural Science and Technology Press, 2010: 20-65. (in Chinese) |
| [6] |
Vreysen MJB, Abd-Alla AMM, Bourtzis K, et al. The insect pest control laboratory of the joint FAO/IAEA Programme: Ten years (2010-2020) of research and development, achievements and challenges in support of the sterile insect technique[J]. Insects, 2021, 12(4): 346. DOI:10.3390/insects12040346 |
| [7] |
Zhang DJ, Lees RS, Xi ZY, et al. Combining the sterile insect technique with the incompatible insect technique: Ⅲ-robust mating competitiveness of irradiated triple Wolbachia-infected Aedes albopictus males under semi-field conditions[J]. PLoS One, 2016, 11(3): e0151864. DOI:10.1371/journal.pone.0151864 |
| [8] |
李姣, 肖铁光, 周社文. 桔小实蝇及其SIT防治技术应用研究进展[J]. 作物研究, 2007, 21(2): 145-148. Li J, Xiao TG, Zhou SW. Progress on Bactrocera dorsalis and application of SIT[J]. Crop Res, 2007, 21(2): 145-148. DOI:10.3969/j.issn.1001-5280.2007.02.021 |
| [9] |
Pusey PL. Biological control agents for fire blight of apple compared under conditions limiting natural dispersal[J]. Plant Dis, 2002, 86(6): 639-644. DOI:10.1094/PDIS.2002.86.6.639 |
| [10] |
Egert M, Wagner B, Lemke T, et al. Microbial community structure in midgut and hindgut of the humus-feeding larva of Pachnoda ephippiata (Coleoptera: Scarabaeidae)[J]. Appl Environ Microb, 2003, 69(11): 6659-6668. DOI:10.1128/AEM.69.11.6659-6668.2003 |
| [11] |
Lemke T, Stingl U, Egert M, et al. Physicochemical conditions and microbial activities in the highly alkaline gut of the humus-feeding larva of Pachnoda ephippiata (Coleoptera: Scarabaeidae)[J]. Appl Environ Microb, 2003, 69(11): 6650-6658. DOI:10.1128/AEM.69.11.6650-6658.2003 |
| [12] |
Tsuchida T, Koga R, Horikawa M, et al. Symbiotic bacterium modifies Aphid body color[J]. Science, 2010, 330(6007): 1102-1104. DOI:10.1126/science.1195463 |
| [13] |
Tamburini E, Perito B, Mastromei G. Growth phase-dependent expression of an endoglucanase encoding gene (eglS) in Streptomyces rochei A2[J]. FEMS Microbiol Lett, 2004, 237(2): 267-272. DOI:10.1016/j.femsle.2004.06.043 |
| [14] |
刘婧, 陈丹, 庄桂芬, 等. 家蝇发育过程中肠道可培养共生细菌的分离与鉴定[J]. 中国寄生虫学与寄生虫病杂志, 2017, 35(2): 120-124. Liu J, Chen D, Zhuang GF, et al. Isolation and identification of cultivable symbiotic bacteria from the intestinal tract of Musca domestica during development[J]. Chin J Parasitol Parasit Dis, 2017, 35(2): 120-124. |
| [15] |
Shi ZH, Wang LL, Zhang HY. Low diversity bacterial community and the trapping activity of metabolites from cultivable bacteria species in the female reproductive system of the oriental fruit fly, Bactrocera dorsalis Hendel (Diptera: Tephritidae)[J]. Int J Mol Sci, 2012, 13(5): 6266-6278. DOI:10.3390/ijms13056266 |
| [16] |
Wang HX, Jin L, Peng T, et al. Identification of cultivable bacteria in the intestinal tract of Bactrocera dorsalis from three different populations and determination of their attractive potential[J]. Pest Manag Sci, 2014, 70(1): 80-87. DOI:10.1002/ps.3528 |
| [17] |
Dillon RJ, Vennard CT, Buckling A, et al. Diversity of locust gut bacteria protects against pathogen invasion[J]. Ecol Lett, 2005, 8(12): 1291-1298. DOI:10.1111/j.1461-0248.2005.00828.x |
| [18] |
Dickson LB, Jiolle D, Minard G, et al. Carryover effects of larval exposure to different environmental bacteria drive adult trait variation in a mosquito vector[J]. Sci Adv, 2017, 3(8): e1700585. DOI:10.1126/sciadv.1700585 |
| [19] |
Coon KL, Brown MR, Strand MR. Mosquitoes host communities of bacteria that are essential for development but vary greatly between local habitats[J]. Mol Ecol, 2016, 25(22): 5806-5826. DOI:10.1111/mec.13877 |
| [20] |
Thongsripong P, Chandler JA, Green AB, et al. Mosquito vector-associated microbiota: Metabarcoding bacteria and eukaryotic symbionts across habitat types in Thailand endemic for dengue and other arthropod-borne diseases[J]. Ecol Evol, 2018, 8(2): 1352-1368. DOI:10.1002/ece3.3676 |
| [21] |
Raharimalala FN, Boukraa S, Bawin T, et al. Bacterial diversity of field-caught mosquitoes from different regions of Belgium and potential impact on virus transmission[C]//Proceedings of the 7th EPIZONE Annual Meeting "Nothing permanent, except change". Bruxelles, Belgium, 2013: 196.
|
| [22] |
Bando H, Okado K, Guelbeogo WM, et al. Intra-specific diversity of Serratia marcescens in Anopheles mosquito midgut defines Plasmodium transmission capacity[J]. Sci Rep, 2013, 3: 1641. DOI:10.1038/srep01641 |
| [23] |
Wu P, Sun P, Nie KX, et al. A gut commensal bacterium promotes mosquito permissiveness to arboviruses[J]. Cell Host Microbe, 2019, 25(1): 101-112.e5. DOI:10.1016/j.chom.2018.11.004 |
| [24] |
童良琴, 蔡珍, 肖小平, 等. 一种导致伊蚊死亡的色素细菌的发现及致死机制的研究[J]. 中国科学: 生命科学, 2021, 51(1): 83-90. Tong LQ, Cai Z, Xiao XP, et al. Discovery and mechanistic study of an Aedes aegypti lethal bacteria Chromobacterium[J]. Sci Sin Vitae, 2021, 51(1): 83-90. DOI:10.1360/SSV-2020-0236 |
| [25] |
Saraiva RG, Fang JR, Kang S, et al. Aminopeptidase secreted by Chromobacterium sp. Panama inhibits dengue virus infection by degrading the E protein[J]. PLoS Negl Trop Dis, 2018, 12(4): e0006443. DOI:10.1371/journal.pntd.0006443 |
| [26] |
Pan XL, Zhou GL, Wu JH, et al. Wolbachia induces reactive oxygen species (ROS)-dependent activation of the toll pathway to control dengue virus in the mosquito Aedes aegypti[J]. Proc Natl Acad Sci USA, 2011, 109(1): E23-E31. DOI:10.1073/pnas.1116932108 |
| [27] |
孙佩璐, 崔春来, 宋红生, 等. 斯氏按蚊中Toll受体参与抵抗微生物感染和调控肠道菌群稳态[J]. 昆虫学报, 2019, 62(8): 937-947. Sun PL, Cui CL, Song HS, et al. Toll receptors are involved in anti-microbial response and gut microbiota homeostasis in the malaria vector Anopheles stephensi (Diptera: Culicidae)[J]. Acta Entomol Sin, 2019, 62(8): 937-947. DOI:10.16380/j.kcxb.2019.08.006 |
| [28] |
Qu S, Wang SB. Interaction of entomopathogenic fungi with the host immune system[J]. Dev Comp Immunol, 2018, 83: 96-103. DOI:10.1016/j.dci.2018.01.010 |
| [29] |
Angleró-Rodríguez YI, Talyuli OAC, Blumberg BJ, et al. An Aedes aegypti-associated fungus increases susceptibility to dengue virus by modulating gut trypsin activity[J]. Elife, 2017, 6: e28844. DOI:10.7554/eLife.28844 |
| [30] |
Terenius O, Lindh JM, Eriksson GK, et al. Midgut bacterial dynamics in Aedes aegypti[J]. FEMS Microbiol Ecol, 2012, 80(3): 556-565. DOI:10.1111/j.1574-6941.2012.01317.x |
| [31] |
Zouache K, Raharimalala FN, Raquin V, et al. Bacterial diversity of field-caught mosquitoes, Aedes albopictus and Ae. aegypti, from different geographic regions of Madagascar[J]. FEMS Microbiol Ecol, 2011, 75(3): 377-389. DOI:10.1111/j.1574-6941.2010.01012.x |
| [32] |
Moncayo AC, Lerdthusnee K, Leon R, et al. Meconial peritrophic matrix structure, formation, and meconial degeneration in mosquito pupae/pharate adults: Histological and ultrastructural aspects[J]. J Med Entomol, 2005, 42(6): 939-944. DOI:10.1093/jmedent/42.6.939 |
| [33] |
Moll RM, Romoser WS, Modrakowski MC, et al. Meconial peritrophic membranes and the fate of midgut bacteria during mosquito (Diptera: Culicidae) metamorphosis[J]. J Med Entomol, 2001, 38(1): 29-32. DOI:10.1603/0022-2585-38.1.29 |
| [34] |
Osei-Poku J, Mbogo CM, Palmer WJ, et al. Deep sequencing reveals extensive variation in the gut microbiota of wild mosquitoes from Kenya[J]. Mol Ecol, 2012, 21(20): 5138-5150. DOI:10.1111/j.1365-294X.2012.05759.x |
| [35] |
Travanty NV, Apperson CS, Ponnusamy L. A diverse microbial community supports larval development and survivorship of the Asian tiger mosquito (Diptera: Culicidae)[J]. J Med Entomol, 2019, 56(3): 632-640. DOI:10.1093/jme/tjz003 |
| [36] |
Vavricka CJ, Han Q, Mehere P, et al. Tyrosine metabolic enzymes from insects and mammals: A comparative perspective[J]. Insect Sci, 2014, 21(1): 13-19. DOI:10.1111/1744-7917.12038 |
| [37] |
Augustinos AA, Kyritsis GA, Papadopoulos NT, et al. Exploitation of the medfly gut microbiota for the enhancement of sterile insect technique: Use of Enterobacter sp. in larval diet-based probiotic applications[J]. PLoS One, 2015, 10(9): e0136459. DOI:10.1371/journal.pone.0136459 |
| [38] |
蔡朝辉. 橘小实蝇肠道微生物对其生长发育及辐射源损伤修复的功能研究[D]. 武汉: 华中农业大学, 2020. Cai ZH. The effects of gut microbiota on the growth and the repair of irradiated damage in Bactrocera dorsalis[D]. Wuhan: Huazhong Agricultural University, 2020. (in Chinese) |
| [39] |
Msaad GM, Charaabi K, Hamden H, et al. Probiotic based-diet effect on the immune response and induced stress in irradiated mass reared Ceratitis capitata males (Diptera: Tephritidae) destined for the release in the sterile insect technique programs[J]. PLoS One, 2021, 16(9): e0257097. DOI:10.1371/journal.pone.0257097 |
| [40] |
Dale C. Evolution: Weevils get tough on symbiotic tyrosine[J]. Curr Biol, 2017, 27(23): R1282-R1284. DOI:10.1016/j.cub.2017.10.031 |
| [41] |
Zhang DJ, Chen S, Abd-Alla AMM, et al. The effect of radiation on the gut bacteriome of Aedes albopictus[J]. Front Microbiol, 2021, 12: 671699. DOI:10.3389/fmicb.2021.671699 |
| [42] |
Mancini MV, Damiani C, Accoti A, et al. Estimating bacteria diversity in different organs of nine species of mosquito by next generation sequencing[J]. BMC Microbiol, 2018, 18(1): 126. DOI:10.1186/s12866-018-1266-9 |
| [43] |
Shuttleworth LA, Khan MAM, Osborne T, et al. A walk on the wild side: Gut bacteria fed to mass-reared larvae of Queensland fruit fly [Bactrocera tryoni (Froggatt)] influence development[J]. BMC Biotechnol, 2019, 19 Suppl 2(95). DOI:10.1186/s12896-019-0579-6 |
 2023, Vol. 34
2023, Vol. 34


