扩展功能
文章信息
- 唐莉娟, 刘丹, 马博, 卜三平, 宋瑞霞, 王远志
- TANG Li-juan, LIU Dan, MA Bo, BU San-ping, SONG Rui-xia, WANG Yuan-zhi
- 新疆边境地区寄生蜱携带梨形虫情况调查
- Investigation on piroplasmas in on-host ticks in border area of Xinjiang Uygur Autonomous Region, China
- 中国媒介生物学及控制杂志, 2023, 34(4): 564-568
- Chin J Vector Biol & Control, 2023, 34(4): 564-568
- 10.11853/j.issn.1003.8280.2023.04.022
-
文章历史
- 收稿日期: 2023-02-10
2 石河子大学医学院, 新疆 石河子 832003
2 School of Medicine, Shihezi University, Shihezi, Xinjiang 832003, China
梨形虫(Piroplasma)属顶复门(Apicomplexa)、孢子虫纲(Sporozoa)、梨形虫目(Piroplasmida),梨形虫病在世界各地流行,死亡率高,给畜牧业和国民经济造成重大损失。对人畜健康影响较大的蜱传寄生虫种类分别属于巴贝虫属(Babesia)和泰勒虫属(Thelieria)。巴贝虫病(babesiosis)和泰勒虫病(theileriosis)是经蜱传播,分别由巴贝虫属和泰勒虫属原虫寄生于哺乳动物红细胞内引起的人兽共患病。该病可引起多种脊椎动物发病,主要包括牛、羊、马等家畜和野生动物,偶尔也可感染人类[1]。到目前为止,已有105种巴贝虫被发现,硬蜱是其主要传播媒介[2]。新疆维吾尔自治区(新疆)地处中国西北边境,地理环境复杂多样,物种资源丰富,多样的生态环境和气候条件为蜱的生存创造有利条件,是我国蜱种丰富和蜱传疾病高发的省份,而与中国新疆毗邻的蒙古共和国、哈萨克斯坦共和国、吉尔吉斯坦共和国等国在蜱传疾病领域研究相对滞后。因此,开展该区域特别是边境地区的家畜体表寄生蜱携带梨形虫的调查研究,对该地区“人病兽防、关口前移”具有重要的疾病预警意义。
1 材料与方法 1.1 样品来源2018年9月-2021年9月,对新疆地区12个县(市)的家畜寄生蜱进行采集,将采集到的蜱送至石河子大学进行形态学和分子生物学鉴定。对鉴定后的蜱提取基因组DNA。从1 593份蜱基因组DNA中随机挑选浓度为50 ng/μl的DNA样本用于梨形虫检测。
1.2 主要试剂及仪器设备T-GRADIENT PCR仪购自美国Bio-Rad公司,Image Lab Version 3.0凝胶成像系统购自美国Bio-Rad公司,DYY-6B型电泳仪购自北京六一仪器厂,NanoDrop 2000紫外可见分光光度计购自美国Thermo Fisher Scientific公司。基因组DNA提取试剂盒购自Omega公司;普通琼脂糖凝胶DNA回收试剂盒购自天根生化科技有限公司;2×Taq PCR Master Mix、MarkerⅠ、MarkerⅡ、试剂盒购自北京全式金生物技术有限公司。
1.3 巴贝虫和泰勒虫基因的PCR检测根据参考文献[3-4]合成巴贝虫和泰勒虫基因引物,引物合成由上海祥音生物工程技术服务有限公司完成,目标基因为18S rRNA。PCR扩增体系均为25 μl:10×PCR buffer 2.4 μl,dNTP(10 mmol/L)2 μl,正、反向引物(20 μmol/L)各1 μl,模板DNA 1.5 μl,Taq DNA polymerase 0.6 μl,ddH2O 16.5 μl。巴贝虫基因扩增条件为:95 ℃ 5 min;95 ℃ 30 s,54 ℃ 30 s,72 ℃ 40 s,共40个循环;72 ℃ 5 min,目的片段约487 bp;泰勒虫基因扩增条件为:94 ℃ 30 s;94 ℃ 30 s,60 ℃ 40 s,72 ℃ 40 s,共35个循环;72 ℃ 7 min。目的片段为438 bp。PCR产物分别经1.5%琼脂糖凝胶电泳检测。
1.4 序列分析与遗传进化分析将巴贝虫和泰勒虫阳性PCR产物克隆送深圳华大基因股份有限公司进行测序。将序列放进DNAMAN 6.0.3.99软件和基于局部比对算法的搜索工具(Basic Local Alignment Search Tool,BLAST)中进行比对。
2 结果 2.1 蜱的鉴定及分类1 593只蜱经石河子大学形态学和分子生物学鉴定,发现蜱4属5种,分别为刻点血蜱(Haemaphysalis punctata)、草原革蜱(Dermacentor nuttalli)、边缘革蜱(D. marginatus)、亚洲璃眼蜱(Hyalomma asiaticum)和图兰扇头蜱(Rhipicephalus turanicus)。
2.2 梨形虫PCR扩增结果用BJ1-F/BN2-R和PIRO-F/PIRO-R两对引物分别扩增巴贝虫、泰勒虫18S rRNA基因;扩增出的产物经1.5%琼脂糖凝胶(1×TAE,pH 8.0)电泳后分别在相应位置出现了目的条带。
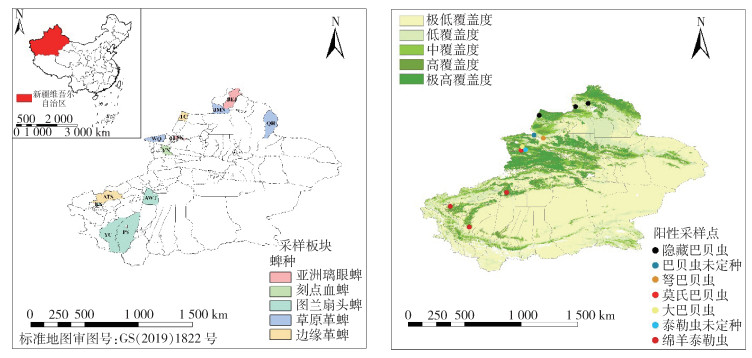
2.3 巴贝虫、泰勒虫核酸检测结果 2.3.1 各县(市)巴贝虫、泰勒虫核酸阳性率从1 593份蜱基因组DNA中共检测出36份巴贝虫、泰勒虫阳性核酸,梨形虫总阳性率为2.26%。各县(市)检出巴贝虫、泰勒虫的总阳性率最高为5.61%,检出最低阳性率为1.33%,青河、温泉县和阿图什市3地未检出。各县(市)巴贝虫、泰勒虫核酸检出情况见表 1和图 1。
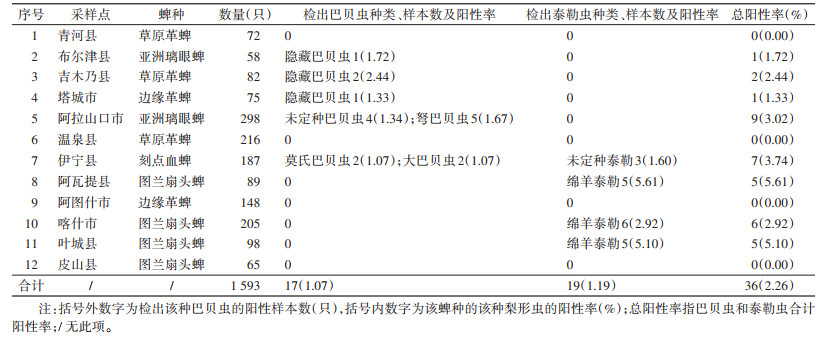
|
|
| 注:左图中,QH清河县,BEJ布尔津县,JMN吉木乃县,TC塔城市,ALSK阿拉山口市,WQ温泉县,YN伊宁市县,AWT阿瓦提县,ATS阿图什市,KS喀什市,YC叶城县,PS皮山县。 图 1 新疆维吾尔自治区12个县(市)巴贝虫和泰勒虫的分布 Figure 1 Distribution of Babesia spp. and Theileria spp. in 12 counties/cities of Xinjiang Uygur Autonomous Region, China |
| |
将测序结果在DNAMAN软件中进行比对,共检出5种巴贝虫和2种泰勒虫核酸,分别为4份隐藏巴贝虫、4份未定种巴贝虫、5份弩巴贝虫、2份莫氏巴贝虫、2份大巴贝虫核酸和3份未定种泰勒虫、16份绵阳泰勒虫核酸。
2.3.3 巴贝虫、泰勒虫遗传进化分析根据18S rRNA基因的2个不同片段构建巴贝虫、泰勒虫核酸系统发育树。该系统发育树显示:新疆的隐藏巴贝虫核酸与土耳其已经发现的隐藏巴贝虫同源性为97%;未定种巴贝虫核酸与我国另1未定种巴贝虫亲缘关系最近,同源性达97%;大巴贝虫核酸与我国和法国的大巴贝虫遗传关系均较远,同源性仅有62%。莫氏巴贝虫核酸和弩巴贝虫核酸与参考序列同源性为100%;绵羊泰勒虫核酸与参考序列同源性为99%;未定种泰勒虫核酸与参考序列遗传关系均较远。见图 2。
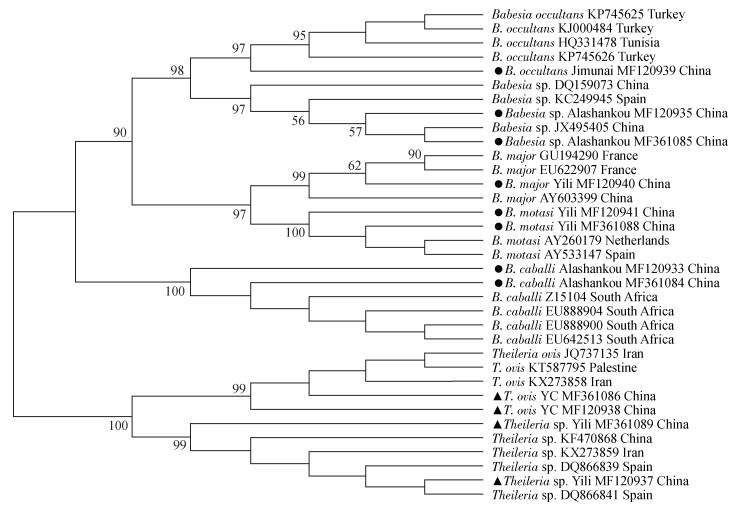
|
| 注:●本研究检测到的巴贝虫;▲本研究检测到的泰勒虫。 图 2 新疆维吾尔自治区边境地区蜱中巴贝虫和泰勒虫基于18S rRNA基因序列的系统进化分析 Figure 2 Phylogenic analysis of Babesia spp. and Theileria spp. in ticks collected from Xinjiang Uygur Autonomous Region based on 18S rRNA gene sequences |
| |
弩巴贝虫呈世界性分布,在美洲、非洲、亚洲、欧洲、大洋洲均有其相关报道[5]。2018年,Song等[6]研究表明,革蜱属、璃眼蜱属和扇头蜱属是弩巴贝虫的传播媒介。2021年李敏等[7]在新疆和静和昭苏县的森林革蜱(D. silvarum)和草原革蜱中检测到弩巴贝虫核酸,感染率高达28%。2022年仇晓飞等[8]从森林革蜱、草原革蜱、边缘革蜱及亚洲璃眼蜱中检测到弩巴贝虫核酸。在本次研究中,弩巴贝虫核酸从阿拉山口市的亚洲璃眼蜱中检出,未发现新感染蜱种;同时,阿拉山口市的亚洲璃眼蜱中存在不同的巴贝虫种类(弩巴贝虫核酸和未定种巴贝虫核酸)混合感染的情况。由此推断亚洲璃眼蜱可能是巴贝虫潜在的传播媒介。
隐藏巴贝虫核酸首次出现在南非和尼日利亚,其次是欧洲(例如罗马尼亚)和非洲(突尼斯)[9-12]。在土耳其的图兰扇头蜱和边缘璃眼蜱(Hy. marginatum)中发现了隐藏巴贝虫[13]。2016年首次在新疆中哈边境阿拉山口亚洲璃眼蜱虫检测到隐藏巴贝虫核酸[14]。2018年首次在新疆吉木乃县草原革蜱中检测到隐藏巴贝虫核酸[6],张峰等[15]在小亚璃眼蜱(Hy. anatolicum)中检测到了隐藏巴贝虫核酸。2022年仇晓飞等[8]在新疆阿图什小亚璃眼蜱和富蕴县采集的亚洲璃眼蜱中检测到隐藏巴贝虫核酸。本试验在亚洲璃眼蜱、草原革蜱和边缘革蜱中均检测到了该种巴贝虫。这一发现增加了隐藏巴贝虫的分布范围和潜在传播媒介。
莫氏巴贝虫不仅是一种感染羊的重要蜱传播性梨形虫,而且可感染人,其传播媒介主要为刻点血蜱和囊形扇头蜱(R. bursa)[16]。莫氏巴贝虫于2000年4月从西藏自治区甘南地区采集的青海血蜱(H. qinghaiensis)中首次分离出来[17]。2016年中国首次报道森林革蜱、全沟硬蜱(Ixodes persulcatus)和血红扇头蜱(R. sanguineus)感染类莫氏巴贝虫(B. motasi-like)[18]。2018年有报道从刻点血蜱中检测出莫氏巴贝虫核酸[6],本次在新疆伊宁县刻点血蜱中也检测出莫氏巴贝虫核酸。值得注意的是,伊宁县刻点血蜱中检测出2种巴贝虫核酸和1种泰勒虫核酸。
绵羊泰勒虫和未定种泰勒虫寄生于反刍动物(例如山羊和绵羊)后都会造成严重的经济损失[19]。在伊朗首次报道了从血红扇头蜱中检测出绵羊泰勒虫核酸阳性[20]。2014年Abedi等[21]在伊朗的马血和硬蜱中都检测到了同种泰勒虫——马泰勒虫(T. equi)核酸阳性,提示蜱在泰勒虫传播中可能发挥了重要作用。2011年Li等[22]报道绵羊泰勒虫在我国的传播媒介为小亚璃眼蜱。,仇晓飞等[8]在血红扇头蜱、刻点血蜱及麻点璃眼蜱(Hy. rufipes)中检测到绵羊泰勒虫核酸,本试验在新疆叶城县、喀什市和阿瓦提县的图兰扇头蜱中检测出绵羊泰勒虫核酸。Wang等[23]研究证实了新疆地区的优势蜱种主要是刻点血蜱和图兰扇头蜱。提示绵羊泰勒虫可能成为新疆地区主要的泰勒虫种类之一。
新疆位于中国西北边陲,与八国接壤,是“一带一路”的重要纽带。鉴于其特殊的地理位置和生态类型,这里畜牧业贸易往来频繁,野生动物种类和数量众多,寄生虫分布也相对丰富,蚊、蝇、蜱和蚤等重要媒介生物种类繁多。而新疆边境口岸地区人口及牲畜密集,在蜱媒病原的传播模式上,多种动物都能成为蜱的生物载体,依靠宿主动物的活动而不断扩大寄生范围,比如动物远距离的迁徙,通过这种动物携带迁移的途径将带有疫病的蜱转移至新的地域,从而引发产生更大范围的疫区。本次调查结果显示新疆边境地区家畜寄生蜱梨形虫平均感染率为2.26%,感染率较低,但存在蜱跨区传播疾病的风险。此外,新疆野生动物资源丰富,在做好家畜寄生蜱调查研究的同时,也要对野生动物寄生蜱进行调查研究,加强新疆地区因牲畜贸易和野生动物迁徙引起梨形虫病的监测、防治。
利益冲突 无
| [1] |
Krause PJ. Human babesiosis[J]. Int J Parasitol, 2019, 49(2): 165-174. DOI:10.1016/j.ijpara.2018.11.007 |
| [2] |
Vannier E, Krause PJ. Babesiosis[M]//Ryan ET, Hill DR, Solomon T, et al. Hunter's tropical medicine and emerging infectious diseases. 10th ed. Amsterdam: Elsevier, 2020: 799-802. DOI: 10.1016/B978-0-323-55512-8.00105-8.
|
| [3] |
Farkas R, Takács N, Hornyák Á, et al. First report on Babesia cf. microti infection of red foxes (Vulpes vulpes) from Hungary[J]. Parasit Vectors, 2015, 8(1): 55. DOI:10.1186/s13071-015-0660-5 |
| [4] |
Sun Y, Liu GP, Yang LW, et al. Multiple infections of tick-borne pathogens in Ixodes persulcatus collected from forests in Heilongjiang province[J]. Acta Parasitol Med Entomol Sin, 2007, 14(4): 231-240. DOI:10.3969/j.issn.1005-0507.2007.04.008 |
| [5] |
张杨, 达伊力特, 刘进, 等. 弩巴贝虫二温式PCR检测方法的建立及初步应用[J]. 动物医学进展, 2014, 35(6): 16-20. Zhang Y, Dayilite, Liu J, et al. Establishment and application of two-temperature PCR for Babesia caballi detection[J]. Prog Vet Med, 2014, 35(6): 16-20. DOI:10.16437/j.cnki.1007-5038.2014.06.030 |
| [6] |
Song R, Wang Q, Guo F, et al. Detection of Babesia spp., Theileria spp. and Anaplasma ovis in border regions, northwestern China[J]. Transbound Emerg Dis, 2018, 65(6): 1537-1544. DOI:10.1111/tbed.12894 |
| [7] |
李敏, 呼尔查, 党娜娜, 等. 新疆2种优势革蜱携带马梨形虫和饶氏立克次体病原的检测[J]. 中国兽医杂志, 2021, 57(1): 68-71, 76. Li M, Hu EC, Dang NN, et al. Detection of two dominant Dermacentor spp. carrying Theileria equi, Babesia caballi and Rickettsia raoultii in Xinjiang[J]. Chin J Vet Med, 2021, 57(1): 68-71, 76. |
| [8] |
仇晓飞, 林汉亮, 罗金, 等. 新疆边境地区蜱携带梨形虫种类的分子鉴定[J]. 动物医学进展, 2022, 43(1): 31-37. Qiu XF, Lin HL, Luo J, et al. Molecular identification of piroplasma in ticks of Xinjiang border areas[J]. Prog Vet Med, 2022, 43(1): 31-37. DOI:10.3969/j.issn.1007-5038.2022.01.006 |
| [9] |
Dipeolu OO, Amoo A. The presence of kinetes of a Babesia species in the haemolymph smears of engorged Hyalomma ticks in Nigeria[J]. Vet Parasitol, 1984, 17(1): 41-46. DOI:10.1016/0304-4017(84)90063-3 |
| [10] |
Gray JS, De Vos AJ. Studies on a bovine Babesia transmitted by Hyalomma marginatum rufipes Koch, 1844[J]. Onderstepoort J Vet Res, 1981, 48(4): 215-223. |
| [11] |
Ionita M, Mitrea IL, Pfister K, et al. Molecular evidence for bacterial and protozoan pathogens in hard ticks from Romania[J]. Vet Parasitol, 2013, 196(1/2): 71-76. DOI:10.1016/j.vetpar.2013.01.016 |
| [12] |
Ros-García A, M'Ghirbi Y, Bouattour A, et al. First detection of Babesia occultans in Hyalomma ticks from Tunisia[J]. Parasitology, 2011, 138(5): 578-582. DOI:10.1017/S0031182011000060 |
| [13] |
Aktas M, Vatansever Z, Ozubek S. Molecular evidence for trans-stadial and transovarial transmission of Babesia occultans in Hyalomma marginatum and Rhipicephalus turanicus in Turkey[J]. Vet Parasitol, 2014, 204(3/4): 369-371. DOI:10.1016/j.vetpar.2014.05.037 |
| [14] |
罗丹, 尹小平, 王安东, 等. 中国和哈萨克斯坦边境阿拉山口口岸蜱中首次检测到巴贝斯虫核酸[J]. 中华地方病学杂志, 2016, 35(9): 633-635. Luo D, Yin XP, Wang AD, et al. The first detection of Babesia genotype from tick at Alataw Pass, China-Kazakhstan border[J]. Chin J Endemiol, 2016, 35(9): 633-635. DOI:10.3760/cma.j.issn.2095-4255.2016.09.003 |
| [15] |
张峰, 王正荣, 蒋建军, 等. 新疆小海子垦区媒介蜱及其携带梨形虫种类鉴定[J]. 动物医学进展, 2022, 43(3): 129-132. Zhang F, Wang ZR, Jiang JJ, et al. Identification of ticks and piroplasma carried by ticks in Xiaohaizi reclamation area of Xinjiang[J]. Prog Vet Med, 2022, 43(3): 129-132. DOI:10.16437/j.cnki.1007-5038.2022.03.019 |
| [16] |
Sun Y, Liu GP, Yang LW, et al. Babesia microti-like rodent parasites isolated from Ixodes persulcatus (Acari: Ixodidae) in Heilongjiang province, China[J]. Vet Parasitol, 2008, 156(3/4): 333-339. DOI:10.1016/j.vetpar.2008.05.026 |
| [17] |
Wang JM, Ma ML, Liu AH, et al. A sero-epidemiological survey of Chinese Babesia motasi for small ruminants in China[J]. Parasitol Res, 2013, 112(6): 2387-2391. DOI:10.1007/s00436-013-3310-x |
| [18] |
Niu QL, Liu ZJ, Yang JF, et al. Genetic diversity and molecular characterization of Babesia motasi-like in small ruminants and ixodid ticks from China[J]. Infect Genet Evol, 2016, 41: 8-15. DOI:10.1016/j.meegid.2016.03.007 |
| [19] |
Zhou M, Cao SN, Sevinc F, et al. Molecular detection and genetic characterization of Babesia, Theileria and Anaplasma amongst apparently healthy sheep and goats in the central region of Turkey[J]. Ticks Tick-Borne Dis, 2017, 8(2): 246-252. DOI:10.1016/j.ttbdis.2016.11.006 |
| [20] |
Zakkyeh T, Mohammad Ali O, Nasibeh HV, et al. First molecular detection of Theileria ovis in Rhipicephalus sanguineus tick in Iran[J]. Asian Pac J Trop Med, 2012, 5(1): 29-32. DOI:10.1016/S1995-7645(11)60240-X |
| [21] |
Abedi V, Razmi G, Seifi H, et al. Molecular and serological detection of Theileria equi and Babesia caballi infection in horses and ixodid ticks in Iran[J]. Ticks Tick-Borne Dis, 2014, 5(3): 239-244. DOI:10.1016/j.ttbdis.2013.11.008 |
| [22] |
Li YQ, Guan GQ, Ma ML, et al. Theileria ovis discovered in China[J]. Exp Parasitol, 2011, 127(1): 304-307. DOI:10.1016/j.exppara.2010.07.002 |
| [23] |
Wang YZ, Mu LM, Zhang K, et al. A broad-range survey of ticks from livestock in Northern Xinjiang: Changes in tick distribution and the isolation of Borrelia burgdorferi sensu stricto[J]. Parasit Vectors, 2015, 8: 449. DOI:10.1186/s13071-015-1021-0 |
 2023, Vol. 34
2023, Vol. 34


