扩展功能
文章信息
- 张晨曦, 武少卿, 刘洋, 刘芳, 王宇, 范蒙光, 李建云
- ZHANG Chen-xi, WU Shao-qing, LIU Yang, LIU Fang, WANG Yu, FAN Meng-guang, LI Jian-yun
- 内蒙古自治区森林革蜱感染立克次体、无形体及埃立克体的研究
- An analysis of Rickettsia, Anaplasma, and Ehrlichia infections in Dermacentor silvarum in Inner Mongolia Autonomous Region, China
- 中国媒介生物学及控制杂志, 2023, 34(4): 559-563
- Chin J Vector Biol & Control, 2023, 34(4): 559-563
- 10.11853/j.issn.1003.8280.2023.04.021
-
文章历史
- 收稿日期: 2023-03-02
2 乌兰察布市疾病预防控制中心, 内蒙古 乌兰察布 012000;
3 包头医学院, 内蒙古 包头 014000;
4 内蒙古自治区综合疾病预防控制中心, 内蒙古 呼和浩特 010031;
5 内蒙古农业大学, 内蒙古 呼和浩特 010018
2 Ulanqab Center for Disease Prevention and Control, Ulanqab, Inner Mongolia 012000, China;
3 Baotou Medical College, Baotou, Inner Mongolia 014000, China;
4 Inner Mongolia Center for Comprehensive Disease Prevention and Control, Hohhot, Inner Mongolia 010031, China;
5 Inner Mongolia Agricultural University, Hohhot, Inner Mongolia 010018, China
立克次体、无形体和埃立克体均是革兰阴性细胞内共生菌,是重要的蜱传病原体。立克次体属于立克次体目、立克次体科,其中斑疹伤寒群和斑点热群立克次体包含了多个重要人类病原体。斑疹伤寒群主要包括普氏立克次体(Rickettsia prowazekii)和莫氏立克次体(R. typhi),可分别引起流行性斑疹伤寒和地方性斑疹伤寒[1]。而斑点热群立克次体是立克次体属中最大的类群,可引起落基山斑点热、日本斑点热、地中海斑点热、非洲蜱咬热等多种疾病[1]。此外,一些其他类群的立克次体也可感染人,如猫立克次体(R. felis)、塔拉塞维奇立克次体(R. tarasevichiae)等[2-3]。无形体和埃立克体都属于立克次体目、无形体科,包括多种动物病原体,如感染牛的边缘无形体(Anaplasma marginale)、中央无形体(A. centrale)、牛无形体(A. bovis)和米纳斯埃立克体(Ehrlichia minasensis),感染犬类的犬埃立克体(E. canis)等[4-5],给畜牧业造成巨大经济损失。同时,多种无形体和埃立克体可感染人,如嗜吞噬细胞无形体(A. phagocytophilum)可引起人粒细胞无形体病(human granulocytic anaplasmosis,HGA),查菲埃立克体(E. chaffeensis)可引起人单核细胞埃立克体病(human monocytotropic ehrlichiosis,HME)等[6]。近些年,无形体属和埃立克体属一些新发的人类病原体也陆续被发现,如2015年Li等[7]报道了我国东北地区一种可感染人的无形体新种——山羊无形体(A. capra),可引起发热、头痛、倦怠等一系列症状。
蜱是斑点热群立克次体的主要自然宿主和传播媒介[3],同时也可携带和传播多种埃立克体和无形体。内蒙古自治区(内蒙古)地处我国北方,面积约1 183 000 km2,目前已有多个关于内蒙古地区蜱携带立克次体等病原体的报道[8-11]。然而,以上报道多数仅限于PCR检测,并未进行深入的多基因分析、遗传进化分析和分型。本研究从内蒙古四子王旗和土默特左旗采集当地优势蜱种森林革蜱(Dermacentor silvarum),检测其携带立克次体、埃立克体和无形体情况,并对其关键基因进行了遗传进化分析。
1 材料与方法 1.1 材料2021-2022年,分别从内蒙古呼和浩特市土默特左旗(经度111°13′,纬度40°57′)和乌兰察布市四子王旗(经度111°20′,纬度41°53′)家畜体表采集寄生蜱。重点检察家畜耳部、面部、腋窝、腹股沟等部位,使用金属镊子夹住蜱,顺着叮咬方向轻轻拔出。经对蜱盾板、须肢、颚基等部位进行形态学鉴定后,初步确定蜱种,并置于-40 ℃冰箱保存。
1.2 方法 1.2.1 DNA提取和蜱种分子生物学鉴定将蜱样本单个提取DNA。用磷酸盐缓冲液(PBS)清洗3次后,用研钵充分研磨。用Omega Mollusc DNA Kit试剂盒按照说明书操作提取DNA,置于-40 ℃冰箱保存。
为对形态学鉴定结果进行确认,使用文献报道的LCO1490和HCO2198引物[5],从四子王旗和土默特左旗的蜱DNA中各随机选取5份,PCR扩增其细胞色素C氧化酶亚基Ⅰ(COⅠ)基因序列。PCR产物送生工生物工程(上海)股份有限公司测序,测序结果用BLAST程序(https://blast.ncbi.nlm.nih.gov/Blast.cgi)与数据库中已知序列进行比对。
1.2.2 立克次体、埃立克体和无形体PCR检测立克次体属选择16S rRNA和柠檬酸合成酶基因(gltA)同时作为目标基因,埃立克体属和无形体属选择16S rRNA序列为目标基因,采用半巢式PCR,分别用文献报道的属特异性引物扩增该基因保守区域[5, 12]。使用Sensoquest PCR System LabCycler PCR扩增仪,反应用试剂为大连TaKaRa公司产品。具体反应条件见表 1。
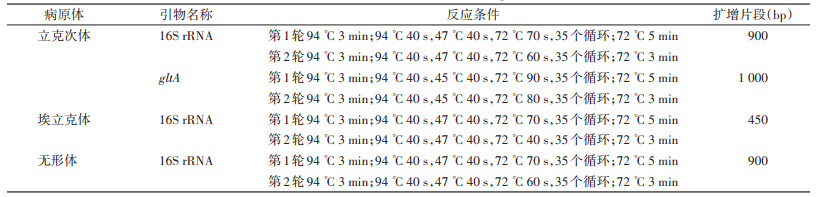
|
PCR完成后,取5 μl PCR产物用1.0%凝胶电泳10 min,用紫外凝胶成像仪观察条带情况,将符合预期条带大小的阳性样本送生工生物工程(上海)股份有限公司测序。
1.3 关键基因扩增挑选出获得的阳性样本,分别用文献报道的热休克蛋白基因(groEL)及16S rRNA或gltA基因引物对其关键基因进行扩增[5, 12]。
1.4 同源性分析和进化树构建将测序获得的DNA序列用DNAStar软件进行拼接,随后用BLAST程序与数据库中已知序列进行比对。同时从GenBank数据库中下载代表性菌株的16S rRNA、gltA和groEL序列作为参考序列,与本研究获得的代表性序列一起,用MEGA 6.0软件中的Clustal W进行比对。用PhyML 3.0软件进行最大似然法(maximum likelihood method,ML法)进化树构建。
2 结果 2.1 样本采集、核酸提取和蜱种鉴定2021年4月,从内蒙古呼和浩特市土默特左旗的山羊体表采集寄生蜱41只;2022年5月,从内蒙古乌兰察布市四子王旗的骆驼体表采集寄生蜱35只。经形态学鉴定均为森林革蜱成蜱,且均为饱血状态。用试剂盒提取DNA,使用50 μl缓冲液进行洗脱。PCR扩增获得的COⅠ序列结果显示均与GenBank中的森林革蜱同源性 > 99.0%,确定为森林革蜱。
2.2 立克次体、埃立克体和无形体PCR检测及关键基因扩增结合16S rRNA和gltA基因PCR产物的电泳及测序结果,四子王旗的35份蜱中立克次体阳性6份(16S rRNA阳性6份,gltA阳性5份),阳性率为17.14%(6/35);土默特左旗的41份蜱中立克次体阳性2份(16S rRNA阳性1份,gltA阳性2份),阳性率为4.88%(2/41)。选取全部阳性样本,扩增groEL基因,其中土默特左旗的2份阳性均获得groEL序列,四子王旗的6份阳性中有4份获得groEL序列。电泳结果显示,四子王旗的35份蜱和土默特左旗的41份蜱中埃立克体和无形体均为阴性。
2.3 遗传分析与系统进化分析将上述获得的立克次体16S rRNA、gltA及groEL基因序列,用BLAST进行比对,同时用PhyML 3.0软件构建进化树。对16S rRNA序列分析可见,四子王旗的Siziwang7、Siziwang8、Siziwang11菌株及土默特左旗的Tumote8菌株序列100%相同,与劳氏立克次体的标准株(R. raoultii strain Khabarovsk)及IM16株(R. raoultii strain IM16)、BMIE株(R. conorii subsp. raoultii strain BIME)等同源性均为100%。而四子王旗的Siziwang5、Siziwang6、Siziwang26菌株序列100%相同,与劳氏立克次体Tomsk株(R. raoultii isolate Tomsk)及埃氏立克次体R. aeschlimannii、康氏立克次体Malish 7株(R. conorii strain Malish 7)、马赛立克次体BC株(R. massiliae isolate BC)等同源性为100%。两组立克次体的16S rRNA序列存在2个核苷酸的差异。进化分析可见,以上2组立克次体在16S rRNA基因进化树上分成2个截然不同的分支,与BLAST结果一致。见图 1A。
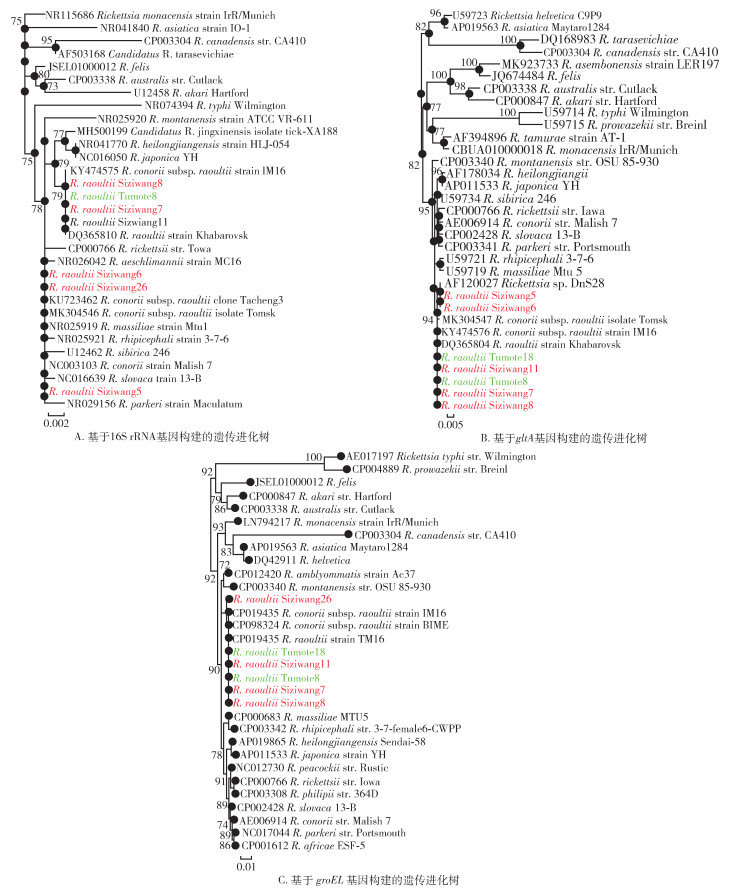
|
| 注:红色和绿色部分为本研究获得的阳性菌株;gltA柠檬酸合成酶基因;groEL热休克蛋白基因。 图 1 内蒙古森林革蜱携带立克次体遗传分析与系统进化分析 Figure 1 Genetic analysis and phylogenetic analysis of Rickettsia borned by Dermacentor silvarum in Inner Mongolia, China |
| |
gltA基因分析结果与16S rRNA基因较为一致。四子王旗的Siziwang7、Siziwang8和Siziwang11菌株及土默特左旗的Tumote8、Tumote18菌株之间序列完全相同,与劳氏立克次体标准株及IM16株同源性均为100%。而四子王旗的Siziwang5、Siziwang6菌株间序列相同,与劳氏立克次体标准株及IM16株的最高同源性均为99.8%。以上2组立克次体在gltA基因进化树上也显示出一定的距离。见图 1B。
与16S rRNA和gltA基因不同,本研究获得的所有groEL基因均无差异,序列间同源性为100%。BLASTN显示均与劳氏立克次体标准株、IM16株及BIME株同源性为100%。见图 1C。
根据以上分析结果,四子王旗和土默特左旗的森林革蜱中检出的立克次体均为劳氏立克次体,但存在一定的遗传多样性。
3 讨论森林革蜱广泛分布于我国北方的内蒙古、黑龙江、新疆等省(自治区),以及俄罗斯、蒙古国等地[13]。森林革蜱同时也是我国的优势蜱种之一,目前已在我国的274个县(区)有报道,影响的人口数可能多达9 620万人。森林革蜱的主要宿主包括山羊、绵羊、牛等家畜,也可叮咬人类,是重要的传染病病原体媒介。目前已报道的森林革蜱传播的病原体包括发热伴血小板减少综合征病毒、蜱传脑炎病毒、嗜吞噬细胞无形体、查菲埃立克体、西伯利亚立克次体、黑龙江立克次体、塔拉塞维奇立克次体、劳氏立克次体等[14]。其中劳氏立克次体又称康氏立克次体劳氏亚型,是2008年Mediannikov等[15]首次在欧洲和俄罗斯的革蜱中分离和命名的一种斑点热群立克次体。随后在哈萨克斯坦、蒙古国及我国的山西、甘肃、云南等地也有发现[16-19],提示该立克次体有广泛的地理分布。2006年在西班牙蜱叮咬后产生焦痂和颈部淋巴结病变的病例中检出的未分型立克次体为劳氏立克次体,这是其首次感染人的报道[20]。2018年,Li等[21]在我国的河南信阳、内蒙古牙克石、山东泰安3地的病例中均检测到劳氏立克次体,主要症状表现为发热、不适、肌痛、淋巴结肿大等,表明这一病原体在我国人群中的感染可能较为普遍。
本研究在我国内蒙古地区2个地级市的2个县均检出了劳氏立克次体,阳性率分别为17.14%和4.88%。根据2015-2016年报道,在内蒙古西部地区采集的亚东璃眼蜱(Hyalomma asiaticum kozlovi)和草原革蜱(D. nuttalli)中劳氏立克次体阳性率可分别高达15.4%和58.5%[22]。而本研究检测到的阳性率相对较低,可能与地理区域和宿主不同有关,也可能是由于采样量少不能反映当地蜱中的真实携带或感染情况所致。此外,由于劳氏立克次体曾被报道在马、犬等哺乳动物的血液中检出[23-24],而本研究所检测森林革蜱均为饱血蜱,不排除本研究检出的立克次体是来自蜱所吸动物血液的可能。尽管如此,本研究揭示了四子王旗和土默特左旗草原革蜱中劳氏立克次体的存在,进一步表明该立克次体在内蒙古的蜱中可能存在广泛分布和流行。据文献报道,劳氏立克次体的主要宿主是革蜱,其在内蒙古地区的广泛分布可能与宿主革蜱在内蒙古的分布密切相关[25]。由于劳氏立克次体是人类病原体且森林革蜱叮咬人,有必要对当地的农业、畜牧业等风险人群开展相应监测工作。
更为重要的是,本研究发现基于16S rRNA序列和gltA序列,在四子王旗检出的劳氏立克次体存在一定的核苷酸差异性,可分为2个不同的进化分支。这表明劳氏立克次体在这一地区可能已存在长期的进化,不同分支上菌株的致病性是否有差异有待研究。与此同时,检出的所有groEL基因并未发现差异。这一现象存在2种可能:(1)groEL基因在进化中比16S rRNA和gltA基因更为保守。(2)16S rRNA和gltA基因的差异是由不同菌株间的基因重组引起。具体原因尚有待进一步研究。
利益冲突 无
| [1] |
Gillespie JJ, Williams K, Shukla M, et al. Rickettsia phylogenomics: Unwinding the intricacies of obligate intracellular life[J]. PLoS One, 2008, 3(4): e2018. DOI:10.1371/journal.pone.0002018 |
| [2] |
Parola P, Musso D, Raoult D. Rickettsia felis: The next mosquito-borne outbreak?[J]. Lancet Infect Dis, 2016, 16(10): 1112-1113. DOI:10.1016/S1473-3099(16)30331-0 |
| [3] |
Rudakov N, Samoylenko I, Shtrek S, et al. A fatal case of tick-borne rickettsiosis caused by mixed Rickettsia sibirica subsp. sibirica and "Candidatus Rickettsia tarasevichiae" infection in Russia[J]. Ticks Tick Borne Dis, 2019, 10(6): 101278. DOI:10.1016/j.ttbdis.2019.101278 |
| [4] |
Zhao HQ, Liu PP, Xue F, et al. Molecular detection and identification of Candidatus ehrlichia hainanensis, a novel Ehrlichia species in rodents from Hainan province, China[J]. Biomed Environ Sci, 2021, 34(12): 1020-1023. DOI:10.3967/bes2021.138 |
| [5] |
Lu M, Tian JH, Zhao HQ, et al. Molecular survey of vector-borne pathogens in ticks, sheep keds, and domestic animals from Ngawa, Southwest China[J]. Pathogens, 2022, 11(5): 606. DOI:10.3390/pathogens11050606 |
| [6] |
Ismail N, McBride JW. Tick-borne emerging infections: Ehrlichiosis and anaplasmosis[J]. Clin Lab Med, 2017, 37(2): 317-340. DOI:10.1016/j.cll.2017.01.006 |
| [7] |
Li H, Zheng YC, Ma L, et al. Human infection with a novel tick-borne Anaplasma species in China: A surveillance study[J]. Lancet Infect Dis, 2015, 15(6): 663-670. DOI:10.1016/S1473-3099(15)70051-4 |
| [8] |
盛悦, 邓华, 高艳菲, 等. 2019-2020年内蒙古部分地区蜱携带斑点热群立克次体的调查[J]. 中国国境卫生检疫杂志, 2021, 44(3): 168-170. Sheng Y, Deng H, Gao YF, et al. Investigation on spotted fever group rickettsiae in ticks collected at part regions of Inner Mongolia, 2019-2020[J]. Chin J Front Health Quarant, 2021, 44(3): 168-170. DOI:10.16408/j.1004-9770.2021.03.005 |
| [9] |
范明远, Walker DH, 刘清淮, 等. 从内蒙呼盟完工地区病人及蜱卵中首次分离出蜱传斑点热群立克次体[J]. 中华流行病学杂志, 1985, 6(6): 346. Fan MY, Walker DH, Liu QH, et al. Rickettsia tick-borne spotted fever group was isolated for the first time from patients and tick eggs in the completed area of Humeng, Inner Mongolia[J]. Chin J Epidemiol, 1985, 6(6): 346. |
| [10] |
乌兰图雅, 高娃, 殷旭红, 等. 内蒙古西部地区蜱虫种类与立克次体携带情况的相关性研究[J]. 现代预防医学, 2018, 45(11): 2059-2062, 2072. Wulan TY, Gao W, Yin XH, et al. Correlation of tick species and rickettsia carrying situation in western Inner Mongolia[J]. Mod Prev Med, 2018, 45(11): 2059-2062, 2072. |
| [11] |
陆苗, 覃新程. 内蒙古自治区牙克石市全沟硬蜱携带立克次体的研究[J]. 疾病监测, 2021, 36(3): 276-279. Lu M, Qin XC. Studying of rickettsiae carried by Ixodes persulcatus in Yakeshi city, Inner Mongolia[J]. Dis Surveill, 2021, 36(3): 276-279. DOI:10.3784/jbjc.202010230364 |
| [12] |
Guo WP, Tian JH, Lin XD, et al. Extensive genetic diversity of Rickettsiales bacteria in multiple mosquito species[J]. Sci Rep, 2016, 6: 38770. DOI:10.1038/srep38770 |
| [13] |
刘凯, 姚晓燕, 寸得娇, 等. 气候环境因子对我国森林革蜱适生区的影响研究[J]. 中国媒介生物学及控制杂志, 2021, 32(6): 732-735. Liu K, Yao XY, Cun DJ, et al. Effects of climatic and environmental factors on the potential geographic distribution of Dermacentor silvarum in China[J]. Chin J Vector Biol Control, 2021, 32(6): 732-735. DOI:10.11853/j.issn.1003.8280.2021.06.015 |
| [14] |
Zhao GP, Wang YX, Fan ZW, et al. Mapping ticks and tick-borne pathogens in China[J]. Nat Commun, 2021, 12(1): 1075. DOI:10.1038/s41467-021-21375-1 |
| [15] |
Mediannikov O, Matsumoto K, Samoylenko I, et al. Rickettsia raoultii sp. nov., a spotted fever group rickettsia associated with Dermacentor ticks in Europe and Russia[J]. Int J Syst Evol Microbiol, 2008, 58(Pt 7): 1635-1639. DOI:10.1099/ijs.0.64952-0 |
| [16] |
Guo WP, Wang YH, Lu QZ, et al. Molecular detection of spotted fever group rickettsiae in hard ticks, northern China[J]. Transbound Emerg Dis, 2019, 66(4): 1587-1596. DOI:10.1111/tbed.13184 |
| [17] |
Liu H, Liang XT, Wang HJ, et al. Molecular evidence of the spotted fever group rickettsiae in ticks from Yunnan province, Southwest China[J]. Exp Appl Acarol, 2020, 80(3): 339-348. DOI:10.1007/s10493-020-00467-5 |
| [18] |
Fischer T, Myalkhaa M, Krücken J, et al. Molecular detection of tick-borne pathogens in bovine blood and ticks from Khentii, Mongolia[J]. Transbound Emerg Dis, 2020, 67 Suppl 2: 111-118. DOI:10.1111/tbed.13315 |
| [19] |
Wagner E, Tukhanova N, Shin A, et al. Incidence of tick-borne spotted fever group Rickettsia species in rodents in two regions in Kazakhstan[J]. Sci Rep, 2022, 12(1): 14872. DOI:10.1038/s41598-022-19145-0 |
| [20] |
Ibarra V, Oteo JA, Portillo A, et al. Rickettsia slovaca infection: DEBONEL/TIBOLA[J]. Ann N Y Acad Sci, 2006, 1078(1): 206-214. |
| [21] |
Li H, Zhang PH, Huang Y, et al. Isolation and identification of Rickettsia raoultii in human cases: A surveillance study in 3 medical centers in China[J]. Clin Infect Dis, 2018, 66(7): 1109-1115. DOI:10.1093/cid/cix917 |
| [22] |
Yin XH, Guo SC, Ding CL, et al. Spotted fever group rickettsiae in Inner Mongolia, China, 2015-2016[J]. Emerg Infect Dis, 2018, 24(11): 2105-2107. DOI:10.3201/eid2411.162094 |
| [23] |
Shao JW, Yao XY, Song XD, et al. Molecular detection and genetic diversity of Rickettsia spp. in pet dogs and their infesting ticks in Harbin, northeastern China[J]. BMC Vet Res, 2021, 17(1): 113. DOI:10.1186/s12917-021-02823-y |
| [24] |
Chang QC, Hu Y, Wu TT, et al. The role of ranged horses in eco-epidemiology of Rickettsia raoultii infection in China[J]. Front Microbiol, 2022, 12: 795500. DOI:10.3389/fmicb.2021.795500 |
| [25] |
Földvári G, Rigó K, Lakos A. Transmission of Rickettsia slovaca and R. raoultii by male Dermacentor marginatus and D. reticulatus ticks to humans[J]. Diagn Microbiol Infect Dis, 2013, 76(3): 387-389. DOI:10.1016/j.diagmicrobio.2013.03.005 |
 2023, Vol. 34
2023, Vol. 34


