扩展功能
文章信息
- 刘雷杰, 王宇超, 应峥, 李世波, 舒纪为, 王忠发, 王蓉, 张森
- LIU Lei-jie, WANG Yu-chao, YING Zheng, LI Shi-bo, SHU Ji-wei, WANG Zhong-fa, WANG Rong, ZHANG Sen
- 浙江省舟山市一起疑似钩端螺旋体病疫情及其流行病学调查
- An epidemiological investigation of a suspected leptospirosis epidemic in Zhoushan, Zhejiang Province, China
- 中国媒介生物学及控制杂志, 2023, 34(4): 518-522
- Chin J Vector Biol & Control, 2023, 34(4): 518-522
- 10.11853/j.issn.1003.8280.2023.04.014
-
文章历史
- 收稿日期: 2023-03-06
2 浙江省舟山医院, 浙江 舟山 316021;
3 岱山县疾病预防控制中心, 浙江 舟山 316200;
4 宁波市疾病预防控制中心病毒研究所, 浙江 宁波 315010;
5 舟山市定海区疾病预防控制中心, 浙江 舟山 316000
2 Zhoushan Hospital of Zhejiang Province, Zhoushan, Zhejiang 316021, China;
3 Daishan Center for Disease Control and Prevention, Zhoushan, Zhejiang 316200, China;
4 Department of Viral Research, Ningbo Municipal Center for Disease Control and Prevention, Ningbo, Zhejiang 315010, China;
5 Dinghai Center for Disease Control and Prevention, Zhoushan, Zhejiang 316000, China
钩端螺旋体病(leptospirosis)简称钩体病,是一种由致病性钩端螺旋体(Leptospira,钩体)引起的急性人兽共患传染病[1]。大量哺乳动物均可作为其感染宿主,通过动物尿液排出的钩体,可在被污染的水或土壤中存活数月[2]。我国大部分地区的气候条件适合钩体生长繁殖,动物宿主的种类繁多,存在暴发和大流行的潜在风险[3]。该病在20世纪60年代中期至70年代末期是浙江省舟山市常见的人兽共患传染病,且经常发生局部暴发流行。最严重的一起暴发,患者多达234例。随着舟山市钩体病防治水平的提高,自1982年后本地一直未见该病的报道。2022年4月20日,舟山医院接收1名钩体病疑似患者,其发病后3 d血清经实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction,qPCR)检测为钩体核酸阴性,但第三方检测机构的宏基因组测序报告则为钩体阳性[4]。虽经研究决定该病例未被列入法定传染病报表,但该病例的出现是否提示钩体病在本市“死灰复燃”,需引起高度重视。为此我们再度对患者急性期与恢复期血清进行了钩体核酸及抗体检测,并对患者居住地宿主动物与居民的钩体感染情况开展了分子流行病学调查。通过系统的监测调查来评估当前钩体病在舟山市的潜在风险,为钩体病防控与早期诊断提供科学依据。
1 材料与方法 1.1 材料 1.1.1 患者居住地自然环境该患者居住地位于舟山市普陀区展茅街道东北,三面环山面朝西南,有水田0.36 km2,旱地0.17 km2,山林1.13 km2的纯农业村。全村人口1 030人,60岁以上老人390人,村民主要从事苗木、水果、蔬菜、水稻与水产养殖,但其中1户为养猪专业户(居民70号)。居民住房沿着山脚与平原的接壤处呈长条形分布。小兽分布有褐家鼠(Rattus norvegicus)、臭鼩(Suncus murinus)和小家鼠(Mus musculus)等,以褐家鼠为主。
1.1.2 病例临床信息余某某,男,79岁,现居普陀区展茅街道晓辉村,自诉8 d前接触鼠类后出现突发高热,最高体温40 ℃,伴畏寒、寒战、恶心、呕吐,全身肌痛且有明显的腓肠肌压痛,淋巴结肿大,眼结膜充血不明显,住院期间由于患者反复发热被怀疑钩体病,从神经内科转至感染性疾病科,按钩体病给予青霉素钠(80万IU/次,静脉滴注,1次/8 h)抗感染治疗,好转后出院[4]。
1.1.3 周围居民信息60岁以上常住居民69人,男性31人,女性38人,年龄分布60~82岁,平均年龄(71.03±4.80)岁。
1.1.4 血样采集处理经疑似病例及周围居民知情同意后,无菌采集静脉血3~5 ml,分离血清后直接检测或-70 ℃保存备用。疑似病例血样为发病后3 d与64 d空腹采集。
1.1.5 尿样采集处理[5]无菌一次性纸杯接取中段人尿或猪尿约100 ml分别注入到50 ml塑料离心管,1 700×g离心1 h,留沉渣约0.5 ml用于提取核酸。
1.1.6 小兽样本采集处理捕捉、鉴定与解剖按《全国病媒生物病原学监测方案》[6]执行,取黄豆粒大小的肾脏组织研磨成组织匀浆,提取核酸。
1.2 主要试剂核酸提取试剂购自QIAGEN公司。One Step PrimeScript™ RT-PCR Kit(Perfect Real Time)(RR064A),PrimeScript™ One Step RT-PCR Kit Ver.2(RR055A)购自TaKaRa公司。钩端螺旋体IgM、IgG抗体酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂购自德国维润赛润公司。
1.3 方法 1.3.1 钩体患者确诊条件[5]① 从血液或脑脊液或尿液分离到钩体;②从血液或尿液或脑脊液检测到钩体核酸;③患者恢复期血清比早期血清抗钩体抗体效价4倍或4倍以上升高。疑似病例加上述3条中的任何一条即可判定为确诊病例。
1.3.2 钩体核酸与抗体检测方法核酸检测选用王蓉等[7]报道的反转录实时荧光定量PCR(quantitative reverse transcription PCR,RT-qPCR)方法。钩体IgM与IgG检测采用ELISA法,结果判断按试剂盒说明书执行。
1.3.3 测序与序列分析对检测阳性的钩体核酸进行23S rRNA的反转录PCR扩增,引物同文献[8],扩增产物经1.5%琼脂糖电泳分离后,特异性条带送上海赛恒生物科技公司进行测序。获得的序列经GenBank数据库中的序列BLAST比对确认,核苷酸序列同源性分析采用DNAStar中MegAlign分析。
2 结果 2.1 患者血清钩体核酸与抗体检测结果该患者发病后3 d血清中钩体核酸检测循环阈值(cycle threshold value,Ct)为30.80,结果呈弱阳性,发病后64 d为阴性。发病后3 d血清中钩体IgM与IgG抗体均为阴性,发病后64 d血清中IgM与IgG均转为强阳性[吸光度(A)分别为2.48与1.81],活性值均 > 100 U/ml。肾综合征出血热、登革热、病毒性肝炎与流行性感冒4类病毒核酸鉴别诊断均为阴性。依据钩体病诊断标准(WS 290-2008),结合流行病学史、临床表现和实验检查,该患者可以确诊为钩体病患者。
2.2 周围居民感染情况及阳性标本地理分布69例居民血清钩体核酸检测结果均为阴性,IgM阳性率为4.35%(3/69,其中2例弱阳性),IgG阳性率为8.70%(6/69,其中4例弱阳性,包括养猪专业户70号),抗体总阳性率为11.59%(8/69,其中居民67号为IgM和IgG双阳性)(表 1)。3名IgM阳性者与确诊病例集中在该村西北角,5位IgG阳性者分布在晓辉村东南角(图 1)。此外,8例抗体阳性居民的血清核酸检测结果均为阴性,但3份IgM阳性居民的尿液核酸检测结果显示阳性,Ct值分别为27.82、29.44和30.76。
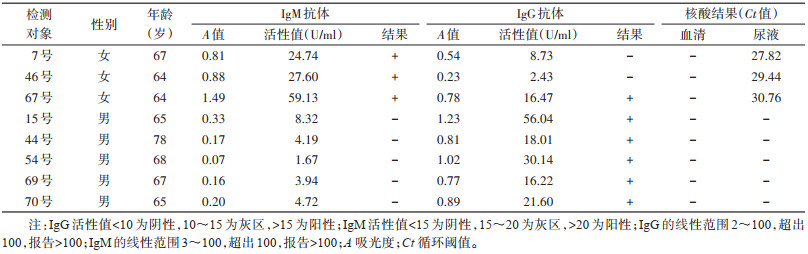
|

|
| 图 1 钩体患者与隐性感染者在浙江省舟山市普陀区晓辉村的分布位置 Figure 1 Distribution of the patient and residents with latent leptospirosis infection in Xiaohui village of Putuo District in Zhoushan, Zhejiang Province |
| |
共捕获小兽50只,钩体核酸阳性率为30.00%(15/50,其中7只为强阳性,8只为弱阳性),在村中唯一一户养猪专业户中采集的3份猪尿,钩体核酸检测结果均为阳性。15份鼠肾和3份猪尿的钩体核酸载量存在差异,其Ct值分布范围在13.60~34.00,其中7份鼠肾的Ct值< 20。见表 2。
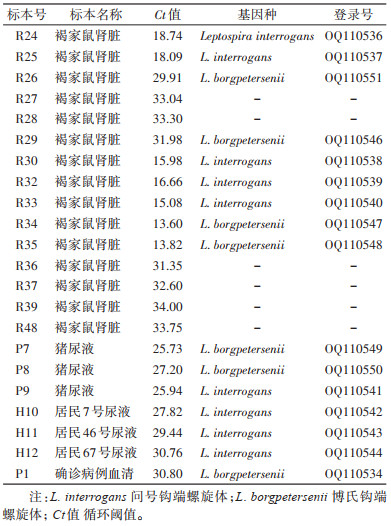
|
核酸检测共获得阳性结果22份,包括鼠肾样本15份、猪尿和人尿样本各3份,患者血清1份。其中16份样本23S rRNA序列测序成功,核苷酸的同源性为99.40%~100%。序列比对结果显示:9份样本中的序列来自问号钩体(L. interrogans),包括5份鼠肾样本、3份人尿样本和1份猪尿样本,且序列一致。7份来自博氏钩体(L. borgpetersenii),包括4份鼠肾样本、2份猪尿样本和1份患者急性期血清样本,序列一致。上述序列已全部上传至GenBank,登录号为:问号钩体OQ110536~OQ110544、博氏钩体OQ110546~OQ110551、患者OQ110534。
3 讨论根据钩体血清型别不同以及宿主免疫水平差异,患者临床表现相差甚大,轻者似感冒;重者可出现黄疸、出血、弥散性血管内凝血、休克,甚至死亡[9]。由于钩体病在本市已近40年未发现,早期症状又无明显特征性[10],多数年青医生缺乏相关临床诊断经验,因此可靠的分子及血清学诊断对该病的“三早一就”治疗原则十分关键[11]。对疑似病例及周围居民的研究表明,采用高灵敏度的核酸检测方法以及选择合适的采样时间点对钩体病的早期诊断至关重要。本病例急性期血清经qPCR诊断为钩体核酸阴性,而基于16S rRNA的RT-qPCR结果为阳性。结合既往研究报道[7],RT-qPCR方法具有更高的灵敏度,从而降低漏检的风险。同时,3名IgM阳性村民钩体核酸检测在血清中为阴性而尿液中为阳性,说明钩体核酸在尿液中的滞留时间要长于血清。因此,结合现行标准,建议急性期血清采集时间在发病后7 d之内,最佳时间为2~4 d,7 d以后建议血与尿同时采集。此外,根据1例输入性病例发病后血清抗体消长的观察结果(数据未报道),我们发现IgM与IgG阳转时间分别为病后第4与第5天。虽然具体时间点与文献[11-12]稍有差异,但2种抗体的阳转均发生在钩体的急性感染期。因此建议钩体病确诊标准中增加IgM与IgG阳转两项指标以有效缩短确诊时间,不要局限于恢复期血清比早期血清抗体效价4倍或4倍以上升高的单项指标。
近年来,浙江省钩体病疫情一直处于平稳状态,仅2007年磐安县及2017年三门县各暴发了一起钩体病疫情[13-14],并证实野鼠是当地主要传染源。本次流行病学调查显示抗体阳性者半年内无发热、全身肌痛、淋巴结肿大、眼结膜充血等临床症状,提示该村存在一定程度的钩体隐性感染。在对患者居住地宿主动物钩体感染情况调查中,约50%的鼠肾中钩体核酸载量较高(均Ct值< 20),提示这些鼠体内含有高浓度的钩体及其排泄物有较强的传染性。猪尿液中的钩体核酸检出率更是高达100%。对患者血清、所在地周围人群尿液以及鼠肾、猪尿的阳性样本测序,结果显示为问号钩体或博氏钩体,提示可能存在2种及以上钩体在该区域潜在流行,这也是我国目前最为流行的基因种[15-17]。从地理分布来看,3例IgM阳性者与确诊病例位置较为接近,集中在晓辉村的西北角,但两者所携带钩体的基因种并不一致。5位IgG阳性者(包括养猪专业户70号)则均匀分布在晓辉村东南角,但由于感染时间较久远,无法检测到基因种,而3份猪尿样本及村里多个采集点捕获的鼠经检测均存在问号和博氏2种基因种。考虑到晓辉村的生猪数量少(3~5头),且主要以圈养为主,污染面积有限。而鼠密度及钩体带菌率普遍较高,褐家鼠主要栖居于人的住房和各类建筑物中,村中老人家中普遍存在卫生问题及剩菜剩饭习惯,可能对食物饮水等环境造成污染,推测鼠类更有可能是本次钩体病的主要传染源。
利益冲突 无
| [1] |
Garba B, Bahaman AR, Khairani-Bejo S, et al. Retrospective study of leptospirosis in Malaysia[J]. EcoHealth, 2017, 14(2): 389-398. DOI:10.1007/s10393-017-1234-0 |
| [2] |
Zhang CC, Li Z, Xu YH, et al. Genetic diversity of Leptospira interrogans circulating isolates and vaccine strains in China from 1954-2014[J]. Hum Vaccines Immunother, 2019, 15(2): 381-387. DOI:10.1080/21645515.2018.1528839 |
| [3] |
李喆, 徐颖华, 辛晓芳. 我国钩端螺旋体分子分型研究进展[J]. 疾病监测, 2022, 37(4): 512-516. Li Z, Xu YH, Xin XF. Progress in research of molecular typing of Leptospira in China[J]. Dis Surveill, 2022, 37(4): 512-516. DOI:10.3784/jbjc.202109130500 |
| [4] |
朱光琦, 陈琳迪, 舒纪为, 等. 致病性钩端螺旋体病例分析及病原学鉴定[J]. 中华临床感染病杂志, 2023, 16(1): 59-62, 66. Zhu GQ, Chen LD, Shu JW, et al. Case analysis and pathogenic identification leptospirosis[J]. Chin J Clin Infect Dis, 2023, 16(1): 59-62, 66. DOI:10.3760/cma.j.issn.1674-2397.2023.01.008 |
| [5] |
中华人民共和国卫生部. WS 290-2008钩端螺旋体病诊断标准[S]. 北京: 人民卫生出版社, 2008. Ministry of Health of People's Republic of China. WS 290-2008 Diagnostic criteria for leptospirosis[S]. Beijing: People's Medical Publishing House, 2008. (in Chinese) |
| [6] |
中国疾病预防控制中心传染病预防控制所. 全国病媒生物病原学监测方案(试行)[Z]. 北京: 中国疾病预防控制中心, 2020. National Institute for Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention. National vector etiology surveillance program (Trial)[Z]. Beijing: Chinese Center for Disease Control and Prevention, 2020. (in Chinese) |
| [7] |
王蓉, 马敏, 王忠发, 等. 一种高效检测致病性钩端螺旋体PCR改良方法及效果评价[J]. 中国媒介生物学及控制杂志, 2023, 34(1): 77-81. Wang R, Ma M, Wang ZF, et al. Evaluation of an improved PCR assay in detection of pathogenic Leptospira[J]. Chin J Vector Biol Control, 2023, 34(1): 77-81. DOI:10.11853/j.issn.1003.8280.2023.01.014 |
| [8] |
中华人民共和国国家质量监督检验检疫总局. SN/T 3741.1-2013国境口岸鼠类携带病原体检测方法第1部分: 致病性钩端螺旋体PCR检测方法[S]. 北京: 中国标准出版社, 2014. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. SN/T 3741.1-2013 Detection for pathogens of rodents at frontier ports Part 1: Detection for pathogenic leptospira[S]. Beijing: Standards Press of China, 2013. (in Chinese) |
| [9] |
Rajapakse S. Leptospirosis: Clinical aspects[J]. Clin Med J, 2022, 22(1): 14-17. DOI:10.7861/clinmed.2021-0784 |
| [10] |
Haake DA, Levett PN. Leptospirosis in humans[M]//Adler B. Leptospira and leptospirosis. Berlin: Springer, 2015: 65-97. DOI: 10.1007/978-3-662-45059-8_5.
|
| [11] |
李兰娟, 黄祖瑚. 感染病学[M]. 2版. 南京: 江苏凤凰科学技术出版社, 2021: 1008-1010. Li LJ, Huang ZH. Infectious diseases[M]. 2nd ed. Nanjing: Jiangsu Phoenix Science and Technology Press, 2021: 1008-1010. |
| [12] |
Sahimin N, Sharif SA, Mohd Hanapi IR, et al. Seroprevalence of anti-Leptospira IgG and IgM antibodies and risk assessment of leptospirosis among urban poor communities in Kuala Lumpur, Malaysia[J]. Am J Trop Med Hyg, 2019, 101(6): 1265-1271. DOI:10.4269/ajtmh.19-0003 |
| [13] |
杨盛旭, 卢苗贵, 梅慧娟, 等. 一起钩端螺旋体病暴发疫情流行病学调查[J]. 预防医学, 2018, 30(5): 524-525. Yang SX, Lu MG, Mei HJ, et al. An epidemiological investigation of a leptospirosis outbreak[J]. Prev Med, 2018, 30(5): 524-525. DOI:10.19485/j.cnki.issn2096-5087.2018.05.026 |
| [14] |
李钟梁, 姜理平, 张孟田, 等. 浙江省磐安县钩端螺旋体病暴发后监测分析[J]. 中国媒介生物学及控制杂志, 2013, 24(3): 272-274. Li ZL, Jiang LP, Zhang MT, et al. Surveillance of Leptospira after leptospirosis outbreak in Pan'an county, Zhejiang[J]. Chin J Vector Biol Control, 2013, 24(3): 272-274. |
| [15] |
Zhang CC, Xu JM, Zhang TL, et al. Genetic characteristics of pathogenic Leptospira in wild small animals and livestock in Jiangxi province, China, 2002-2015[J]. PLoS Negl Trop Dis, 2019, 13(6): e0007513. DOI:10.1371/journal.pntd.0007513 |
| [16] |
Xu JL, Chen JT, Xiong CR, et al. Pathogenic Leptospira infections in Hubei province, central China[J]. Microorganisms, 2022, 11(1): 99. DOI:10.3390/microorganisms11010099 |
| [17] |
Xu GY, Qiu HY, Liu WJ, et al. Serological and molecular characteristics of pathogenic Leptospira in rodent populations in Fujian province, China, 2018-2020[J]. BMC Microbiol, 2022, 22(1): 151. DOI:10.1186/s12866-022-02566-2 |
 2023, Vol. 34
2023, Vol. 34


