扩展功能
文章信息
- 李雪, 凌峰, 韦舒琳, 屈志强, 刁书琴, 黄燕翠, 罗密芳
- LI Xue, LING Feng, WEI Shu-lin, QU Zhi-qiang, DIAO Shu-qin, HUANG Yan-cui, LUO Mi-fang
- 南宁市2022年白纹伊蚊击倒抗性基因型分布研究
- Distribution of knockdown resistance genotypes in Aedes albopictus in Nanning, Guangxi Zhuang Autonomous Region, China, 2022
- 中国媒介生物学及控制杂志, 2023, 34(4): 480-484
- Chin J Vector Biol & Control, 2023, 34(4): 480-484
- 10.11853/j.issn.1003.8280.2023.04.007
-
文章历史
- 收稿日期: 2023-03-20
白纹伊蚊(Aedes albopictus)是很多重要蚊媒传染病的主要传播媒介,能传播多种病原体,如登革病毒、寨卡病毒等。2019年中国大陆登革热疫情形势较2015-2018年更加严峻,28个省(自治区、直辖市)报告登革热病例共22 599例,发病率为1.63/10万,报告病例数仅次于2014年的登革热大暴发,高于2018年(5 136例)[1]。控制白纹伊蚊成蚊的措施有空间喷洒和滞留喷洒菊酯类卫生杀虫剂等[2-3],随着卫生杀虫剂的不合理使用,目前我国白纹伊蚊成蚊对该类卫生杀虫剂抗药性表现越来越明显[4],为蚊媒防制增加了难度。
蚊虫抗药性机制主要包括代谢抗性、行为抗性和击倒抗性等[5]。蚊虫电压门控钠离子通道(voltage-gated sodium channel,VGSC)是拟除虫菊酯类和滴滴涕等有机氯类杀虫剂的作用靶点,该通道编码基因突变导致蚊虫对该类卫生杀虫剂的亲和力降低从而产生抗性,称为击倒抗性[6]。本研究通过采集广西壮族自治区(广西)南宁市江南、良庆、青秀、武鸣、西乡塘和兴宁区等地的白纹伊蚊,检测其VGSC基因1016、1532及1534位点突变情况,以期丰富我国白纹伊蚊群体击倒抗性基因突变数据,为研究击倒抗性基因突变结果与生物测定结果之间的关联性提供科学依据。
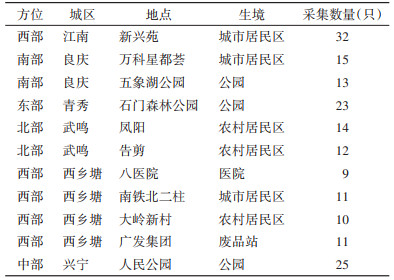
1 材料与方法 1.1 材料 1.1.1 供试蚊虫采用勺捕法在南宁市东、西、南、北、中不同方位的农村、公园、医院、城市居民区、废品站等不同生态环境采集幼蚊(表 1),收集至实验室进行集中统一饲养,羽化后,经形态学鉴定为白纹伊蚊的作为击倒抗性基因分布检测试虫,将其用75%乙醇溶液浸泡,于-20 ℃保存备用。实验室饲养温度为(26±1)℃,相对湿度为60%~80%。
|
组织破碎仪[中国,天根生化科技(北京)有限公司,TGrinder H24]、核酸提取仪[中国,天根生化科技(北京)有限公司,TGuide S32]、超微量分光光度计(德国,IMplen Gmbh,N60 Touch)、PCR仪[中国,杭州博日科技股份有限公司,TC-96/G/H(b)C]和凝胶成像系统(英国,Uvitec Ltd. FireReader V10)等。
1.1.3 主要试剂磁珠法组织基因组DNA提取试剂盒[DP602,天根生化科技(北京)有限公司]、2×Taq PCR预混试剂II[KT211,天根生化科技(北京)有限公司],引物由北京擎科生物科技有限公司合成。
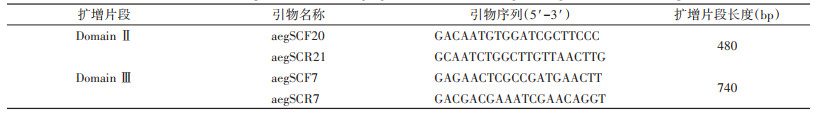
1.2 方法 1.2.1 白纹伊蚊核酸提取、基因扩增和测序将单只白纹伊蚊进行研磨后,参照磁珠法组织基因组DNA提取试剂盒说明书提取基因组DNA。以该DNA为模板,采用Kasai等[7-8]的引物(表 2),扩增VGSC基因的第Ⅱ、Ⅲ跨膜结构域的部分片段。PCR扩增VGSC基因片段反应体系为25 μl,体系配置参照2×Taq PCR预混试剂Ⅱ说明书,PCR反应条件为:94 ℃ 5 min;94 ℃ 30 s,Domain Ⅱ 58 ℃ 30 s(Domain Ⅲ 55 ℃ 30 s),72 ℃ 30 s,共30个循环;72 ℃延伸8 min。采用1.5%的琼脂糖凝胶电泳进行检测,将出现目的片段大小且条带清晰无拖尾的扩增产物送至北京擎科生物科技有限公司,按提供的测序引物(表 3)进行测序。
|

|
将获得的测序结果在美国国立生物技术信息中心(NCBI)数据库进行BLAST比对,使用DNAStar 7.1软件对峰图进行分析,统计分析1016、1532和1534位点突变情况,确定采集的白纹伊蚊等位基因和基因型,计算南宁市6个城区等位基因和基因型频率。
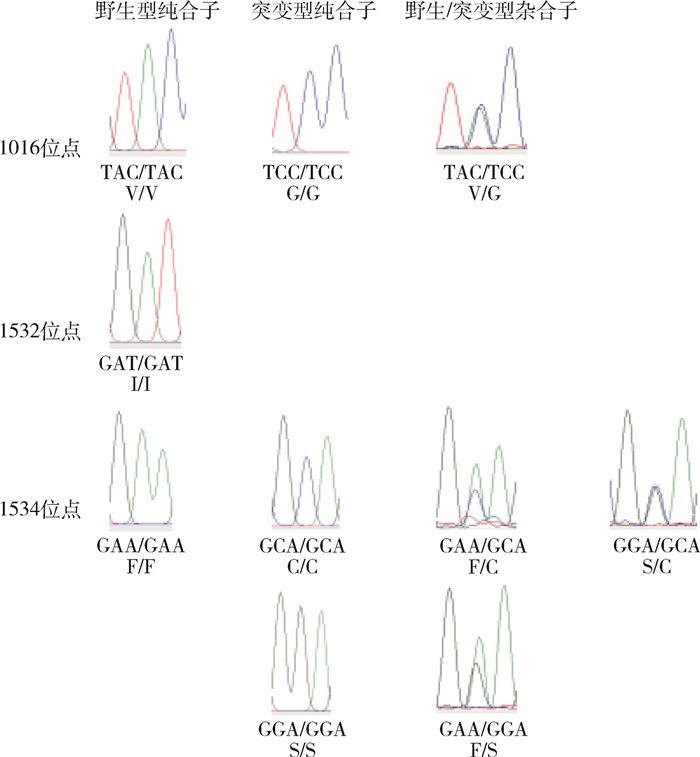
2 结果 2.1 VGSC基因的等位基因和基因型175只白纹伊蚊成蚊扩增产物经测序后,共获得350条DNA序列,测序片段长度约为400 bp。BLAST比对结果显示与白纹伊蚊VGSC基因第Ⅱ、Ⅲ编码区的部分序列一致性达99.00%以上。对获得的350条测序图谱进行比对分析,结果显示1532位点未出现突变,1016和1534位点存在突变(图 1)。1532位点只有1种等位基因类型,即野生型1532I(175,100%);基因型均为野生型纯合子1532I/I(175,100%)。1016位点有2种等位基因,分别为野生型1016V(148,78.28%)和突变型1016G(49,21.72%);有3种基因型,分别为野生型纯合子1016V/V(126,72.00%)、野生/突变型杂合子1016V/G(22,12.57%)和突变型纯合子1016G/G(27,15.43%)。1534位点有3种等位基因,分别为野生型1534F(51,16.86%)、突变型1534S(116,36.29%)和突变型1534C(135,46.85%);有6种基因型,分别为野生型纯合子1534F/F(8,4.57%)、野生/突变型杂合子1534F/S(21,12.00%)、野生/突变型杂合子1534F/C(22,12.57%),突变型杂合子1534S/C(64,36.57%)、突变型纯合子1534S/S(21,12.00%)和突变型纯合子1534C/C(39,22.29%)。
|
| 注:TAC、TCC、GAT、GAA、GCA、GGA为氨基酸密码子,分别编码缬氨酸(V)、甘氨酸(G)、异亮氨酸(I)、苯丙氨酸(F)、半胱氨酸(C)和丝氨酸(S)。 图 1 2022年南宁市白纹伊蚊击倒抗性测序峰图 Figure 1 Knockdown resistance sequencing chromatogram of Aedes albopictus populations in Nanning, Guangxi Zhuang Autonomous Region, China, 2022 |
| |
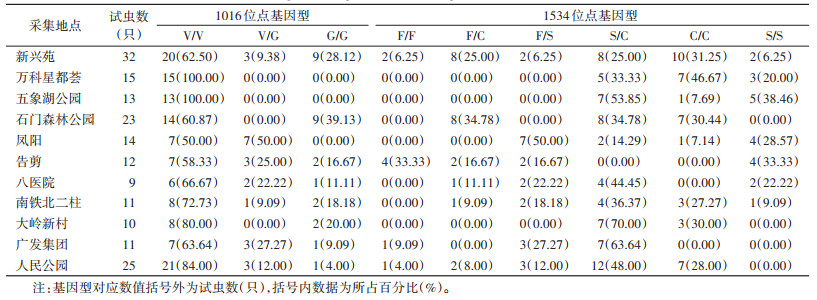
序列比对分析发现6个城区175只白纹伊蚊1532位点尚未突变,等位基因均为野生型GAT/I,基因型为I/I。1016位点只有1种突变等位基因1016G,万科星都荟和五象湖公园(南部)白纹伊蚊未检测到突变情况,其余采集地点均有不同程度的突变。凤阳1016V/G基因型突变率最高(50.00%),石门森林公园白纹伊蚊1016G/G基因型突变率最高(39.13%)。1534位点有2种突变等位基因,1534S和1534C,5个方位白纹伊蚊均有不同程度的突变,石门森林公园白纹伊蚊1534F/C基因型突变率最高(34.78%),凤阳1534F/S基因型突变率最高(50.00%),大岭新村1534S/C基因型突变率最高(70.00%),万科星都荟1534C/C基因型突变率最高(46.67%),五象湖公园1534S/S基因型突变率最高(38.46%)。见表 4。
|
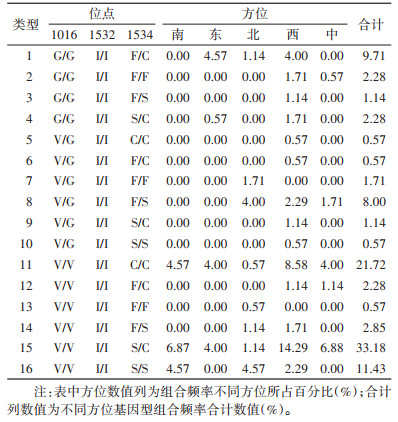
175只白纹伊蚊样本中共检测到16种基因型组合(表 5),未检测到3个位点同时突变,仅检测到1只3个位点均为野生型纯合子的个体。1016、1532、1534位点突变组合丰富多样,其中V/V+I/I+S/C组合发生频率最高,V/V+I/I+C/C组合次之;除3个位点均为野生型纯合子的个体外,V/G+I/I+C/C组合、V/G+I/I+F/C组合和V/G+I/I+S/S组合均仅出现1只个体。
|
白纹伊蚊是登革热等多种蚊媒传染病的传播媒介,准确、客观地评价其抗药性水平是防控的基础。本次研究结果其VGSC基因1016位点检测到的突变纯合子和野生/突变型杂合子与Zhou等[9]的研究结果相同,南宁市白纹伊蚊1016G突变率为21.72%,与2018-2019年云南省景洪市突变率(25.31%)相接近[10],比2021年周小洁等[11]报道的北京市白纹伊蚊1016位点突变率(5.00%)高。1532位点共有2种等位基因,即野生型1532I和突变型1532T,本次研究结果1532位点与2019年广东省中山市[12]白纹伊蚊现场种群击倒抗性基因检测结果一致,未发生突变,但在上海市嘉定区等地的白纹伊蚊击倒抗性基因中此类突变均有检测到[13]。1532T在抗药性中的作用尚无定论[14],袁浩等[15]报道VGSC基因1532T突变使白纹伊蚊成虫对氯菊酯敏感性下降,但与溴氰菊酯敏感性无相关性。1534位点突变率较高,突变类型多样,本次研究结果等位基因突变型为1534S(116/36.29%)和1534C(135/46.85%),研究报道1534S和1534C与白纹伊蚊的抗药性密切相关[9, 16-17]。本次检测获得的白纹伊蚊1534位点突变率和突变类型与各地区不尽相同,例如云南省景洪市均以突变型1534S为主,广东省中山市以1534L为主,这与当地使用的卫生杀虫剂品种、强度和频次等因素有关,再加上遗传因素和选择压力的影响导致。通过对白纹伊蚊抗药性的深入研究,从分子层面了解抗性机制,避免生物测定中的一些主观因素,如死亡个体的判定等导致的检测误差,对制定更加完善的防蚊措施具有重要意义。
本次研究结果显示拟除虫菊酯类卫生杀虫剂在广西南宁市白纹伊蚊成蚊的防制中所产生的抗药性水平较高,建议调整杀虫剂使用方案,减缓抗药性水平上升趋势,保障杀灭效果。
利益冲突 无
| [1] |
刘起勇. 我国登革热流行新趋势、防控挑战及策略分析[J]. 中国媒介生物学及控制杂志, 2020, 31(1): 1-6. Liu QY. Dengue fever in China: New epidemical trend, challenges and strategies for prevention and control[J]. Chin J Vector Biol Control, 2020, 31(1): 1-6. DOI:10.11853/j.issn.1003.8280.2020.01.001 |
| [2] |
World Health Organization. Pesticides and their application, for the control of vectors and pests of public health importance, sixth edition [EB/OL]. (2006) [2023-03-02]. https://apps.who.int/iris/handle/10665/69223.
|
| [3] |
World Health Organization. Dengue guidelines for diagnosis, treatment, prevention and control, new edition [EB/OL]. (2009)[2023-03-02]. https://apps.who.int/iris/handle/10665/44188.
|
| [4] |
赵春春, 周欣欣, 李文玉, 等. 2020年中国13省份登革热媒介白纹伊蚊抗药性监测及分析研究[J]. 中国媒介生物学及控制杂志, 2022, 33(1): 30-37. Zhao CC, Zhou XX, Li WY, et al. Insecticide resistance surveillance and characteristic analysis of dengue vector Aedes albopictus in 13 provinces of China in 2020[J]. Chin J Vector Biol Control, 2022, 33(1): 30-37. DOI:10.11853/j.issn.1003.8280.2022.01.006 |
| [5] |
Hemingway J, Ranson H. Insecticide resistance in insect vectors of human disease[J]. Annu Rev Entomol, 2000, 45: 371-391. DOI:10.1146/annurev.ento.45.1.371 |
| [6] |
Itokawa K, Sekizuka T, Maekawa Y, et al. High-throughput genotyping of a full voltage-gated sodium channel gene via genomic DNA using target capture sequencing and analytical pipeline MoNaS to discover novel insecticide resistance mutations[J]. PLoS Negl Trop Dis, 2019, 13(11): e0007818. DOI:10.1371/journal.pntd.0007818 |
| [7] |
Kasai S, Ng LC, Lam-Phua SG, et al. First detection of a putative knockdown resistance gene in major mosquito vector, Aedes albopictus[J]. Jpn J Infect Dis, 2011, 64(3): 217-221. |
| [8] |
Kasai S, Caputo B, Tsunoda T, et al. First detection of a VSSC allele V1016G conferring a high level of insecticide resistance in Aedes albopictus collected from Europe (Italy) and Asia (Vietnam), 2016: A new emerging threat to controlling arboviral diseases[J]. Eurosurveillance, 2019, 24(5): 1700847. DOI:10.2807/1560-7917.ES.2019.24.5.1700847 |
| [9] |
Zhou XJ, Yang C, Liu N, et al. Knockdown resistance (kdr) mutations within seventeen field populations of Aedes albopictus from Beijing, China: First report of a novel V1016G mutation and evolutionary origins of kdr haplotypes[J]. Parasit Vectors, 2019, 12(1): 180. DOI:10.1186/s13071-019-3423-x |
| [10] |
朱彩英, 赵春春, 伦辛畅, 等. 云南省景洪市2018-2019年白纹伊蚊击倒抗性基因型分布研究[J]. 中国媒介生物学及控制杂志, 2020, 31(1): 7-11. Zhu CY, Zhao CC, Lun XC, et al. Distribution of knockdown resistance genotypes in Aedes albopictus in Jinghong, Yunnan province, China, 2018-2019[J]. Chin J Vector Biol Control, 2020, 31(1): 7-11. DOI:10.11853/j.issn.1003.8280.2020.01.002 |
| [11] |
周小洁, 赵宇晗, 刘念, 等. 北京市两个白纹伊蚊种群kdr抗性突变检测分析[J]. 中华卫生杀虫药械, 2021, 27(4): 304-307. Zhou XJ, Zhao YH, Liu N, et al. Detection and analysis of kdr resistance mutations in two populations of Aedes albopictus in Beijing[J]. Chin J Hyg Insect Equip, 2021, 27(4): 304-307. DOI:10.19821/j.1671-2781.2021.04.003 |
| [12] |
杨罗菊, 刘德星, 陈健, 等. 中山市白纹伊蚊现场种群击倒抗性基因检测分析[J]. 中国人兽共患病学报, 2021, 37(2): 171-175. Yang LJ, Liu DX, Chen J, et al. Detection and analysis of the knockdown resistance gene in the field populations of Aedes albopictus in Zhongshan[J]. Chin J Zoonoses, 2021, 37(2): 171-175. DOI:10.3969/j.issn.1002-2694.2021.00.005 |
| [13] |
赵春春. 我国白纹伊蚊抗药性及kdr基因分布研究[D]. 北京: 中国疾病预防控制中心, 2019. Zhao CC. Study on insectcides resistance and kdr gene distribution of Aedes albopictus in China[D]. Beijing: Chinese Center for Disease Control and Prevention, 2019. (in Chinese) |
| [14] |
邱星辉. 白纹伊蚊抗药性分子机制研究进展[J]. 寄生虫与医学昆虫学报, 2019, 26(3): 194-198. Qiu XH. Current knowledge about the molecular mechanisms underlying insecticide resistance in Aedes albopictus[J]. Acta Parasitol Med Entomol Sin, 2019, 26(3): 194-198. DOI:10.3969/j.issn.1005-0507.2019.03.009 |
| [15] |
袁浩, 董昊炜, 庄松阳, 等. 电压门控钠离子通道基因I1532T突变与白纹伊蚊对菊酯类杀虫剂敏感性的相关性[J]. 中国热带医学, 2021, 21(12): 1130-1135, 1149. Yuan H, Dong HW, Zhuang SY, et al. Correlation between the mutation of allele I1532T in voltage-gated sodium channel (VGSC) gene and susceptibility of Aedes albopictus to pyrethroid insecticides[J]. China Trop Med, 2021, 21(12): 1130-1135, 1149. DOI:10.13604/j.cnki.46-1064/r.2021.12.03 |
| [16] |
Auteri M, La Russa F, Blanda V, et al. Insecticide resistance associated with kdr mutations in Aedes albopictus: An update on worldwide evidences[J]. Biomed Res Int, 2018, 2018: 3098575. DOI:10.1155/2018/3098575 |
| [17] |
Xu JB, Bonizzoni M, Zhong DB, et al. Multi-country survey revealed prevalent and novel F1534S mutation in voltage-gated sodium channel (VGSC) gene in Aedes albopictus[J]. PLoS Negl Trop Dis, 2016, 10(5): e0004696. DOI:10.1371/journal.pntd.0004696 |
 2023, Vol. 34
2023, Vol. 34

