扩展功能
文章信息
- 田鹏, 孙晓东, 段凯霞, 徐艳春, 周耀武, 郭祥瑞, 李仕刚, 林祖锐
- TIAN Peng, SUN Xiao-dong, DUAN Kai-xia, XU Yan-chun, ZHOU Yao-wu, GUO Xiang-rui, LI Shi-gang, LIN Zu-rui
- 缅甸拉咱市2018年蚊类和按蚊疟原虫子孢子感染调查
- Investigation on mosquito species and Plasmodium sporozoite infection in Anopheles mosquitoes in Laiza city, Myanmar, 2018
- 中国媒介生物学及控制杂志, 2023, 34(3): 412-416
- Chin J Vector Biol & Control, 2023, 34(3): 412-416
- 10.11853/j.issn.1003.8280.2023.03.022
-
文章历史
- 收稿日期: 2023-02-14
2 盈江县疾病预防控制中心, 云南 盈江 679300
2 Yingjiang County Center for Disease Control and Prevention, Yingjiang, Yunnan 679300, China
缅甸是湄公河次区域疟疾发病率最高的国家[1],疟疾发病数约占湄公河流域疟疾总病例数的50%,而与中国接壤的缅甸克钦邦边境地区属缅甸疟疾流行最严重区域[2-3],尤其是缅甸拉咱市,每年从缅甸拉咱市输入云南省的疟疾病例是云南省消除疟疾面临的最大挑战[4-5]。为了解缅甸拉咱市蚊类和按蚊疟原虫子孢子感染情况,为当地疟疾防控提供本底资料,2018年7-9月在缅甸拉咱市开展了调查,结果报告如下。
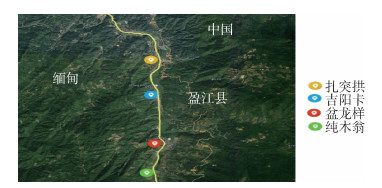
1 材料与方法 1.1 采样点情况拉咱市位于缅甸北部山区,东经97°33′21″,北纬24°47′21″,与中国盈江县那邦镇山水相连,海拔253 m,属亚热带季风气候,年平均气温22.7 ℃。选择拉咱市内扎突拱、吉阳卡、盆龙样、纯木翁4个居民点作为调查点,调查点均沿拉咱河而设,与中国那邦镇仅一河之隔,房屋多为篱笆、石棉瓦和胶合板简易房,周围山坡有溪流及稻田,植被茂密,适合蚊虫孳生。调查点分布情况见图 1。
|
| 图 1 2018年缅甸拉咱市蚊虫调查点分布 Figure 1 Distribution of mosquito survey sites in Laiza city, Myanmar, 2018 |
| |
2018年7-9月每月上、下旬对缅甸拉咱市的扎突拱、吉阳卡、盆龙样、纯木翁4个调查点进行2次捕蚊,每次捕蚊3 d,捕蚊采用定点、定人、定时,如遇大风、下雨等特殊天气,适当调整捕蚊时间[6]。
1.2.2 捕蚊方法采用诱蚊灯全通宵捕蚊法。LTS-M02功夫小帅诱蚊灯,由武汉市吉星环保科技有限责任公司生产。在4个调查点的东、西、南、北、中各选取1间人房作为固定捕蚊点,每个捕蚊点室内、外各悬挂1台诱蚊灯,悬挂高度1.5~2.0 m,从20:00至次日08:00通宵捕蚊,捕获的蚊虫用密封袋装好后放-20 ℃冰箱冻死后进行分类鉴定并计数[7]。
1.3 子孢子检测 1.3.1 主要试剂和仪器DNA提取试剂盒(DNeasy Blood & Tissue Kit)为德国Qiagen公司产品;2×PCR Master Mix(含Taq酶)购自Qiagen公司;琼脂糖为Biowest Regular AgaroseG-10(lot:11860)产品;DNA marker(2 000 bp)为宝生物工程(大连)有限公司产品;基因扩增仪为美国ABI veriti96 PCR仪;电泳仪为北京六一仪器厂生产;凝胶成像系统Gel Doc XR+为美国Bio-rad公司产品。
1.3.2 基因组DNA制备去除按蚊翅膀、足及喙,以同种按蚊5只/组,加10 μl buffer ATL进行研磨直至无肉眼可见大组织,参照DNA提取试剂盒提取基因组DNA,-20 ℃保存备用。
1.3.3 巢式PCR扩增引物序列:rPLU5:5′-CCT GTTGTTGCCTTAAACTTC-3',rPLU6:5′-TTAAAATT GTTGCAGTTAAAACG-3';rVIV1:5′-CGCTTCTAG CTTAATCCACATAACTGATAC-3′、rVIV2:5′-ACTT CCAAGCCGAAGCAAAGAAAGTCCTTA-3′;rFA-L1:5′-TTAAACTGGTTTGGGAAAACCAAATATATT-3′、rFAL2:5′-ACACAATGAACTCAATCATGACTACCC GTC-3′;rPM1:5′-ATAACATAGTTGTACGTTAAGA ATAACCGC-3',rPM2:5′-AAATTCCCATGCATAA AAAATTATACAAA-3′;rPO1:5′-ATCTCTTTTGCT ATTTTTTAGTATTGGAGA-3'、rPO2:5′-GGAAAGG ACACATTAATTGTATCCTAATG-3'。PCR反应体系:第1轮DNA模板2.6 μl,2×Taq PCR混合体系14 μl,正、反向引物(20 μmol/L)rPLU5/rPLU6各0.7 μl,用ddH2O补足体积至25 μl;第2轮反应以1.6 μl第1轮的PCR扩增产物为模板,2×Taq PCR混合体系14 μl,正、反向引物(20 μmol/L)各0.7 μl,引物为rPv1/rPv2、rPf1/rPf2、rPM1/rPM2和rPO1/ rPO2,用ddH2O补足体积至25 μl。两轮PCR反应条件:94 ℃ 3 min;94 ℃ 30 s,58 ℃ 45 s,72 ℃ 40 s,32次循环;72 ℃ 6 min。第2轮退火温度为60 ℃。扩增产物于1.5%琼脂糖凝胶电泳观察扩增的目的片段长度,判别疟原虫种类[间日疟原虫(Pv,120 bp)、恶性疟原虫(Pf,205 bp)、三日疟原虫(Pm,141 bp)和卵形疟原虫(Po,800 bp)]。
1.4 统计学分析用Excel 2016软件建立数据库进行合计和构成比计算,按蚊子孢子最低感染率(minimum infection rate,MIR)=子孢子阳性组数/蚊虫样本总数×100。用SPSS 13软件进行χ2检验,比较4个调查点子孢子最低感染率间的差异,P < 0.05为差异有统计学意义。
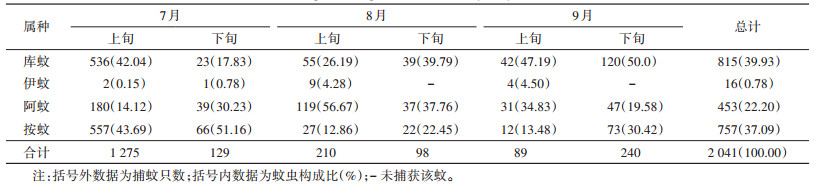
2 结果 2.1 蚊虫种属2018年7-9月共捕获蚊虫2 041只,其中库蚊属(Culex)815只,占捕蚊总数的39.93%,伊蚊属(Aedes)16只,占0.78%,阿蚊属(Armigeres)453只,占22.20%,按蚊属(Anopheles)757只,占37.09%。见表 1。
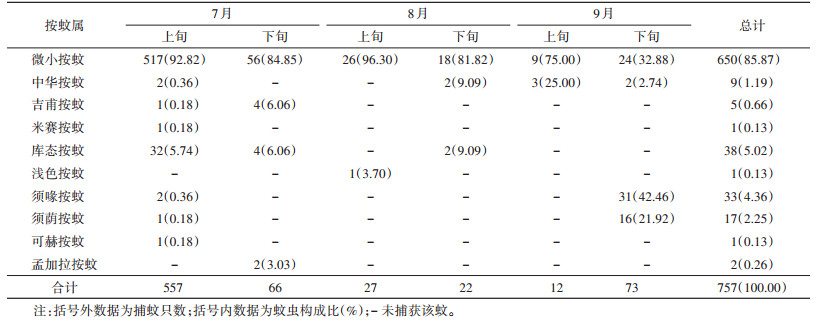
本次调查共捕获按蚊10种757只,经解剖镜下形态学鉴定为微小按蚊(An. minimus)、中华按蚊(An. sinensis)、吉普按蚊(An. jeyporiensis)、米赛按蚊(An. messeae)、库态按蚊(An. culicifacies)、浅色按蚊(An. subpictus)、须喙按蚊(An. barbirostris)、须荫按蚊(An. barbumbrosus)、可赫按蚊(An. kochi)和孟加拉按蚊(An. bengalensis)。其中微小按蚊650只,占85.87%,为按蚊优势种;其次为库态按蚊,占5.02%。见表 2。
|
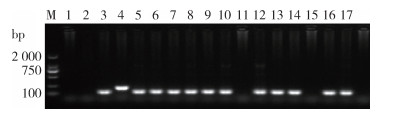
PCR检测按蚊共135组667只,其中微小按蚊650只(97.45%),中华按蚊7只(1.05%),其他按蚊10只(1.50%)。4个调查点中,扎突拱共检测25组123只(其中微小按蚊115只、中华按蚊5只、其他按蚊3只),吉阳卡8组41只(微小按蚊40只、可赫按蚊1只),盆龙样5组22只(微小按蚊20只、中华按蚊2只),纯木翁97组481只(微小按蚊475只、其他按蚊6只)。共有11组样品扩增出约120 bp的间日疟原虫目的片段(图 2),均标记为微小按蚊,检出率为8.15%。按检测出的11组中每组至少有1只微小按蚊携带疟原虫子孢子,可推算微小按蚊疟原虫子孢子最低感染率为1.69%(11/650),其中扎突拱最低感染率为1.74%(2/115),纯木翁为1.89%(9/475),二者差异无统计学意义(χ2=0.012,P=0.912),其他调查点子孢子感染率均为0。
|
| 注:M DNA标志物;1空白对照;2阴性对照;3间日疟原虫阳性对照;4恶性疟原虫阳性对照;5~17微小按蚊样品。 图 2 缅甸拉咱市按蚊疟原虫子孢子巢式PCR扩增产物电泳图 Figure 2 Electropherogram of nested PCR amplification products of Plasmodium sporozoites in Anopheles mosquitoes from Laiza city, Myanmar |
| |
本次调查共捕获10种按蚊,与吴林波等[8-9]于2021年缅甸拉咱市按蚊种类及分布调查和中缅边境地区不同建筑类型房屋蚊虫入侵情况调查结果相似,略少于施文琦等[10]2008年在相同地区捕获的14种按蚊,可能与当年气候、调查点范围、捕蚊场所和捕蚊时间等有关。本次调查发现缅甸拉咱市优势按蚊为微小按蚊,构成比为85.87%,与2014年Wang等[11]在相同地区调查的微小按蚊属于当地优势蚊种结果(84.60%)相似,但高于2015年张苍林等[12]在该地区相邻的中国那邦镇微小按蚊调查结果(49.07%),主要是本次捕获的大部分蚊虫来自缅甸拉咱市纯木翁自然村,该村靠近森林,周围溪流遍布,特别适合微小按蚊孳生。调查发现7月上旬捕蚊数占捕蚊总数的62.47%(1 275/2 041),7月中旬以后当地进入雨季,暴雨破坏蚊虫孳生地,导致7月下旬以后捕蚊数锐减,提示蚊媒控制应在7月上旬以前开展。
目前,检测按蚊体内子孢子的方法有解剖镜检法、酶联免疫吸附试验、巢氏PCR、荧光PCR和环介导等温扩散技术等[13-17],传统的解剖镜检法是传疟媒介判定最直接最可靠的方法,但对人员技术的依赖程度高,与PCR相比较,其操作也较为繁琐,敏感性和特异性均有一定的局限性,已不符合当前大规模疟疾媒介调查的需求[18],PCR方法具有较高的灵敏度[14],对于大批量的标本,是目前常用的方法,本调查采用巢氏PCR来检测按蚊的疟原虫子孢子,采用DNA试剂盒抽提按蚊基因组DNA。
本次调查共捕获按蚊757只,PCR检测667只,占比88.11%,未检测按蚊占11.89%,主要是因为分组时这些蚊虫躯体不全,无法再次核实蚊种或缺失检测部位。调查结果发现微小按蚊子孢子最低感染率为1.69%(11/650),最高感染率为8.46%(55/650),感染率在1.69%~8.46%,与周晓俊等[19]2008年在当地调查的微小按蚊疟原虫子孢子感染率为1.72%相似,但高于余果[20]2014年在缅甸克钦地区的感染率(0.07%~0.70%),可能与当地发病率、捕蚊地点及时间不一致有关。调查同时发现捕获按蚊数量较多的2个点扎突拱与纯木翁间微小按蚊最低感染率差异无统计学意义(χ2=0.012,P=0.912),说明2个调查点的微小按蚊传播能量一致,该2个调查点的生态环境相似,其微小按蚊的生活和叮人习性相似,提示当地疟疾流行程度高低与媒介种群数量多少有关,这可能也是按蚊捕获数量少的吉阳卡和盆龙样2个调查点未检出子孢子的原因。
2015年张苍林等[12]在拉咱市相邻的中国那邦镇捕获14只微小按蚊进行巢氏PCR未检出疟原虫子孢子,杨锐等[21]2015年在景洪市开展微小按蚊子孢子感染率调查未发现阳性,符合当前国内无本地疟疾病例情况。境外疟疾流行为云南边境地区“外防输入”带来压力[22-24]。本次调查研究存在一定的局限性,由于物资缺乏和工作现场在乡镇的原因,未单只检测微小按蚊,而是采用5只/组,不能准确算出疟原虫子孢子感染率,只能估算最低感染率,捕获的微小按蚊和检出阳性大部分来自缅甸拉咱市纯木翁自然村,只能局部反映当地的传疟媒介及疟原虫子孢子感染情况。
缅甸拉咱市2018年7-10月共报告疟疾病例664例,其中4个调查点报告160例,均为间日疟,占缅甸拉咱市报告疟疾病例总数的24.10%,发病率为1.29%(160/12 417),研究揭示微小按蚊是缅甸拉咱市传疟媒介优势蚊种,其疟原虫子孢子感染率高,通过控制蚊媒降低其种群密度可有效降低疟疾传播。
志谢 上海市疾病预防控制中心黄芳博士,云南省寄生虫病防治所周红宁所长、许建卫主任技师在本文投稿过程中给予帮助与支持,特此志谢利益冲突 无
| [1] |
吴艳琴, 周友华, 周红宁. 缅甸疟疾流行特征研究概况[J]. 中国病原生物学杂志, 2022, 17(1): 118-122. Wu YQ, Zhou YH, Zhou HN. Progress of malaria epidemiological characteristics in Myanmar[J]. J Pathog Biol, 2022, 17(1): 118-122. DOI:10.13350/j.cjpb.220126 |
| [2] |
World Health Organization. World malaria report 2018[R]. Geneva: WHO, 2018: 46-47.
|
| [3] |
Wang Y, Zhong DB, Cui LW, et al. Population dynamics and community structure of Anopheles mosquitoes along the China-Myanmar border[J]. Parasit Vectors, 2015, 8(1): 445. DOI:10.1186/s13071-015-1057-1 |
| [4] |
杨恒林, 肖宁, 杨亚明, 等. 中缅和中老边境地区消除疟疾的挑战、机遇与对策[J]. 中国热带医学, 2017, 17(4): 321-324, 335. Yang HL, Xiao N, Yang YM, et al. Challenges, opportunities and strategies of malaria elimination along China-Myanmar and China-Laos Border[J]. China Trop Med, 2017, 17(4): 321-324, 335. DOI:10.13604/j.cnki.46-1064/r.2017.04.02 |
| [5] |
周耀武, 林祖锐, 杨恒林, 等. 2011-2019年云南省消除疟疾阶段疫情特征分析[J]. 中国病原生物学杂志, 2020, 15(11): 1328-1331. Zhou YW, Lin ZR, Yang HL, et al. Analysis of the epidemiological characteristics of malaria elimination in Yunnan province from 2011 to 2019[J]. J Pathog Biol, 2020, 15(11): 1328-1331. DOI:10.13350/j.cjpb.201118 |
| [6] |
石健, 凌峰, 屈志强, 等. 南宁市2015-2016年疟疾媒介监测结果分析[J]. 中国媒介生物学及控制杂志, 2019, 30(2): 203-205. Shi J, Ling F, Qu ZQ, et al. An analysis of malaria vector surveillance data from 2015 to 2016 in Nanning, China[J]. Chin J Vector Biol Control, 2019, 30(2): 203-205. DOI:10.11853/j.issn.1003.8280.2019.02.021 |
| [7] |
董学书, 周红宁, 龚正达. 云南蚊类志[M]. 昆明: 云南科技出版社, 2010: 85-93. Dong XS, Zhou HN, Gong ZD. The mosquito fauna of Yunnan, China[M]. Kunming: Yunnan Science and Technology Press, 2010: 85-93. |
| [8] |
吴林波, 许翔, 罗春海, 等. 缅甸按蚊种类调查及分布[J]. 中国病原生物学杂志, 2022, 17(6): 718-723. Wu LB, Xu X, Luo CH, et al. Investigations of distributions of Anopheles species in Myanmar[J]. J Pathog Biol, 2022, 17(6): 718-723. DOI:10.13350/j.cjpb.220621 |
| [9] |
吴林波, 许翔, 郭小连, 等. 中缅边境地区不同建筑类型房屋蚊虫入侵情况调查[J]. 中国病原生物学杂志, 2021, 16(7): 853-855, 858. Wu LB, Xu X, Guo XL, et al. Investigation of the mosquito invasion of different types of housing in the China-Myanmar border area[J]. J Pathog Biol, 2021, 16(7): 853-855, 858. DOI:10.13350/j.cjpb.210726 |
| [10] |
施文琦, 周晓俊, 张仪, 等. 中缅边境(西段)传疟媒介的初步调查[J]. 中国寄生虫学与寄生虫病杂志, 2011, 29(2): 134-137. Shi WQ, Zhou XJ, Zhang Y, et al. Investigation on malaria vectors in western part of China-Myanmar border[J]. Chin J Parasitol Parasit Dis, 2011, 29(2): 134-137. |
| [11] |
Wang Y, Zhong DB, Cui LW, et al. Population dynamics and community structure of Anopheles mosquitoes along the China-Myanmar border[J]. Parasit Vectors, 2015, 8(1): 445. DOI:10.1186/s13071-015-1057-1 |
| [12] |
张苍林, 郭祥瑞, 杨锐, 等. 2015年中缅边境盈江县疟疾疫点的调查与分析[J]. 中国寄生虫学与寄生虫病杂志, 2016, 34(5): 430-434. Zhang CL, Guo XR, Yang R, et al. Evaluation on malaria hotspots in Yingjiang county of the China-Myanmar border area in 2015[J]. Chin J Parasitol Parasit Dis, 2016, 34(5): 430-434. |
| [13] |
周红宁, 张再兴, 李春富, 等. 云南湄公河流域上游河谷地区疟疾媒介传疟作用研究(英文)[J]. 中国寄生虫病防治杂志, 2005, 18(6): 407-411. Zhou HN, Zhang ZX, Li CF, et al. The role of the malaria vectors in the upper valley of Mekong river in Yunnan (in English)[J]. Chin J Parasit Dis Con, 2005, 18(6): 407-411. DOI:10.3969/j.issn.1673-5234.2005.06.003 |
| [14] |
刘耀宝, 周华云, 汪圣强, 等. 荧光定量PCR用于按蚊体内疟原虫子孢子检测的研究[J]. 中国血吸虫病防治杂志, 2012, 24(4): 445-449. Liu YB, Zhou HY, Wang SQ, et al. Detection of Plasmodium sporozoites in Anopheles mosquitoes by using fluorescent quantitative PCR[J]. Chin J Schisto Control, 2012, 24(4): 445-449. |
| [15] |
徐大为, 王峰. 蚊媒唾腺疟原虫子孢子的ELISA检测方法[J]. 承德医学院学报, 1998, 15(2): 146-147. Xu DW, Wang F. ELISA method for detection of sporozoites of mosquito borne Plasmodium salivary gland malaria[J]. J Chengde Med College, 1998, 15(2): 146-147. |
| [16] |
Bass C, Nikou D, Blagborough AM, et al. PCR-based detection of Plasmodium in Anopheles mosquitoes: A comparison of a new high-throughput assay with existing methods[J]. Malar J, 2008, 7: 177. DOI:10.1186/1475-2875-7-177 |
| [17] |
朱韩武, 曹俊, 周华云, 等. 环介导等温扩增技术检测蚊体内间日疟原虫子孢子的研究[J]. 中国血吸虫病防治杂志, 2010, 22(2): 158-163. Zhu HW, Cao J, Zhou HY, et al. Detection of Plasmodium vivax sporozoites-carrying mosquitoes using loop-mediated isothermal amplification (LAMP)[J]. Chin J Schisto Control, 2010, 22(2): 158-163. DOI:10.3969/j.issn.1005-6661.2010.02.013 |
| [18] |
刘耀宝. 基因检测技术用于疟疾媒介调查的研究[D]. 无锡: 江苏省血吸虫病防治研究所, 2009. Liu YB. Study on gene detection techniques for malaria vector investigation[D]. Wuxi: Jiangsu Institute of Parasitic Diseases, 2009. (in Chinese) |
| [19] |
周晓俊, 施文琦, 张仪, 等. 缅甸克钦地区媒介微小按蚊分布和传疟作用[J]. 中国病原生物学杂志, 2010, 5(8): 578-580, 584. Zhou XJ, Shi WQ, Zhang Y, et al. Distribution of Anopheles minimus and its role in malaria transmission in the Kachin region of Myanmar[J]. J Pathog Biol, 2010, 5(8): 578-580, 584. DOI:10.13350/j.cjpb.2010.08.012 |
| [20] |
余果. 中缅边境按蚊群落及微小按蚊传疟作用[D]. 重庆: 重庆师范大学, 2014. Yu G. The Anopheles community and the role of An. minimus on malaria transmission on the China-Myanmar border[D]. Chongqing: Chongqing Normal University, 2014. (in Chinese) |
| [21] |
杨锐, 郑宇婷, 杨晓羽, 等. 云南省边境地区景洪市疟疾媒介调查[J]. 中国寄生虫学与寄生虫病杂志, 2019, 37(4): 406-410, 416. Yang R, Zheng YT, Yang XY, et al. Investigation on malaria vectors in Jinghong, a border area in Yunnan province[J]. Chin J Parasitol Parasit Dis, 2019, 37(4): 406-410, 416. DOI:10.12140/j.issn.1000-7423.2019.04.006 |
| [22] |
中国顺利通过世界卫生组织消除疟疾认证[J]. 中国护理管理, 2021, 21(7): 1087. China has successfully passed the World Health Organization certification for malaria eradication[J]. Chin Nurs Manage, 2021, 21(7): 1087. (in Chinese) |
| [23] |
夏志贵, 周水森, 汤林华. 中国消除疟疾的历程、意义、主要经验及消除后策略与展望[J]. 传染病信息, 2022, 35(1): 39-45, 59. Xia ZG, Zhou SS, Tang LH. History, impacts and experience of malaria elimination in China and strategies and prospects after elimination[J]. Infect Dis Info, 2022, 35(1): 39-45, 59. |
| [24] |
曹俊, 刘耀宝, 曹园园, 等. 中国消除疟疾的持续挑战: 输入性疟疾[J]. 中国寄生虫学与寄生虫病杂志, 2018, 36(2): 93-96. Cao J, Liu YB, Cao YY, et al. Sustained challenge to malaria elimination in China: Imported malaria[J]. Chin J Parasitol Parasit Dis, 2018, 36(2): 93-96. |
 2023, Vol. 34
2023, Vol. 34