扩展功能
文章信息
- 杨金颋, 黄晓宾, 王玉娟, 郭宪国, 张现政, 杨慧娟, 郑小燕
- YANG Jin-ting, HUANG Xiao-bin, WANG Yu-juan, GUO Xian-guo, ZHANG Xian-zheng, YANG Hui-juan, ZHENG Xiao-yan
- 云南省亚洲长翼蝠(Miniopterus fuliginosus)体表寄生虫感染情况分析
- Ectoparasitic infestation on Miniopterus fuliginosus in Yunnan province, China
- 中国媒介生物学及控制杂志, 2023, 34(3): 406-411
- Chin J Vector Biol & Control, 2023, 34(3): 406-411
- 10.11853/j.issn.1003.8280.2023.03.021
-
文章历史
- 收稿日期: 2022-11-09
2 东北师范大学吉林省动物资源保护与利用重点实验室, 吉林 长春 130000
2 Jilin Provincial Key Laboratory of Animal Resource Conservation and Utilization, Northeast Normal University, Changchun, Jilin 130000, China
寄生在哺乳动物体表的寄生虫多为节肢动物,其种类丰富,主要包括双翅目(Diptera)、半翅目(Hemiptera)、革翅目(Dermaptera)、虱目(Phthiraptera)、蚤目(Siphonaptera)和蜱螨亚纲(Acari)等。现有研究表明,这些体表寄生节肢动物多为媒介生物,可携带多种病原体,并通过生物性或机械性传播将病原体传给健康动物或人类而引发人兽共患病[1]。
蝙蝠(翼手目,Chiroptera)是唯一真正会飞的哺乳动物,目前已知约1 400种,在全球广泛分布(除两极和一些小岛屿外)[2]。同时,蝙蝠也是多种人兽共患病病原体的自然宿主,如狂犬病病毒(Rabies virus)、SARS冠状病毒(SARS-CoV)、埃博拉病毒(Ebola virus)、巴尔通体(Bartonella spp.)、立克次体(Rickettsia spp.)等。目前,大量研究证实蝙蝠体表存在多种寄生虫,常隶属双翅目中的蝠蝇科(Streblidae)和蛛蝇科(Nycteribiidae),蚤目中蝠蚤科(Ischnopsyllidae),蜱螨亚纲中的蝠螨科(Spinturnicidae)、巨刺螨科(Macronyssidae)、恙螨科(Trombiculidae)和硬蜱科(Ixodidae)。值得关注的是,部分研究在蝙蝠及其体表寄生虫体内检测到同一种病原体,提示蝙蝠体表寄生虫可能是蝙蝠体内病原体传播的重要媒介[3]。鉴于此,应加强对蝙蝠体表寄生虫的关注和研究,探究其对流行病学的意义。然而,目前对蝙蝠体表寄生虫的研究多集中于欧美国家和地区[4],在我国研究较少,这与我国丰富的蝙蝠物种资源严重不符。
云南省独特的自然环境孕育了丰富的蝙蝠物种资源,是研究蝙蝠及其体表寄生虫的理想区域。亚洲长翼蝠(Miniopterus fuliginosus),隶属长翼蝠科(Miniopteridae),在中国广泛分布,其狭长的翼型使其能够进行长距离飞行,可能导致寄生虫及相关病原体的跨区域传播[5]。本文将云南省部分地区的亚洲长翼蝠作为宿主对象,调查和分析其体表寄生虫的寄生状况和物种多样性。这不仅为探究蝙蝠体表寄生虫对病原体的媒介传播作用奠定基础,也为当地病媒节肢动物的监测和相关疾病的防治提供理论指导。
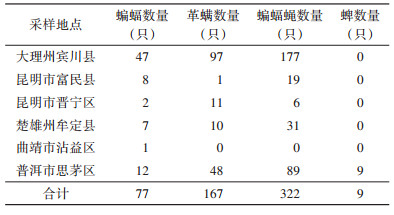
1 材料与方法 1.1 采样地点2020-2022年,在6个采样点捕捉亚洲长翼蝠,采样点分别位于昆明市富民县,昆明市晋宁区,楚雄彝族自治州(楚雄州)牟定县,曲靖市沾益区,大理白族自治州(大理州)宾川县和普洱市思茅区。
1.2 方法 1.2.1 亚洲长翼蝠及体表寄生虫的采集在傍晚时刻,预先在栖息地(洞口)布置雾网,等待蝙蝠外出捕食,利用雾网抓捕蝙蝠,并根据《中国哺乳动物彩色图鉴》中的鉴定特征进行蝙蝠物种鉴定[6]。将捕捉到的蝙蝠单独放入清洁透气且预先编号的布袋中,带到采集点附近的户外临时实验室。仔细检查每只蝙蝠体表,用无菌镊子夹取肉眼可见的体表寄生虫,并用毛刷蘸取乙醇溶液收集个体较小的寄生虫。采集完后,用酒精棉片对采集器械进行消毒,避免交叉感染。按照一兽一瓶的原则将所有采集到的体表寄生虫保存在装有95%乙醇溶液且编号的采样管中。完成样本采集工作后,所有蝙蝠于抓捕地释放。
1.2.2 亚洲长翼蝠体表寄生虫的鉴定采集到的寄生虫标本带回室内实验室,使用霍氏液进行封片,所封玻片标本被放入烘干箱中进行干燥处理。待玻片被烘干至透明后,于显微镜(徕卡DM500正置显微镜)下进行物种鉴定。体表寄生虫的鉴定参照相关文献和书籍[7-8]。
1.2.3 数据分析亚洲长翼蝠体表寄生虫主要包括革螨、蝙蝠蝇和蜱,计算其基本感染情况指标:构成比(Cr)、感染率(PM)、平均多度(MA)和平均感染强度(MI)。计算公式如下[9]:
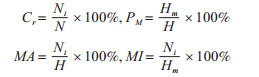
|
式中,Ni为某类/种体表寄生虫的个体数;N为体表寄生虫总个体数;Hm为感染某类/种体表寄生虫的亚洲长翼蝠的个体数;H为所捕获亚洲长翼蝠的总个体数。
使用物种优势度指数(Y)确定各体表寄生虫类群中的优势种,公式如下:
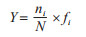
|
式中,N表示所有体表寄生虫的个体数;ni表示某一体表寄生虫物种的个体数;fi表示某一体表寄生虫物种在6个采样点中出现的概率。当Y > 0.2时,认为该物种为优势种。
利用聚块指数(m*/m)分析亚洲长翼蝠体表寄生虫优势种的空间分布型[10],公式如下:
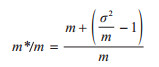
|
式中,m为每只亚洲长翼蝠个体体表某种寄生虫数量的平均值,σ2为每只亚洲长翼蝠个体体表某种寄生虫数量的方差,m*为平均拥挤度。当m*/m > 1时,判定为聚集分布;当m*/m=1时,判定为Poison分布;当m*/m < 1时,判定为均匀分布。
利用协调系数(V)判定寄生在相同宿主的不同寄生虫优势种间的相互关系[11]。公式如下:
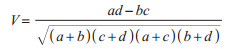
|
式中,a为同时感染寄生虫物种A和B的宿主个体数,b为只感染A但未感染B的宿主个体数,c为只感染B但未感染A的宿主个体数,d为既不感染A也不感染B的宿主个体数。当0 < V≤1时,判定物种之间有正协调关系;当-1≤V < 0时,判定物种之间有负协调关系;当V=0时,可以判定A和B无协调关系。
1.3 统计学分析使用Excel 2013软件对原始数据进行录入及整理,用SPSS 19.0软件进行统计学分析。资料类型为计数资料。使用Fisher’s精确检验判断革螨和蝙蝠蝇的感染率之间差异是否存在统计学意义;使用K-S检验(Kolmogorov-Smirnov test)验证革螨和蝙蝠蝇的感染多度和感染强度数据是否符合正态分布,并根据检验结果选用独立样本t检验或非参数秩和检验判断感染强度差异是否有统计学意义。使用配对卡方检验明确不同寄生虫物种间的协调系数是否有统计学意义。通过皮尔逊卡方检验判断革螨感染率的性别差异是否有统计学意义。以Fisher’s精确检验确定总体表寄生虫和蝙蝠蝇感染率的性别差异是否有统计学意义。采用非参数秩和检验判断总体表寄生虫、革螨、蝙蝠蝇的感染多度和感染强度的性别差异是否有统计学意义。当P < 0.05时差异有统计学意义。
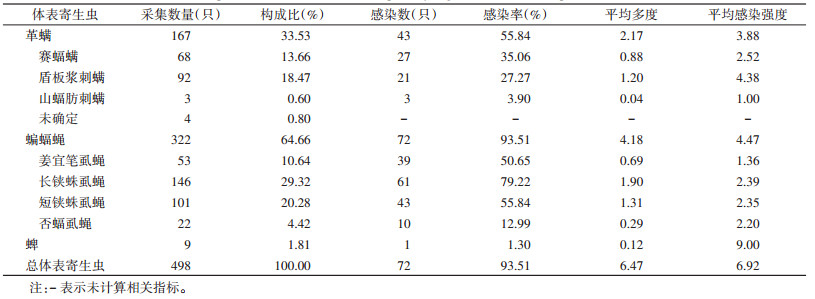
2 结果 2.1 亚洲长翼蝠体表寄生虫感染情况在6个采样点中,共捕捉到77只亚洲长翼蝠,在昆明市富民县,昆明市晋宁区,楚雄州牟定县,曲靖市沾益区,大理州宾川县和普洱市思茅区分别捕捉到47、8、2、7、12、1只,其中雄性59只,雌性18只。有72只蝙蝠感染寄生虫,感染率为93.51%。从蝙蝠体表共采集到498只寄生虫,各采样点采集的种类和数量见表 1。由于本次所采集样本中蜱数量较少,且多为幼虫(缺少相关的鉴定资料),故未对蜱类进行物种鉴定和后续分析。革螨和蝙蝠蝇为亚洲长翼蝠体表的优势寄生虫类群,共占其体表寄生虫总数的98.19%。蝙蝠蝇的感染率和感染多度均大于革螨(感染率:P=0.014;感染多度:U=1 714.50,P=0.001),但二者的感染强度差异无统计学意义(U=1 414.50,P=0.435)。通过物种优势度指数的计算,确定长铗蛛虱蝇(Nycteribia allotopa)(Y=0.293)和短铗蛛虱蝇(N. parvula)(Y=0.203)为优势寄生虫物种,形态特征见图 1、2。
|

|
| 注:a腹侧面观;b背侧面观。 图 1 雌性长铗蛛虱蝇(×40) Figure 1 Female Nycteribia allotopa (×40) |
| |

|
| 注:a腹侧面观;b背侧面观。 图 2 雌性短铗蛛虱蝇(×40) Figure 2 Female Nycteribia parvula (×40) |
| |
43只亚洲长翼蝠体表寄生革螨,感染率为55.84%(43/77)。经鉴定,所采集革螨隶属2科3属3种,其中盾板浆刺螨(Ichoronyssus scutatus)数量最多,占革螨总数的55.09%(92/167),其次为赛蝠螨(Spinturnix psi),占40.72%(68/167),山蝠肪刺螨(Steatonyssus nyctali)仅有3只(占1.80%)。此外,有4只革螨样本被损坏,无法进行物种鉴定。见表 2。
|
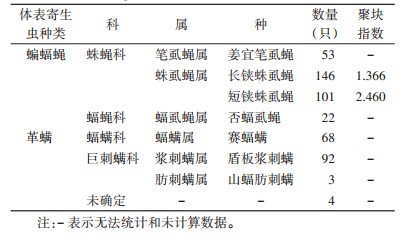
亚洲长翼蝠蝙蝠蝇的感染率为93.51%(72/77)。采集的蝙蝠蝇经鉴定,分别隶属于蛛蝇科(Nycteribiidae,300只)和蝠蝇科(Streblinae,22只)。其中蛛蝇科包含长铗蛛虱蝇、短铗蛛虱蝇和姜宜笔虱蝇(Penicillidia jenynsii)3个种,分别占蝙蝠蝇总数的45.34%(146/322)、31.37%(101/322)和16.46%(53/322);蝠蝇科的22只个体全部为否蝠虱蝇(Brachytarsina kanoi),占比为6.83%。长铗蛛虱蝇和短铗蛛虱蝇的聚块指数均大于临界值,2种蝙蝠蝇在不同的亚洲长翼蝠个体体表间呈聚集分布。见表 3。
|
选择长铗蛛虱蝇和短铗蛛虱蝇进行种间协调关系分析,两者之间存在显著正协调关系(V=0.248,P=0.026)。
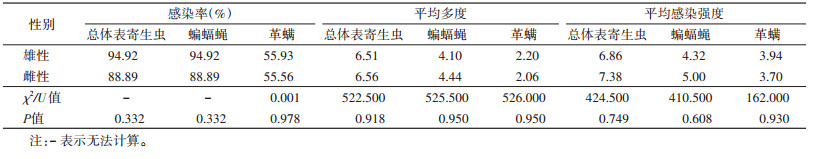
2.5 雌、雄亚洲长翼蝠体表寄生虫感染比较雌、雄亚洲长翼蝠个体间的总体表寄生虫、革螨、蝙蝠蝇感染率差异均无统计学意义(均P > 0.05)。总体表寄生虫、革螨、蝙蝠蝇的平均多度(U=522.500、525.500、526.000,均P > 0.05)和平均感染强度(U=424.500、410.500、162.000,均P > 0.05)在雌、雄亚洲长翼蝠个体间差异也无统计学意义。见表 4。
|
体表寄生虫是多种致病性病原体经动物个体传播人类的重要媒介。作为自然界的“病毒储藏库”,蝙蝠及其体表寄生虫一直是流行病学研究的重点关注类群。本文以云南省境内广泛分布的亚洲长翼蝠为宿主对象,通过一定范围的样本采集及后续鉴定分析,系统揭示其体表寄生虫感染和分布情况。
本研究从云南省6个采样点的77只亚洲长翼蝠体表共采集到寄生虫498只,包括革螨167只(2科3属3种),蝙蝠蝇322只(2科3属4种),以及蜱9只。Postawa和Furman[12]在对普通长翼蝠(M. schreibersi)和南长翼蝠(M. pusillus)体表寄生虫的研究中得到相似结果:(1)在所有体表寄生虫类群中,蝙蝠蝇占比最高,为优势寄生虫类群,其主要包括叉笔虱蝇(P. dufourii)、N. schmidlii和P. conspicua 3种。(2)体表寄生的蝙蝠蝇与本研究中亚洲长翼蝠体表的蝙蝠蝇隶属同一属,如N. schmidlii隶属蛛虱蝇属,叉笔虱蝇和P. conspicua隶属笔虱蝇属。(3)体表寄生的革螨类群与本研究中亚洲长翼蝠体表的革螨类群中均有赛蝠螨,且数量相对较多。据此推测,亲缘关系较近(同科或同属)的蝙蝠物种间,其体表多寄生同一种或同一类群的寄生虫物种,即蝙蝠体表寄生虫具有较强的宿主特异性。令人意外的是,与其他一些动物类群(如啮齿类、鼩鼱类)相比,蝙蝠体表寄生虫的种类和数量明显较少,陈雁翎等[13]在东亚屋顶鼠(Rattus brunneusculus)的体表采集到螨类5 252只,经鉴定为6科29属151种;李贝等[14]在短尾鼩(Anourosorex squamipes)体表采集到螨类共15 541只,鉴定为10科24属103种。这种差异可能是因为蝙蝠体表寄生虫具有较高的宿主特异性,即某一蝙蝠物种体表只能寄生特定的物种或类群所致[15]。
本次调查共发现72只亚洲长翼蝠体表寄生蝙蝠蝇,感染率达93.51%,包括长铗蛛虱蝇、短铗蛛虱蝇和姜宜笔虱蝇3种。在此之前,部分研究者在对韩国、日本和中国台湾地区所分布亚洲长翼蝠体表寄生虫的研究中,同样发现了这3种蛛蝇,与本研究相似[16-17],提示蝙蝠体表寄生虫的感染具有较高的宿主特异性,并不受蝙蝠所在地域的影响。作为蝙蝠体表的专性寄生虫,蝙蝠蝇一直被视为蝙蝠体内病原体向外传播的重要潜在媒介[18]。Sándor等[19]在东欧地区的蝙蝠及其体表所寄生的蛛蝇中均检测到与疟疾有关的血孢子虫(Polychromophilus melanipherus),同时发现体表寄生有蛛蝇的蝙蝠宿主体内更容易有血孢子虫的存在;Lee等[17]在韩国亚洲长翼蝠体表所寄生的蝙蝠蝇中检测到了巴尔通体和沃尔巴克氏体。截至目前,尚无系统研究揭示蝙蝠蝇传播病原体的具体路径,对其是否能够将病原体传播给人类而引发疾病也缺乏足够证据。
与蝙蝠蝇相比,本研究中亚洲长翼蝠体表所感染革螨数量较少,包括赛蝠螨(68只)、盾板浆刺螨(92只)和山蝠肪刺螨(3只)3种,均不是优势寄生虫物种。大量研究发现,盾板浆刺螨可寄生普通长翼蝠[20]、地中海菊头蝠(Rhinolophus euryale)[17]和大鼠耳蝠(Myotis myotis)[21]等;赛蝠螨可寄生普通长翼蝠、南长翼蝠[12]、马铁菊头蝠(R. ferrumequinum)[22]、尖耳鼠耳蝠(M. blythii)[23]和大鼠耳蝠[21]等。由此推测,蝙蝠体表寄生革螨可感染宿主种类较多,其宿主特异性相比蝙蝠蝇较低。作为一种在脊椎动物体表广泛存在的寄生虫,许多证据均表明革螨是多种人兽共患病病原体的储存宿主和潜在传播媒介,如传播立克次体导致立克次体痘(Rickettsial pox),传播汉坦病毒引起肾综合征出血热等[9]。在对蝙蝠体表寄生革螨的流行病学调查研究中,Reeves等[24]在长翼蝠属蝙蝠体表采集的赛蝠螨中,利用分子学手段检测到嗜吞噬细胞无形体(Anaplasma phagocytophilum),蝙蝠体表革螨可能也是多种病原体的潜在传播媒介,但相关问题仍待进一步研究。
本研究对云南省部分地区亚洲长翼蝠体表寄生虫的感染情况进行了系统分析,为亚洲长翼蝠体表寄生虫的相关研究奠定基础。但本研究采集到的亚洲长翼蝠数量较少,并且采集点仅限于云南省。因此,更多的工作仍待开展:①扩大采样范围,探究整个中国境内亚洲长翼蝠体表寄生虫的感染情况;②扩大蝙蝠宿主样本量,丰富我国蝙蝠体表寄生虫的调查和研究;③开展流行病学研究,明确我国境内亚洲长翼蝠或其他蝙蝠宿主体表寄生虫是否携带致病性病原体,且是否能够感染人类而引发疾病。
利益冲突 无
| [1] |
范宝珠, 黄晓宾, 郭宪国, 等. 云南省中华菊头蝠体表寄生虫感染状况[J]. 中国热带医学, 2022, 22(3): 229-233. Fan BZ, Huang XB, Guo XG, et al. Ectoparasites on body surface of Rhinolophus sinicus in Yunnan[J]. China Trop Med, 2022, 22(3): 229-233. DOI:10.13604/j.cnki.46-1064/r.2022.03.07 |
| [2] |
Fenton MB, Mubareka S, Tsang SM, et al. COVID-19 and threats to bats[J]. Facets, 2020, 5(1): 349-352. DOI:10.1139/facets-2020-0028 |
| [3] |
Brook CE, Bai Y, Dobson AP, et al. Bartonella spp. in fruit bats and blood-feeding ectoparasites in Madagascar[J]. PLoS Negl Trop Dis, 2015, 9(2): e0003532. DOI:10.1371/journal.pntd.0003532 |
| [4] |
Morand S, Krasnov BR, Poulin R. Micromammals and macroparasites: From evolutionary ecology to management[M]. Tokyo: Springer, 2006: 179-194. DOI:10.1007/978-4-431-36025-4
|
| [5] |
Kimprasit T, Nunome M, Iida K, et al. Dispersal history of Miniopterus fuliginosus bats and their associated viruses in east Asia[J]. PLoS One, 2021, 16(1): e0244006. DOI:10.1371/journal.pone.0244006 |
| [6] |
潘清华, 王应祥, 岩崑. 中国哺乳动物彩色图鉴[M]. 北京: 中国林业出版社, 2007: 41-76. Pan QH, Wang YX, Yan K. A field guide to the mammals of China[M]. Beijing: China Forestry Press, 2007: 41-76. |
| [7] |
中国科学院中国动物志编辑委员会. 中国经济昆虫志. 第四十册. 蜱螨亚纲: 皮刺螨总科[M]. 北京: 科学出版社, 1993: 301-366. Editorial Committee of Zoology of China, Chinese Academy of Sciences. Economic insect fauna of China, Fasc. 40, Acari: Dermanyssoideae[M]. Beijing: Science Press, 1993: 301-366. |
| [8] |
Theodor O. An illustrated catalogue of the Rothschild collection of Nycteribiidae[M]. London: The British Museum, 1967: 43-46.
|
| [9] |
丁帆, 刘昕航, 郭宪国, 等. 云南省锡金小鼠体表革螨感染分析[J]. 动物学杂志, 2021, 56(2): 240-246. Ding F, Liu XH, Guo XG, et al. Analysis of gamasid mites (Acari: Mesostigmata) on Mus pahari in Yunnan province[J]. Chin J Zool, 2021, 56(2): 240-246. DOI:10.13859/j.cjz.202102009 |
| [10] |
张聪, 葛星, 赵磊, 等. 双斑长跗萤叶甲越冬卵在玉米田的空间分布型[J]. 生态学报, 2013, 33(11): 3452-3459. Zhang C, Ge X, Zhao L, et al. The spatial distribution pattern of overwintering egg of Monolepta hieroglyphica (Motschulsky) in corn field[J]. Acta Ecol Sin, 2013, 33(11): 3452-3459. DOI:10.5846/stxb201203210387 |
| [11] |
Liu Z, Guo XG, Fan R, et al. Ecological analysis of gamasid mites on the body surface of Norway rats (Rattus norvegicus) in Yunnan province, Southwest China[J]. Biologia, 2020, 75(9): 1325-1336. DOI:10.2478/s11756-019-00383-z |
| [12] |
Postawa T, Furman A. Abundance patterns of ectoparasites infesting different populations of Miniopterus species in their contact zone in Asia Minor[J]. Acta Chiropt, 2014, 16(2): 387-395. DOI:10.3161/150811014X687341 |
| [13] |
陈雁翎, 郭宪国, 任天广, 等. 云南省2001-2015年东亚屋顶鼠体表螨类生态学分析[J]. 中华疾病控制杂志, 2021, 25(12): 1470-1475. Chen YL, Guo XG, Ren TG, et al. Ecological analysis of mites on the body surface of Rattus brunneusculus in Yunnan province from 2001 to 2015[J]. Chin J Dis Control Prev, 2021, 25(12): 1470-1475. DOI:10.16462/j.cnki.zhjbkz.2021.12.020 |
| [14] |
李贝, 郭宪国, 任天广, 等. 云南省短尾鼩体表螨类感染及相关生态分析[J]. 动物学杂志, 2021, 56(5): 686-695. Li B, Guo XG, Ren TG, et al. Infestation and related ecological analyses of mites on mole shrews (Anourosorex squamipes) in Yunnan province[J]. Chin J Zool, 2021, 56(5): 686-695. DOI:10.13859/j.cjz.202105006 |
| [15] |
Pejić B, Budinski I, Van Schaik J, et al. Sharing roosts but not ectoparasites: High host-specificity in bat flies and wing mites of Miniopterus schreibersii and Rhinolophus ferrumequinum (Mammalia: Chiroptera)[J]. Curr Zool, 2022, 68(5): 507-516. DOI:10.1093/cz/zoab086 |
| [16] |
Nabeshima K, Sato S, Kabeya H, et al. Detection and phylogenetic analysis of Bartonella species from bat flies on eastern bent-wing bats (Miniopterus fuliginosus) in Japan[J]. Comp Immunol Microbiol Infect Dis, 2020, 73: 101570. DOI:10.1016/j.cimid.2020.101570 |
| [17] |
Lee H, Seo MG, Lee SH, et al. Relationship among bats, parasitic bat flies, and associated pathogens in Korea[J]. Parasites Vectors, 2021, 14(1): 503. DOI:10.1186/s13071-021-05016-6 |
| [18] |
Tai YL, Lee YF, Kuo YM, et al. Effects of host state and body condition on parasite infestation of bent-wing bats[J]. Front Zool, 2022, 19(1): 12. DOI:10.1186/s12983-022-00457-w |
| [19] |
Sándor AD, Péter Á, Corduneanu A, et al. Wide distribution and diversity of malaria-related haemosporidian parasites (Polychromophilus spp.) in bats and their ectoparasites in Eastern Europe[J]. Microorganisms, 2021, 9(2): 230. DOI:10.3390/microorganisms9020230 |
| [20] |
Cicek H, Stanyukovich MK, Yagci S, et al. Gamasine mite (Parasitiformes, Mesostigmata) infestations of bats (Mammalia, Chiroptera) in Turkey[J]. Acta Parasitol, 2007, 52(3): 247-249. DOI:10.2478/s11686-007-0038-8 |
| [21] |
Uhrin M, Kaňuch P, Krištofík J, et al. Phenotypic plasticity in the greater mouse-eared bat in extremely different roost conditions[J]. Acta Theriol, 2010, 55(2): 153-164. DOI:10.4098/j.at.0001-7051.073.2009 |
| [22] |
田庆云, 顾以铭. 山西省蝙蝠体上的革螨及巨刺螨属二新种的记述(蜱螨亚纲: 蝠螨科、巨刺螨科)[J]. 动物分类学报, 1992, 17(1): 37-41. Tian QY, Gu YM. Gamasid mites on bat from Shanxi with descriptions of two new species of Macronyssus (Acari: Spinturnicidae, Macronyssidae)[J]. Acta Zootaxonom Sin, 1992, 17(1): 37-41. |
| [23] |
Burazerović J, Orlova M, Obradović M, et al. Patterns of abundance and host specificity of bat ectoparasites in the central Balkans[J]. J Med Entomol, 2018, 55(1): 20-28. DOI:10.1093/jme/tjx189 |
| [24] |
Reeves WK, Dowling APG, Dasch GA. Rickettsial agents from parasitic dermanyssoidea (Acari: Mesostigmata)[J]. Exp Appl Acarol, 2006, 38(2): 181-188. DOI:10.1007/s10493-006-0007-1 |
 2023, Vol. 34
2023, Vol. 34


