扩展功能
文章信息
- 张晓云, 刘正祥, 苏丽琼, 罗剑龙, 朱春文, 和凤英, 孙克香, 邵宗体, 蔡文凤
- ZHANG Xiao-yun, LIU Zheng-xiang, SU Li-qiong, LUO Jian-long, ZHU Chun-wen, HE Feng-ying, SUN Ke-xiang, SHAO Zong-ti, CAI Wen-feng
- 云南省鹤庆县2011-2020年动物鼠疫监测结果分析
- Surveillance results of animal plague in Heqing county, Yunnan province, China, 2011-2020
- 中国媒介生物学及控制杂志, 2023, 34(3): 344-350, 355
- Chin J Vector Biol & Control, 2023, 34(3): 344-350, 355
- 10.11853/j.issn.1003.8280.2023.03.011
-
文章历史
- 收稿日期: 2023-01-10
2 云南省地方病防治所, 云南省鼠疫防治研究中心, 云南省自然疫源性疾病防控技术重点实验室, 云南 大理 671000;
3 大理白族自治州疾病预防控制中心, 云南 大理 671000;
4 鹤庆县疾病预防控制中心, 云南 鹤庆 671500
2 Provincial Key Laboratory for Zoonosis Control and Prevention, Yunnan Center of Plague Control and Prevention, Yunnan Institute of Endemic Diseases Control and Prevention, Dali, Yunnan 671000, China;
3 Dali Bai Autonomous Prefecture Center for Disease Control and Prevention, Dali, Yunnan 671000, China;
4 Heqing Center for Disease Control and Prevention, Heqing, Yunnan 671500, China
鼠疫是由鼠疫耶尔森菌(鼠疫菌)感染引发的一种传染性强、病死率高的自然疫源性疾病,啮齿动物是主要宿主,蚤类是主要传播媒介。云南省鼠疫流行历史悠久,比较确切的文字记载为《鹤庆县志》“乾隆三十七年(1772)鼠疫人,继之次年又疫。”[1]。目前云南省存在家、野鼠两型鼠疫疫源地,即黄胸鼠(Rattus tanezumi)鼠疫疫源地和齐氏姬鼠(Apodemus chevrieri)-大绒鼠(Eothenomys miletus)鼠疫疫源地[2]。1975年在剑川县发现野鼠鼠疫自然疫源地[3],疫源地范围包括剑川、玉龙、古城、鹤庆等4个县(区),总面积约2 800 km2,曾于1976-1995年发生动物鼠疫流行。2005年以前30年间云南省野鼠鼠疫疫源地未发生过人间鼠疫[4]。2005年11月,丽江市玉龙县发生5例人间肺鼠疫病例,2006年调查证实玉龙县及古城区存在野鼠鼠疫疫源地[5]。近年来野鼠鼠疫疫源地处于持续活跃期[6-9]。鹤庆县位于大理白族自治州北部,东以金沙江与永胜县分津,南与宾川县接界,西与剑川、洱源两县接壤,北与丽江市毗邻。鹤庆县曾于1772-1773、1776-1796、1879-1888年有过3次较大的鼠疫流行,从1985年开展鼠疫监测工作,32年未发现鼠疫疫情。2017年4月,鹤庆县在监测工作时,从草海镇马厂村的宿主动物中分离到鼠疫菌,在后续的疫情处置调查中从鼠、蚤共分离到10株鼠疫菌株,确定鹤庆县发生了动物鼠疫疫情[10]。为掌握鹤庆县鼠疫流行现状和鼠疫宿主动物及媒介蚤类的种群数量变化,预防和控制鼠疫疫情的发生和流行,本文统计分析了鹤庆县2011-2020年鼠疫监测数据,为指导今后鼠疫防治与监测工作提供参考依据。
1 材料与方法 1.1 资料来源2011-2020年鹤庆县鼠疫监测资料,来源于鼠疫防治管理信息系统、监测报表及防治总结。
1.2 监测方法 1.2.1 宿主动物和媒介监测按照《全国鼠疫监测方案》和《云南省鼠疫监测方案》要求,按固定监测点和流动监测点相结合,每年选择草海和云鹤镇作为固定监测点,每月监测1次;在其余乡镇中每月选择1个作为流动监测点进行循环监测。居民区采用笼夜法,农耕区采用5 m夹线法,对2种生境中的小型兽类(小兽)进行调查取样。计算小兽构成比、密度、染蚤率和蚤指数。
1.2.2 实验室病原学和免疫学检测按照《鼠疫诊断标准》(WS279-2008)进行实验室检测,对捕获小兽和梳检的蚤类进行鼠疫菌分离培养;对活鼠经乙醚麻醉检蚤后采血,进行间接血凝试验(IHA)鼠疫F1抗体检测;对可疑材料或自毙鼠进行鼠疫菌分离培养和反向间接血凝试验(RIHA)鼠疫F1抗原检测。
1.3 统计学分析用Excel 2010软件建立数据库,用SPSS 20.0软件进行数据统计分析,率的比较采用χ2检验,小兽体蚤指数比较采用t检验,以P < 0.05为差异有统计学意义。
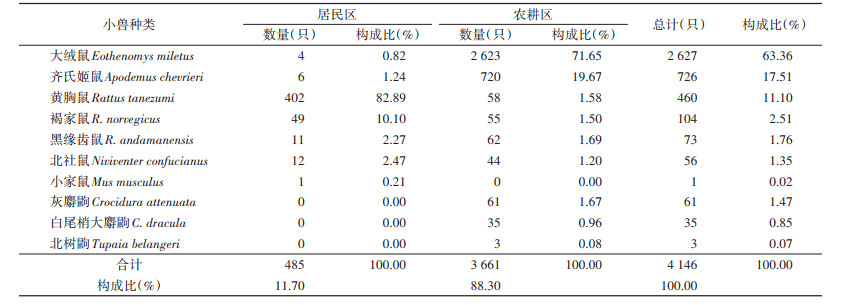
2 结果 2.1 宿主监测2011-2020年共捕获小兽2目4科7属10种4 146只。动物鼠疫监测捕获小兽以大绒鼠、齐氏姬鼠和黄胸鼠为主,构成比分别为63.36%、17.51%和11.10%,其他种类仅占8.03%。居民区和农耕区小兽构成比分别为11.70%和88.30%。居民区以黄胸鼠和褐家鼠(R. norvegicus)为优势种,构成比分别为82.89%和10.10%。农耕区以大绒鼠和齐氏姬鼠为优势种,构成比分别为71.65%和19.67%。见表 1。
|
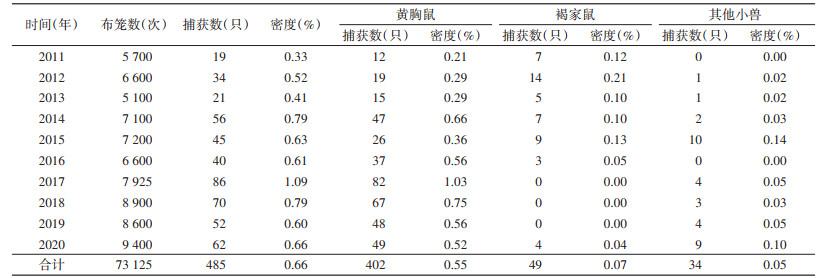
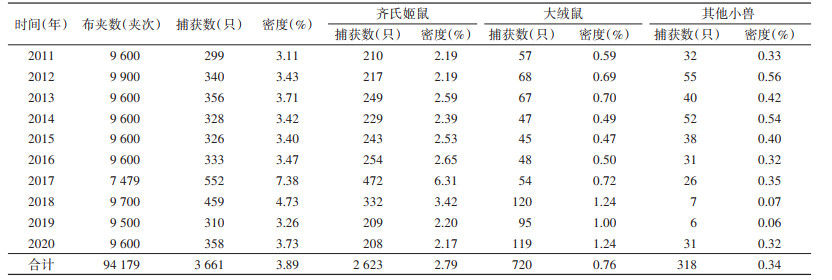
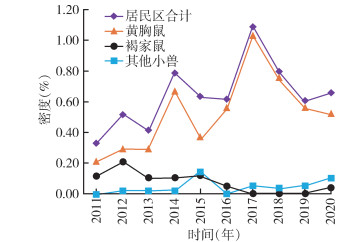
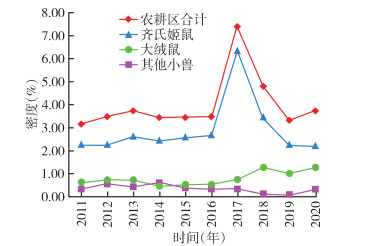
居民区小兽总密度为0.66%[95%置信区间(CI):0.49%~0.80%],年平均密度在0.33%~1.09%,小兽密度2017年明显增高达1.09%,其余各年呈起伏波动变化趋势;居民区黄胸鼠密度各年间呈起伏波动变化趋势,以2017年达到最高为1.03%,居民区褐家鼠密度各年间变化不大,处于较低水平,黄胸鼠和褐家鼠平均密度分别为0.55%和0.07%,差异有统计学意义(χ2=277.150,P < 0.001)。农耕区小兽密度为3.89%(95%CI:3.05%~4.88%),年平均密度在3.11%~7.38%,小兽密度2017年明显增高达7.38%,其余各年无明显变化,保持在3%以上;农耕区齐氏姬鼠密度2017年明显增高达6.31%,其余各年无明显变化,农耕区大绒鼠密度各年间无明显变化,2017年后呈略微升高,农耕区齐氏姬鼠和大绒鼠平均密度分别为2.79%和0.76%,差异有统计学意义(χ2=1 102.855,P < 0.001)。居民区与农耕区小兽密度之间差异亦有统计学意义(χ2=1 770.463,P < 0.001)。见表 2、3,图 1、2。
|
|
|
| 图 1 2011-2020年云南省鹤庆县动物鼠疫监测居民区主要宿主密度年度变化 Figure 1 Annual changes in density of main hosts in residential areas in animal plague surveillance in Heqing county, Yunnan province, 2011-2020 |
| |
|
| 图 2 2011-2020年云南省鹤庆县动物鼠疫监测农耕区主要宿主密度年度变化 Figure 2 Annual changes in density of main hosts in farming areas in animal plague surveillance in Heqing county, Yunnan province, 2011-2020 |
| |
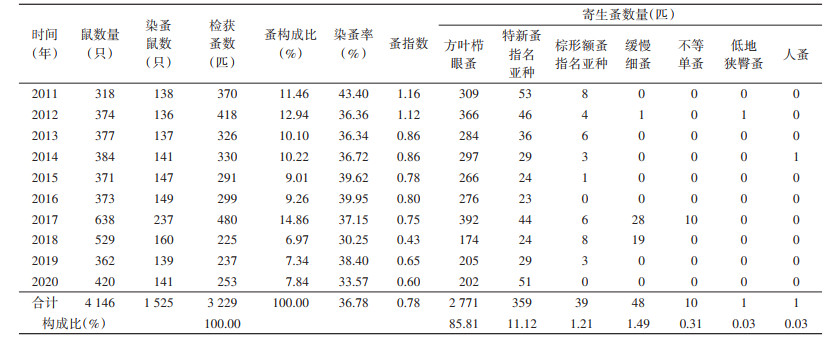
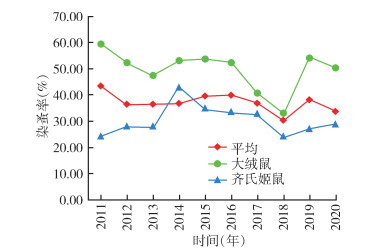
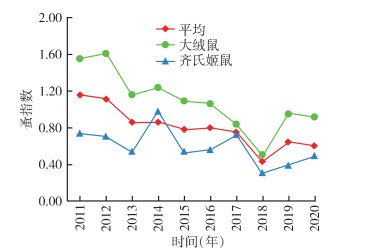
2011-2020年10年动物鼠疫监测从1 525只小兽梳检体表寄生蚤4科7属7种3 229匹,染蚤率为36.78%[95%CI:34.60%~39.75%],年平均染蚤率在30.25%~43.40%,染蚤率2018年最低,为30.25%,总体上各年无明显变化;蚤指数为0.78(95%CI:0.64~0.96),年平均蚤指数在0.43~1.16,蚤指数2018年最低,为0.43,总体呈逐年下降趋势。方叶栉眼蚤(Ctenophthalmus quadratus)和特新蚤指名亚种(Neopsylla specialis specialis)为小兽体表寄生蚤优势种,构成比分别为85.81%和11.12%;缓慢细蚤(Leptopsylla segnis)、棕形额蚤指名亚种(Frontopsylla spadix spadix)、不等单蚤(Monopsyllus anisus)、低地狭臀蚤(Stenischia humilis)和人蚤(Pulex irritans)合计构成比仅占3.07%;未见有印鼠客蚤(Xenopsylla cheopis)分布。见表 4,图 3、4。
|
|
| 图 3 2011-2020年云南省鹤庆县动物鼠疫监测主要宿主染蚤率年度变化 Figure 3 Annual changes in flea infestation rate of main hosts in animal plague surveillance in Heqing county, Yunnan province, 2011-2020 |
| |
|
| 图 4 2011-2020年云南省鹤庆县动物鼠疫监测主要宿主体蚤指数年度变化 Figure 4 Annual changes in flea index of main hosts in animal plague surveillance in Heqing county, Yunnan province, 2011-2020 |
| |
10年间主要宿主大绒鼠染蚤率总体上呈降低-升高-降低波动趋势,以2018年最低,为32.73%,主要宿主齐氏姬鼠染蚤率总体上呈升高-降低-升高波动趋势,以2018年最低,为23.97%,齐氏姬鼠和大绒鼠平均染蚤率分别为29.20%和47.96%,差异有统计学意义(χ2=81.303,P < 0.001)。齐氏姬鼠和大绒鼠各年蚤指数总体上均呈下降趋势,均以2018年最低,分别为0.31和0.49,齐氏姬鼠和大绒鼠平均体蚤指数分别为0.55和1.04,差异亦有统计学意义(t=3.641,P=0.002)。主要宿主齐氏姬鼠和大绒鼠体表主要媒介特新蚤指名亚种蚤指数分别为0.36和0.03,差异有统计学意义(t=9.639,P < 0.001)。见表 5,图 3、4。
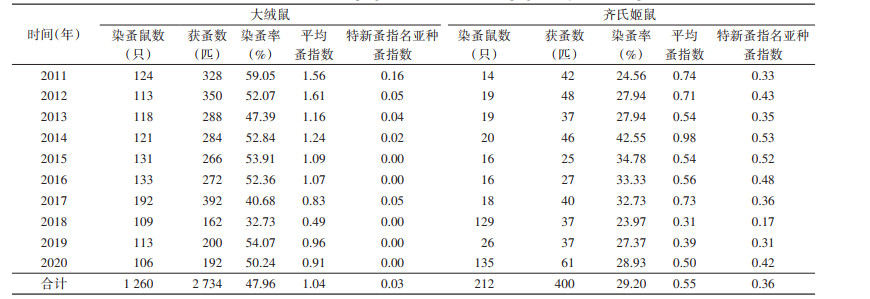
|
2011-2020年细菌学检验宿主动物4 078只,2017年检出鼠疫菌7株(大绒鼠6株、齐氏姬鼠1株),阳性率为1.08%,其余均为阴性;细菌学检验媒介蚤类1 587组,2017年检出鼠疫菌3株(特新蚤指名亚种2株、方叶栉眼蚤1株),阳性率为1.18%;IHA检测动物血清标本1 712份,鼠疫F1抗体均为阴性;RIHA检测动物脏器354份,鼠疫F1抗原阳性3份,均为2017年活鼠检出。见表 6。
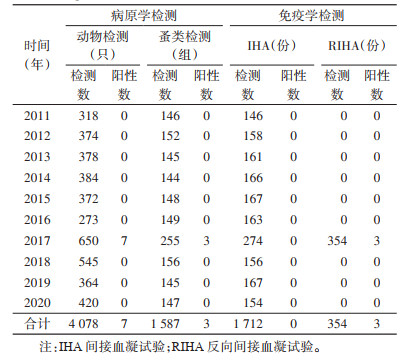
|
鼠疫监测在鼠疫防控中起着至关重要的作用,动物鼠疫监测是鼠疫监测的重要组成部分,往往在极小概率动物将鼠疫传播给人类之前,动物间鼠疫已经发生和流行,因此,对宿主和媒介的现场监测调查和实验室检测可及早发现疫情,采取有效防控措施,避免动物鼠疫波及人间,起到了鼠疫防控“关口前移”的关键作用。
监测主要宿主动物和主要媒介昆虫的数量及组成变化是监测工作的重要环节。2011-2020年鹤庆县监测结果显示,宿主和媒介构成优势种突出,大绒鼠的构成比远大于齐氏姬鼠,与毗邻地区丽江鼠疫疫源地[11-12]和剑川鼠疫疫源地[13-14],以及既往鹤庆县调查有所不同[15],鹤庆鼠疫疫源地与丽江鼠疫疫源地和剑川新发鼠疫疫源地同属一座山脉,彼此相连无天然屏障,其原因有待进一步探究。对比分析发现常规监测面积和监测时间有局限性,尚未能掌握当地宿主动物和媒介昆虫群落结构情况,提示针对重点地区的动物鼠疫监测工作,除需重点关注宿主媒介优势种和主要宿主媒介外,可考虑常规监测和不定期开展鼠疫疫源地调查相结合的方式,以全面掌握宿主、媒介和病原在一定地理景观条件的组成分布和相互关系,掌握疫源地分布范围、流行强度和变化规律。
动物间鼠疫的发生与主要宿主动物密度密切相关,密度增高,发生动物间鼠疫的风险增大[16],小兽染蚤率、蚤指数的高低,与鼠疫在鼠间的流行强度以及波及人间的概率密切相关[17],流行高峰往往与主要宿主动物和媒介高峰相一致[18-19]。既往防控经验认为,在家鼠鼠疫疫源地,当黄胸鼠和印鼠客蚤在当地鼠、蚤群落中构成比占70%以上、室内黄胸鼠密度达5%以上和黄胸鼠鼠体印鼠客蚤指数 > 1以上,3项指标同时存在时,是鼠间鼠疫流行前期的预兆。若将黄胸鼠密度长期控制在室内1%以下(笼捕密度),室外2%以下(夹捕密度),且黄胸鼠鼠体印鼠客蚤指数≤0.5,则鼠疫流行即可得到控制。但在不同时期、不同地区也并非完全符合此情况。家鼠鼠疫疫源地研究提示[20-22],鼠疫流行强度与主要宿主黄胸鼠密度及其寄生主要媒介印鼠客蚤指数有一定关系。主要宿主黄胸鼠密度年际变化和季节消长不明显,其密度达到一定水平即足以保持鼠疫流行的强度,但鼠疫流行强弱及季节性变化与黄胸鼠密度季节消长并不一致;而主要媒介印鼠客蚤季节消长变化明显,且与鼠疫流行的季节性基本一致,说明家鼠鼠疫流行好发季节并不是由黄胸鼠密度高低决定,导致鼠疫流行季节变化的因素可能是鼠疫的主要媒介印鼠客蚤季节消长所致。本监测结果显示,主要宿主齐氏姬鼠和大绒鼠密度和主要宿主鼠体特新蚤指名亚种蚤指数均未达到《云南省鼠疫预防控制应急预案》预警值,而仅2017年鼠密度相对其他年度有所增高,提示疫源地宿主动物和媒介昆虫种群密度变化、季节消长与动物鼠疫的关系,以及监测风险预警值指标的制定值得深入研究。监测结果显示,鹤庆县尚未发现云南家鼠鼠疫疫源地的主要媒介印鼠客蚤,加之家栖鼠及其体表寄生蚤密度较低,提示该疫源地动物疫情通过家栖鼠体表寄生蚤传给人的风险较低,但鼠疫疫源地生态环境复杂,村庄、耕地、林地相互交织,居民在生产生活中接触传染源或感染病原体的风险依然存在。
鼠疫的发生和流行是自然疫源地宿主、媒介和病原体相互作用的结果,受自然地理环境、气候变化和人为干扰等多因素多水平的影响。鹤庆县1985-2016年开展鼠疫监测工作32年,未发现鼠疫阳性线索。2017年监测中从活鼠体内检出鼠疫菌及时发现并控制鼠疫疫情[10],表明当前监测方法和防控措施仍行之有效。坚持常规鼠疫监测,不断提高监测敏感性非常重要。相关研究显示,鹤庆县分离鼠疫菌株与丽江野鼠鼠疫疫源地菌株具有很高的同源性,鹤庆县与丽江市同属于一块鼠疫疫源地[23]。鉴于鹤庆县主要宿主的染蚤率均较高,齐氏姬鼠体蚤中主要媒介特新蚤指名亚种比例也较高,加之该疫源地鼠疫菌株毒力强,近年这块鼠疫疫源地鼠间疫情持续活跃,并呈现不断扩大的趋势[9],鹤庆县发生鼠疫流行的风险高,对疫区群众的潜在威胁较大。建议今后应加强鼠疫监测防治业务培训和现场指导,提高宿主和媒介监测质量,适当扩大监测调查范围,强化监测预警和风险评估,及时控制动物鼠疫的扩散;同时,加强鼠防知识宣传教育,提高居民防护意识,严格落实“疫情三报”和自毙鼠“零报告”制度,经常性开展爱国卫生除害防病活动,整治鼠、蚤孳生环境,开展预防性灭鼠灭蚤,有效降低鼠疫流行和波及人间的风险,保护人民群众的生命和财产安全。
志谢 鹤庆县疾病预防控制中心各位领导及鼠防同仁给予工作上的支持,特此志谢利益冲突 无
| [1] |
孟庆云. "人见死鼠如见虎": 鼠疫的三次世界性大流行[J]. 中国中医基础医学杂志, 2003, 9(8): 42-44. Meng QY. "People see a dead rat like a tiger": Three world pandemics of plague[J]. Chin J Basic Med Traditi Chin Med, 2003, 9(8): 42-44. DOI:10.3969/j.issn.1006-3250.2003.08.017 |
| [2] |
丛显斌, 刘振才. 中国鼠疫及其防治(2001-2010)上册[M]. 长春: 吉林科学技术出版社, 2014: 2. Cong XB, Liu ZC. Plague and its control in China: Volume 1, 2001-2010[M]. Changchun: Jilin Science and Technology Press, 2014: 2. |
| [3] |
董兴齐, 宋志忠, 梁云, 等. 云南省野鼠鼠疫现状及疫源地毗邻关系研究[J]. 昆明医学院学报, 2009, 30(8): 21-25. Dong XQ, Song ZZ, Liang Y, et al. The epidemic situation and neighbour relationship of wild rodent plague in Yunnan province[J]. J Kunming Med Univ, 2009, 30(8): 21-25. |
| [4] |
苏丽琼, 梁云, 吴鹤松, 等. 云南省1986-2014年人间鼠疫流行病学特征分析[J]. 中国媒介生物学及控制杂志, 2016, 27(4): 386-388, 392. Su LQ, Liang Y, Wu HS, et al. Human plague epidemiological feature analysis in Yunnan province from 1986 to 2014[J]. Chin J Vector Biol Control, 2016, 27(4): 386-388, 392. DOI:10.11853/j.issn.1003.8280.2016.04.019 |
| [5] |
宋志忠, 夏连续, 梁云, 等. 云南玉龙及古城区鼠疫自然疫源地判定及初步研究[J]. 中国地方病防治杂志, 2008, 23(1): 3-7. Song ZZ, Xia LX, Liang Y, et al. Confirmation and study of plague natural foci for Yulong county and Guchengqu in Yunnan province[J]. Chin J Ctrl Endem Dis, 2008, 23(1): 3-7. DOI:10.3969/j.issn.1001-1889.2008.01.002 |
| [6] |
谭红丽, 郭英, 杨文艳, 等. 丽江市古城区首次证实一起鼠间鼠疫疫情[J]. 中国人兽共患病学报, 2015, 31(11): 1086-1088. Tan HL, Guo Y, Yang WY, et al. Determination of a rat plague epidemic in ancient city administrative region of Lijiang, China[J]. Chin J Zoonoses, 2015, 31(11): 1086-1088. DOI:10.3969/j.issn.1002-2694.2015.11.021 |
| [7] |
王鹏, 张福新, 郭英, 等. 云南省玉龙县一起鼠间鼠疫的实验室判定[J]. 中国卫生检验杂志, 2015, 25(8): 1105-1107. Wang P, Zhang FX, Guo Y, et al. Laboratory determination of a rat plague epidemic in Yulong county of Yunnan province[J]. Chin J Health Lab Technol, 2015, 25(8): 1105-1107. |
| [8] |
洪梅, 郭英, 高子厚, 等. 2017年云南省剑川县新发疫点动物间鼠疫疫情调查[J]. 现代预防医学, 2018, 45(21): 4001-4004. Hong M, Guo Y, Gao ZH, et al. Epidemic situation of animal plague in new epidemic spot of Jianchuan, Yunnan, 2017[J]. Mod Prev Med, 2018, 45(21): 4001-4004. |
| [9] |
刘正祥, 蔡文凤, 邵宗体, 等. 2005-2017年云南省玉龙鼠疫自然疫源地鼠疫流行病学分析[J]. 疾病监测, 2019, 34(3): 237-240. Liu ZX, Cai WF, Shao ZT, et al. Plague epidemiology in natural plague foci in Yulong, Yunnan, 2005–2017[J]. Dis Surveill, 2019, 34(3): 237-240. DOI:10.3784/j.issn.1003-9961.2019.03.012 |
| [10] |
郭英, 段炳华, 洪梅, 等. 云南省鹤庆县首次在活鼠间发现鼠疫流行[J]. 中国人兽共患病学报, 2018, 34(9): 855-858, 863. Guo Y, Duan BH, Hong M, et al. Plague epidemic was first detected among live rats in Heqing county of Yunnan province[J]. Chin J Zoonoses, 2018, 34(9): 855-858, 863. DOI:10.3969/j.issn.1002-2694.2018.00.172 |
| [11] |
蔡文凤, 张福新, 王国良, 等. 玉龙县及古城区鼠疫疫源地小型兽类构成及群落多样性特征[J]. 中国地方病防治杂志, 2015, 30(5): 333-335. Cai WF, Zhang FX, Wang GL, et al. Structure and community diversity of small mammals in plague natural focus of Yulong county and Gucheng district[J]. Chin J Ctrl Endem Dis, 2015, 30(5): 333-335. |
| [12] |
邵宗体, 高子厚, 张长国, 等. 云南玉龙鼠疫疫源地宿主动物群落结构特征及其流行病学意义[J]. 中国人兽共患病学报, 2018, 34(9): 845-849, 854. Shao ZT, Gao ZH, Zhang CG, et al. Epidemiological significance on the community structures of host animals in Yulong natural plague foci, Yunnan province, China[J]. Chin J Zoonoses, 2018, 34(9): 845-849, 854. DOI:10.3969/j.issn.1002-2694.2018.00.143 |
| [13] |
蔡文凤, 罗剑龙, 苏丽琼, 等. 云南省剑川县2008-2017年鼠疫疫源地不同生境小型兽类群落多样性特征[J]. 中国热带医学, 2019, 19(5): 440-443. Cai WF, Luo JL, Su LQ, et al. Community diversity characteristics of small mammals in plage natural focus of Jianchuan county, Yunnan, 2008-2017[J]. China Trop Med, 2019, 19(5): 440-443. DOI:10.13604/j.cnki.46-1064/r.2019.05.09 |
| [14] |
苏超, 李玉琼, 王倩, 等. 云南省剑川县鼠疫自然疫源地宿主媒介情况分析[J]. 兽类学报, 2021, 41(3): 235-244. Su C, Li YQ, Wang Q, et al. Analysis of host and vectors in the plague natural foci of Jianchuan county, Yunnan province[J]. Acta Theriol Sin, 2021, 41(3): 235-244. DOI:10.16829/j.slxb.150519 |
| [15] |
张灿钟. 云南鹤庆县山地农耕区鼠、蚤的组成与分布分析[J]. 华南预防医学, 2012, 38(2): 44-45, 49. Zhang CZ. Analysis on the composition and distribution of rat and flea in the mountainous farming area of Heqing county, Yunnan province[J]. South China J Prev Med, 2012, 38(2): 44-45, 49. |
| [16] |
杜国义, 闫东. 动物间鼠疫流行与主要宿主密度相关性研究[J]. 中国媒介生物学及控制杂志, 2019, 30(4): 442-443, 450. Du GY, Yan D. A study of the correlation between plague epidemics among animals and the density of their hosts[J]. Chin J Vector Biol Control, 2019, 30(4): 442-443, 450. DOI:10.11853/j.issn.1003.8280.2019.04.020 |
| [17] |
赵智敏, 郑建忠. 山西省鼠疫流行病学调查结果[J]. 中国地方病学杂志, 2011, 30(4): 441-443. Zhao ZM, Zheng JZ. Epidemiological investigation results of plague in Shanxi province[J]. Chin J Endemiol, 2011, 30(4): 441-443. DOI:10.3760/cma.j.issn.1000-4955.2011.04.026 |
| [18] |
郭彦虎, 张涛. 宁夏沙鼠动物间鼠疫春季流行因素分析[J]. 宁夏医科大学学报, 2015, 37(2): 196-198. Guo YH, Zhang T. Epidemiological factors analysis of plague among gerbils in spring in Ningxia[J]. J Ningxia Med Univ, 2015, 37(2): 196-198. DOI:10.16050/j.cnki.issn1674-6309.2015.02.029 |
| [19] |
邵宗体, 浦恩念, 王国良, 等. 丽江野鼠鼠疫流行季节宿主动物及其寄生蚤群落结构与物种多样性[J]. 中国地方病防治, 2021, 36(2): 104-107. Shao ZT, Pu EN, Wang GL, et al. The community structures and species diversity of host animals and ectoparasite fleas in the season of animal plague prevalence in Lijiang plague natural foci[J]. Chin J Ctrl Endem Dis, 2021, 36(2): 104-107. |
| [20] |
赵文红, 郭牧, 苏丽琼, 等. 云南省盈江县鼠疫流行强度与黄胸鼠的消长关系[J]. 医学动物防制, 2018, 34(11): 1055-1059. Zhao WH, Guo M, Su LQ, et al. The relationship of plague epidemic intensity and the succession of Rattus tanezumi in Yingjiang county of Yunnan province[J]. J Med Pest Control, 2018, 34(11): 1055-1059. DOI:10.7629/yxdwfz201811010 |
| [21] |
赵文红, 郭牧, 段彪, 等. 云南省盈江县印鼠客蚤指数季节消长与鼠疫流行关系[J]. 医学动物防制, 2016, 32(3): 258-260. Zhao WH, Guo M, Duan B, et al. Relationship between the seasonal fluctuation of Xenopsylla cheopis index and plague prevalence in Yingjiang county, Yunnan province[J]. J Med Pest Control, 2016, 32(3): 258-260. DOI:10.7629/yxdwfz201603007 |
| [22] |
高子厚, 董兴齐, 赵文红, 等. 云南盈江县鼠疫宿主动物种群分布和季节消长分析[J]. 医学动物防制, 2008, 24(1): 1-3. Gao ZH, Dong XQ, Zhao WH, et al. Analyzing on the population distribution and seasonal variation of plague host animal in Yingjiang county, Yunnan[J]. J Med Pest Control, 2008, 24(1): 1-3. DOI:10.3969/j.issn.1003-6245.2008.01.001 |
| [23] |
石丽媛, 丁奕博, 谭红丽, 等. 云南省鹤庆县2017年分离鼠疫菌分子溯源[J]. 中华流行病学杂志, 2018, 39(7): 983-987. Shi LY, Ding YB, Tan HL, et al. Source tracing of the Yersinia pestis strains isolated from Heqing county, Yunnan province in 2017[J]. Chin J Epidemiol, 2018, 39(7): 983-987. DOI:10.3760/cma.j.issn.0254-6450.2018.07.022 |
 2023, Vol. 34
2023, Vol. 34


